家蝇抗真菌肽-1A体外抗白念珠菌的细胞内作用机制*
2022-01-21邓思波黄敏慧张迎春吴建伟崔古贞陈峥宏王涛
邓思波,黄敏慧,张迎春,吴建伟,崔古贞,2,陈峥宏*,王涛*
(1.贵州医科大学 基础医学院,贵州 贵阳 550025;2.贵州省普通高等学校病原生物学特色重点实验室,贵州 贵阳 550025)
近年来,抗菌肽(antimicrobial peptides,AMPs)在感染性疾病治疗方面的应用受到了极大关注,其抗微生物作用机制已成为研究焦点[1-2]。研究发现,AMPs不仅能作用于微生物细胞膜,还可以通过诱导活性氧(reactive oxygen species,ROS)产生、损伤细胞的DNA或线粒体等方式导致真菌等微生物细胞破坏[3-9]。家蝇抗真菌肽-1A(Muscadomesticaantifungal peptide-1A,MAF-1A)是由26个氨基酸残基构成的小分子阳离子多肽,其氨基酸序列结构与目前发现的AMPs不同[10]。本课题组前期研究结果显示,MAF-1A具有良好的体外抗白念珠菌(Candidaalbicans,C.albicans)活性,且作用后C.albicans的抗氧化应激相关基因、线粒体相关基因等的表达发生明显变化,表明MAF-1A能进入细胞内发挥抗菌效应,具有多靶点抗C.albicans作用[11-12],但具体的作用机制尚不清楚。因此,本研究旨在探讨MAF-1A对C.albicans细胞内作用机制,为MAF-1A的开发利用提供实验依据、为抗C.albicans药物研发提供作用靶点。
1 材料与方法
1.1 实验材料
1.1.1MAF-1A化学合成 MAF-1A的氨基酸序列为KKFKETADKLIESAK QQLESLAKEMK委托生工生物工程(上海)股份有限公司采用9-芴甲氧羰基(9-fluorenylmethyloxycarbonyl,FMOC)固相合成法合成,高效液相色谱(reversed-phase high-performance liquid chromatography,HPLC)纯化、液相色谱-质谱(liquid chromatography-tandem mass spectrometry,LC-MS)验证,多肽合成纯度≥98%。
1.1.2菌株C.albicans(ATCC10231)由贵州医科大学病原生物学特色重点实验室保存。
1.1.3主要试剂和仪器 沙氏葡萄糖琼脂培养基(sabouraud dextrose agar,SDA)、沙氏葡萄糖肉汤培养基(sabouraud dextrose broth,SDB)、氟康唑(fluconazole,FLC)、活性氧检测试剂盒、维生素C、还原型谷胱甘肽、真菌基因组脱氧核糖核苷酸(deoxyribonucleic acid,DNA)提取试剂盒(北京Solarbio),线粒体膜电位(5,5′,6,6′-tetrachloro-1,1′,3,3′-tetraethyl-imidacarbocyanine iodide,JC-1)测定试剂盒(上海MCE),ND2000超微量紫外分光光度计(美国Nanodrop),SYNERGY荧光多功能酶标仪(贵阳奥秘商贸),IQuant400凝胶成像系统(美国Amersham Pharmacia)。
1.2 实验方法
1.2.1菌株活化及菌悬液制备 无菌操作下取C.albicans冻存物划线接种于SDA平板,置于37 ℃温箱培养18~24 h,SDB培养基制备浓度为2×109cfu/L菌悬液。
1.2.2ROS水平检测 以终浓度为0、625、1 250及2 500 mg/L MAF-1A分别处理C.albicans24 h,以4 mg/L FLC为药物对照,按试剂盒说明加2′,7′-二氯荧光黄双乙酸盐(dichloro-dihydro-fluorescein diacetate,DCFH-DA)荧光试剂,37 ℃避光孵育20 min,无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,多功能酶标仪检测荧光强度(激发波长488 nm,发射波长530 nm)。
1.2.3抗氧化剂对MAF-1A抗C.albicans活性的影响 用不同浓度(0、781 及1 560 mg/L)的维生素C(vitamins C,VC)、还原型谷胱甘肽(glutathione,GSH)预处理C.albicans30 min后,参考美国临床实验室标准化委员会(CLSI)M27-A3方法[13],采用微量稀释法检测MAF-1A的抗C.albicans最小抑菌浓度(minimal inhibit concentration,MIC),以抑制80%C.albicans生长为MIC。
1.2.4线粒体膜电位检测 以终浓度为0、625、1 250及2 500 mg/L的MAF-1A分别处理C.albicans24 h,氧化磷酸化解偶联剂(carbonyl cyanide m-chlorophenylhydrazone,cccp)为阳性对照,按试剂盒说明加JC-1染色工作液,37 ℃避光孵育15 min,无菌PBS洗涤2次,多功能酶标仪检测JC-1的荧光转变,激发波长为485 nm,发射波长由525 nm(绿光,FL1)到590 nm(红光,FL2)转变,通过计算FL2/FL1比值得出线粒体膜电位的变化。
1.2.5MAF-1A与C.albicans脱氧核糖核酸(deoxyribo nucleic acid,DNA)结合的凝胶阻滞分析 参考真菌基因组DNA提取试剂盒说明书提取C.albicans的DNA,并使用超微量紫外分光光度计和琼脂糖凝胶电泳检测所得DNA的浓度和纯度。将DNA溶液与不同浓度的MAF-1A(0、625、1 250 及2 500 mg/L)等体积混合,以无菌超纯水作为对照,各组混合液置于37 ℃孵育6 h,进行琼脂糖凝胶电泳(含0.01核酸染色剂),凝胶成像分析仪观察并拍照。
1.3 统计学分析

2 结果
2.1 细胞内ROS含量
与0 mg/L组相比,不同浓度MAF-1A组C.albicans细胞内ROS量明显增加(P<0.01),且胞内ROS 的含量随着MAF-1A浓度的增加而增加,呈剂量依赖性。见图1。

注:与0 mg/L MAF-1A组比较,(1)P<0.01;(2)P<0.001。
2.2 MIC
结果显示,MAF-1A抗C.albicans的MIC为625 mg/L;抗氧化剂GSH和VC预处理C.albicans30 min,MAF-1A抗C.albicans的MIC升高2倍,由625 mg/L增加到1 250 mg/L,即GSH和VC可使MAF-1A抗C.albicans的活性降低。
2.3 线粒体膜电位
结果显示,与0 mg/L组比较,可见cccp组C.albicans线粒体膜电位明显降低(P<0.001),但不同浓度MAF-1A作用后,C.albicans线粒体膜电位未发生明显的变化(P>0.05)。见图2。
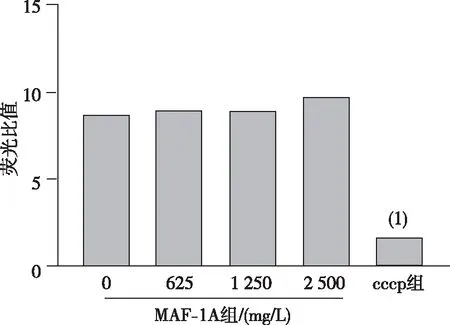
注:(1)与0 mg/L MAF-1A组比较,P<0.001。
2.4 MAF-1A对C.albicans DNA的影响
不同浓度MAF-1A与C.albicansDNA孵育后,可见明显的凝胶阻滞现象,大量DNA被阻滞在凝胶加样孔附近,且DNA电泳条带均出现了一定的滞后现象,并且随着MAF-1A浓度增加,DNA条带亮度减弱。见图3。

注:0为空白对照组;1~4分别为0、625、1 250及2 500 mg/L MAF-1A组。
3 讨论
ROS是生物氧代谢过程中产生的一系列活性氧簇,主要包括超氧阴离子(O-2)、羟基自由基(·OH)、过氧化氢(H2O2)和单线态氧(1O2)等,通常存在于细胞内,当过多的ROS生成时,通常会产生细胞毒性,导致细胞功能异常[14-17]。正常生理状态下,C.albicans细胞内抗氧化防御系统与ROS处于平衡状态,细胞内ROS的水平维持在较低的生理范围,但当胞内产生大量ROS时,大量的ROS能导致蛋白质交联、肽链氧化以及氨基酸侧链可逆或不可逆的氧化,氧自由基反应引起的脂质过氧化可损伤细胞膜,同时也能引起的DNA损伤包括化学结构的改变、单双链的断裂与交叉连接等,进而影响其生理功能[18-22]。有研究发现,某些AMPs能诱导C.albicans细胞内ROS的含量增加,对病原体造成不可逆的损害[23-25]。本实验研究发现,MAF-1A作用后的C.albicans细胞内ROS急剧增加(P<0.01),并呈剂量依赖性,表明MAF-1A可以诱导C.albicans细胞产生ROS;而VC及GSH作用C.albicans后,MAF-1A对C.albicans的抗菌效果明显降低,说明MAF-1A的抗菌作用能被抗氧化剂抑制,以上提示MAF-1A可通过诱导胞质内ROS的产生发挥抗C.albicans活性。
线粒体是真核细胞能量中心,对维持细胞的能量代谢具有重要作用[26-27],而线粒体膜电位的平衡是线粒体正常运行的基本条件之一。有实验研究报道,AMPs可引起线粒体膜电位去极化,导致线粒体功能障碍,功能受损的线粒体可以通过 caspase 等途径引起细胞死亡[23,27]。但本实验结果显示,经MAF-1A作用后,C.albicans菌细胞线粒体膜电位平衡未出现较大的波动(P>0.05),提示C.albicans的线粒体并不是MAF-1A抗菌作用的主要靶点。
研究发现,部分AMPs进入菌体细胞内,能与菌体DNA结合进而影响菌体细胞的正常生理功能,从而达到抑菌效果[28-29]。琼脂糖凝胶阻滞实验常用来考察AMPs与菌体DNA的结合作用,通过分析其电泳迁移率来分析AMPs与菌体DNA的结合情况,若AMPs与C.albicans的DNA发生结合,则其在电泳中的迁移率就会受到影响,即与单独的DNA(0 mg/L)相比,与MAF-1A共孵育的DNA条带出现滞后、变暗淡现象,且在加样孔有DNA滞留,这可能是由于MAF-1A与C.albicans的DNA链结合导致,结果表明MAF-1A进入细胞内后可与菌细胞的DNA结合,提示MAF-1A可通过结合DNA链,干扰DNA的复制等正常生理活动,进而发挥抗C.albicans效果。
综上所述,本研究认为 MAF-1A可能通过诱导C.albicans细胞内ROS的大量产生及与DNA结合作用来发挥细胞内抗C.albicans作用。
