非综合征型耳聋患者遗传性耳聋基因突变位点分析及遗传咨询
2022-01-20贺芳赵明刚李翠拓园王翔
贺芳 赵明刚 李翠 拓园 王翔
(1.西安交通大学第一附属医院转化医学中心·陕西省遗传病诊断中心,陕西 西安 710061;2.北京安博迪恩生物技术有限公司,北京 100000)
耳聋是最常见的出生缺陷之一,截止2017年12月31日,全国残疾人人口基础库主要数据显示(http://www.cdpf.org.cn/),陕西省总残疾人1298496,占全国总残疾人的3.8%,其中听力言语残疾占总残疾人数的11.7%。耳聋与诸多因素有关,如遗传、感染、噪声、创伤、耳毒性药物等,最主要因素为遗传和环境,前者占50%以上,约70%的遗传性耳聋为非综合征型聋(Nonsyndromic hearing loss,NSHL)[1]。截止2020年2月5日,已确定的非综合征性听力损失基因多达123个(https://he-reditaryhearingloss.org/),且具有高度的遗传异质性及表型多样性。目前,我国遗传性耳聋研究多集中于新发突变位点的发现[2]与孕妇及新生儿的常见遗传性耳聋基因筛查上[3-4]。在以下方面尚存在不足:①对非综合征性耳聋患者的基因研究较少。②缺乏针对不同人群,不同地域进行个性化遗传性耳聋筛查策略。③临床耳聋遗传咨询工作尚缺乏落地有效个性化遗传咨询策略及方法。鉴于以上,本研究选取西安地区的246例耳聋患者进行相关遗传性耳聋基因筛查,以摸索出更适合西安地区非综合征聋人群体的基因筛查策略,并根据结果对不同个体提供个性化的遗传咨询。
1 对象与方法
1.1 对象 选取西安市一所聋哑学校、一所聋哑协会2014年11月~2018年3月遗传咨询门诊接诊的非综合征型耳聋患者,共计246例。患者3~64岁,平均(23.8±8.1)岁;男性125例,女性 121例;按照医院伦理委员会管理规定由患者监护人(18岁以下)或本人签署知情同意书后,采集静脉血2mL,EDTA管抗凝,-20℃保存,备用。
1.2 检测内容 依据微阵列芯片杂交技术,对人群中常见的4个基因GJB2、SLC26A4、线粒体12sRNA、GJB3,9个突变位点:235delC、35delG、176del16、299delAT、2168A>G、IVS7-2、1494C>T、1555A>G、538C>T进行基因筛查。GJB2、SLC26A4基因全外显子测序。
1.3 DNA的提取 根据DNA提取试剂盒(康为CW5044S)中的操作流程,提取耳聋患者外周血标本中DNA,用核酸蛋白浓度分析仪SmartSpec Plus(Bio-Rad,美国)检测DNA质量 (浓度80~180 ng/μL、OD值1.7~2.0),放入-20℃冰箱,待用。
1.4 PCR扩增 在PCR试剂准备区,按照9项遗传性耳聋基因检测试剂盒(微阵列芯片法)配置PCR体系、进行扩增。
1.5 杂交及其芯片扫描 在PCR产物分析区,将14.5μL杂交混合液加入芯片点样孔中,封闭杂交盒,60℃孵育1 h。之后在芯片洗干仪(晶芯®SlideWasherTM,博奥)中洗涤并甩干芯片,于微阵列芯片扫描仪(晶芯®LuxScanTM10K/B,博奥)中进行芯片扫描。
1.6 家系调查分析及遗传咨询 对基因芯片检出为阳性的患者,建议其父母及兄弟姐妹进行此项筛查。对杂合突变及野生型个体,建议其行相关突变基因的全外显子测序,同时针对以上结果,制作遗传性耳聋基因识别卡片,为不同个体提供个性化遗传咨询。
1.7 统计学分析 数据采用SPSS 19.0软件进行统计分析。利用Deaftest系统对芯片扫描结果进行分析。同时运用EXCEL2007建立患者的信息数据库。
2 结果
2.1 224例耳聋患者以GJB2和SLC26A4基因突变为主 本研究对246例耳聋患者进行遗传性耳聋基因筛查,在筛查的4个常见突变基因中,分别检出GJB2和SLC26A4基因突变43例(17.48%)、35例(14.23%)。发现线粒体12SrRNA突变7例(2.85%),且均为1555A>G均质突变。GJB3基因未检出突变,见图1。
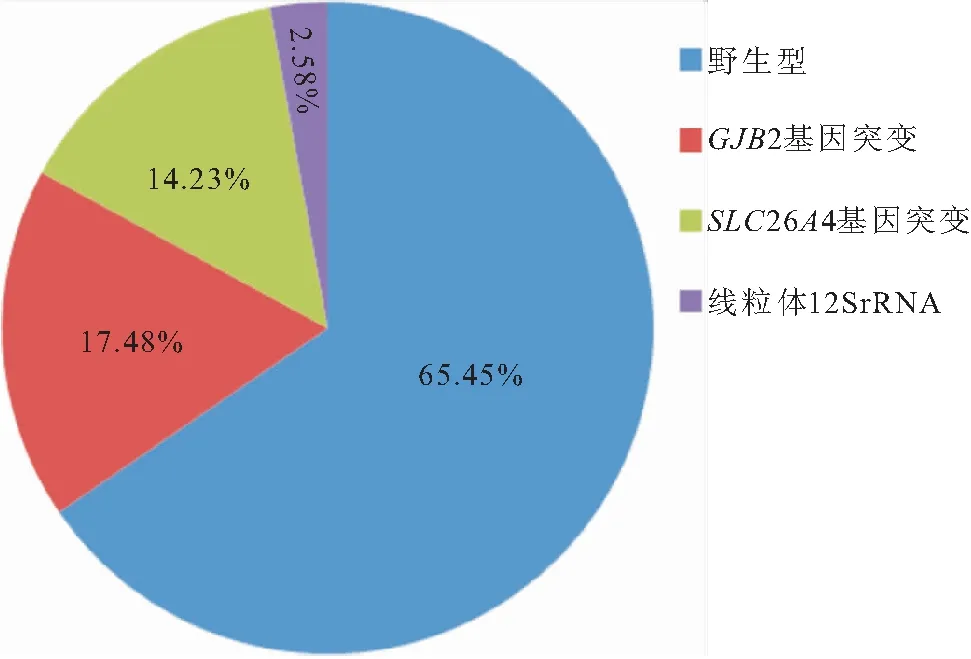
图1 246例聋哑患者遗传性耳聋基因突变的发生率
2.2GJB2和SLC26A4基因突变位点的多样性 在检出的43例GJB2基因突变患者中,存在9种突变类型(表1),其中纯合及复合杂合突变26例(60.47%),杂合突变17例(39.53%)。另在35例SLC26A4基因突变个体中,检出5种突变类型,其中纯合及复合杂合突变12例(34.29%),杂合突变23例(65.71%)。
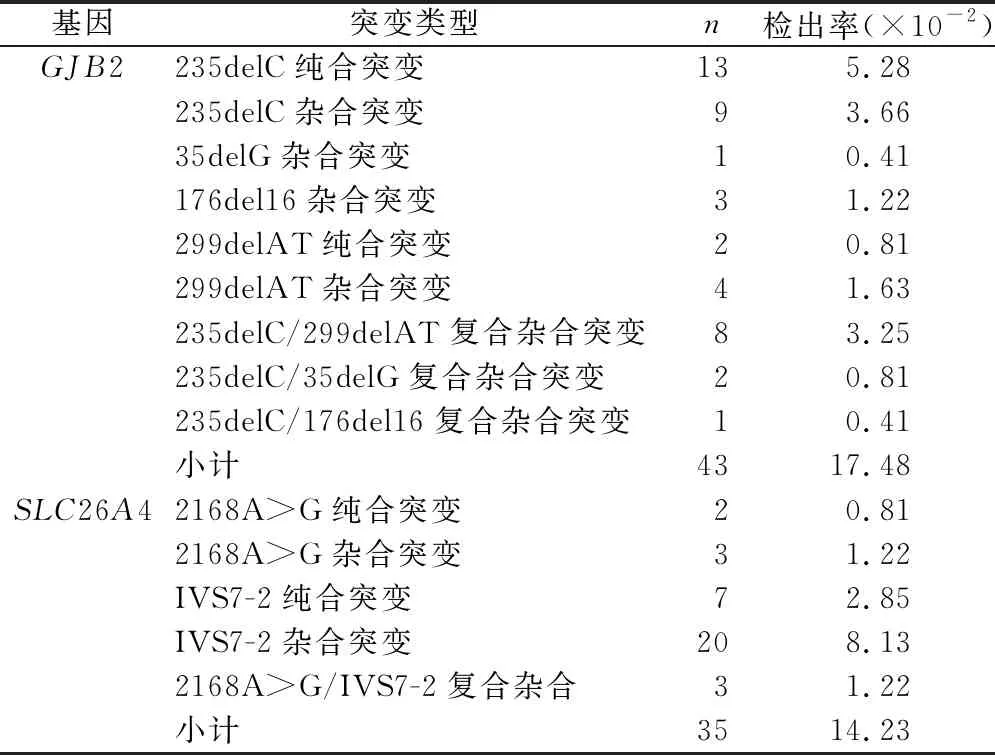
表1 GJB2和SLC26A4基因突变位点检出率
2.3 家系调查结果以GJB2和SLC26A4基因突变携带者为主 对17个家系中的56人进行了遗传性耳聋基因筛查,发现在39例家系成员中,GJB2、SLC26A4基因突变携带者占比48.72%(19/39)。GJB2基因突变频率35.90%(14/39),其中以235delC、 299delAT突变为主;SLC26A4基因突变频率为20.51%(8/39),其中以IVS7-2A>G、2168A>G突变为主。另检出1例线粒体12sRNA1555均质突变型成员,见表2。

表2 17个家系56例成员的家系调查结果
2.4GJB2和SLC26A4基因全外显子测序分析,除检出基因芯片包含突变位点外,还额外发现GJB2基因突变位点。在遗传咨询中,结合咨询者的愿望及需求,对两对欲生育正常听力后代的年轻聋哑夫妇,两个已育有聋儿的家庭(欲再生育听力正常后代),和2例芯片筛查为野生型的耳聋患者,共12人进行了GJB2和SLC26A4基因全外显子序列分析,并将测序结果与基因芯片结果进行比对(表3),在基因芯片检测范围内,GJB2和SLC26A4基因全序列分析结果与之一致。另有4例耳聋患者在GJB2基因的c.605ins46,c.79G>A,c.341A>G,c.257C>G,c.109G>A位点发生突变。

表3 12例样本基因芯片结果及GJB2和SLC26A4基因全外显子序列分析结果
2.5 遗传咨询 针对以上结果,为患者提供遗传性耳聋基因识别卡片(图2),为不同需求的患者提供婚育、用药、治疗、预防等个性化遗传咨询。

图2 遗传性耳聋基因识别卡片
3 讨论
在我国GJB2,SLC26A4,mtDNA12SrRNA基因是遗传性聋高发的基础,这些致聋基因所致的遗传性聋有着较高的发病率[5-6], 但也存在地域差异[7-10]。在对西北地区耳聋患者的基因筛查中[11],发现GJB2、SLC26A4基因的突变频率分别为16.12%、10.54%,其中以235delC突变最为常见,占GJB2突变等位基因的65.71%。而在福建省107例非综合征听力损失人群基因检测研究中[12],GJB2基因突变占17.76%,其中以235delC、299delA为主。河南地区遗传性耳聋基因筛查数据显示[13],GJB2基因突变频率28.46%,SLC26A4基因突变频率为 20.77%。本研究中,西安市246例非综合征型耳聋患者遗传性耳聋基因筛查数据显示,GJB2和SLC26A4基因突变发生率分别为17.48%、14.23%,而GJB2基因突变中发生率较高的位点有:235delC、299delA;SLC26A4基因突变发生率较高的位点有2168A>G、IVS7-2。该数据略高于西北地区GJB2、SLC26A4基因的突变频率,与福建省筛查数据相近,低于河南省GJB2、SLC26A4基因的突变频率。2019年,国内已出台了针对孕妇和新生儿的遗传性耳聋基因变异筛查技术专家共识[14],而针对非综合征性耳聋患者的基因突变筛查并未制定,本研究可为完善该人群聋病基因筛查提供一定的数据支持。
本研究对12例样本GJB2和SLC26A4基因的全序列分析与基因芯片结果对比后发现,在基因芯片检测范围内,测序结果与之一致。另外在检测范围之外,有4例患者存在其他突变类型,分别为:c.235delC/ c.605ins46复合杂合突变、c.235delC杂合/c.79G>A杂合/c.341A>G杂合、c.GJB2 257C>G/ c.299delAT复合杂合突变、c.GJB2 109G>A纯合突变。分析以上额外发现的突变位点后,发现曾在2004年的学术交流会中,有报道过一例新生儿GJB2基因c.235delC/c.605ins46突变[15],但对c.605ins46的致病性之后鲜少报道。2018年,在一个中国家庭中,发现c.257C>G/c.176del16复合杂合突变,而提出该位点的突变可能与该家系的听力损失有关[16]。c.109G>A,c.79G>A,c.341A>G,突变在非综合征型聋人中的发生频率远高于正常听力人群,在流行病学意义上属于致聋的危险因素[17-19],可作为人群针对性的耳聋基因检测在临床上予以重视。总之,以上位点的额外检出,可以为其致病基因位点研究提供临床数据。同时,这也提示基因芯片筛查在检测内容上存在局限性,针对耳聋人群在排除遗传因素致病方面应尽可能选择位点更多,范围更广的检测手段。但聋病基因筛查的大范围推广还有赖于较低的筛查成本,因此在西安地区,相较成本较高的基因全外显子序列分析技术,基因芯片筛查以高通量、低成本、高准确率为特征,适时的选择两者的结合在临床应用中为一种更好的策略。
在我国聋人群体中,聋聋结合是最常见的婚配模式。根据前期调查,21%聋人夫妇因相同基因突变致聋,其后代发生聋病几率达100%,且无法通过产前诊断或者胚胎植入前诊断预防。遗传性耳聋因其高度遗传异质性、表型多样性[20],而使临床遗传咨询具有高度复杂性。本研究针对不同个体提出了个性化的遗传咨询策略,为临床遗传性耳聋患者的遗传咨询提供了参考数据:①本研究中,表3中的聋儿家庭1,夫妇耳聋基因筛查均为GJB2 235delC杂合突变,育有一子,基因筛查结果为GJB2 235delC纯合突变。该对夫妇欲再生育听力正常后代,后行GJB2基因全序列分析显示,父亲GJB2基因c.235delC, c.79G>A, c.341A>G位点均存在杂合突变。鉴于以上,该对夫妇生育耳聋及携带者后代的风险较高,建议其借助辅助生殖技术,达到生育听力正常后代的愿望。②1例耳聋患儿(表2,家系15),6岁,五年前发现听力进行性下降,3岁多时植入人工耳蜗,现语言发育可,基因筛查显示为SLC26A4基因IVS7-2A>G/2168A>G复合杂合突变,家系调查发现其母亲为SLC26A4 2168A>G杂合突变,父亲为SLC26A4 IVS7-2A>G杂合突变,遗传咨询中告之其再生育耳聋后代的风险为25%。随访中得知该母亲已孕21周,随建议其对胎儿进行遗传性耳聋基因的产前诊断,结果显示胎儿仍为“SLC26A4基因IVS7-2A>G/2168A>G复合杂合突变”,进行过详细的遗传咨询后,该对夫妇自愿选择终止妊娠,有效避免了聋儿的出生。③线粒体基因1555A>G和1494C>T的突变,可导致药物敏感性耳聋,携带该位点突变的个体,对氨基糖苷类药物(如:庆大霉素、链霉素、卡那霉素及丁胺卡那霉素等)异常敏感,通常很小的使用剂量就可能导致耳聋症状的出现。因此在本研究中,对检出的7例1555A>G均质突变个体,均发放“遗传性耳聋基因识别卡片”,嘱其在以后就诊时主动向医师出示该卡片,以避免相关药物的使用。同时追踪母系成员,进行用药指导,以实现聋病的一级预防。④在门诊咨询中,对确诊为遗传性耳聋的患者或携带者,在择偶时应指导其避免选择与自己相同耳聋基因突变的聋哑人或携带者(如图2所示与自己相同卡片的人),这样可避免大部分聋聋婚配家庭生育聋病后代,实现耳聋的二级预防。
4 结论
本研究通过对西安地区246例非综合征性耳聋患者行遗传性耳聋基因筛查及后续个性化分析,在以下方面弥补了目前临床上存在的不足:①选取非综合征性耳聋患者进行基因相关研究,很好的扩充了该部分人群的遗传性耳聋基因研究数据。②针对西安地区,结合经济成本的考虑,非综合征性耳聋患者应以常见位点基因筛查为基础,辅以深度测序技术的应用,将在突变位点的诊断上有所提高。③临床耳聋遗传咨询,应结合基因检测结果,以患者愿景为前提,在婚育、孕产、用药等方面,制定个性化的遗传咨询策略,提出落地有效的实施方法,将三级预防方针渗透到遗传咨询的过程中。
