Linc01135对过氧化氢作用的成骨细胞增殖分化及氧化应激损伤的影响
2022-01-20吴文明赵汝岗张强
吴文明 赵汝岗 张强
(首都医科大学附属北京地坛医院骨科,中国 北京 100015)
骨质疏松症是一种以骨量减少,骨质量受损及骨强度降低,导致骨脆性增加、易发生骨折为特征的全身代谢性骨病。由于人口老龄化,骨质疏松症的发生率逐渐增加[1-2]。因此,需探讨骨质疏松症发生、发展的作用机制,寻找治疗骨质疏松症的新策略。氧化应激在骨质疏松症中发挥重要作用,影响骨形成相关细胞的增殖分化,进而影响骨质疏松的发生、发展。因此,抗氧化应激对预防骨质疏松症具有重要意义[3-4]。lncRNA与骨质疏松密切相关,还参与调控骨代谢相关信号通路,将可为骨质疏松症诊断、治疗及判断预后提供新的靶向目标[5-6]。有研究报道,人炎症牙周膜干细胞中Linc01135表达降低,上调Linc01135可促进人炎症牙周膜干细胞在12%静态牵张力作用下的成骨分化[7]。然而Linc01135对成骨细胞增殖分化及氧化应激的影响及机制尚不清楚。丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路参与骨质疏松的发生与发展,p38MAPK是MAPK信号通路的一种,p38MAPK可以通过磷酸化相关成骨转录因子调控成骨细胞基因的表达,进而影响其功能[8-9]。活化p38 MAPK通路促进骨髓间充质干细胞向成骨细胞转化[10]。葛根素通过激活细胞外调节蛋白激酶(Extracellular regulated protein kinases,ERK)1/2和p38MAPK信号通路刺激成骨分化和骨形成[11]。但p38MAPK信号通路对成骨细胞氧化应激损伤的影响尚不清楚。本研究用过氧化氢作用的成骨细胞,以模拟体外骨质疏松的病理环境,旨在探讨Linc01135对过氧化氢作用的成骨细胞增殖分化及氧化应激损伤的影响及其机制是否与p38 MAPK信号通路有关。
1 材料与方法
1.1 材料 人成骨细胞hFOB 1.19购自上海晅科生物科技有限公司;RPMI-1640培养基、胎牛血清、双抗购自美国Hyclone公司;p38MAPK抑制剂(SB203580)购自北京百奥莱博科技有限公司;MTT试剂盒、Annexin V-FITC/PI凋亡检测试剂盒购自厦门研科生物技术有限公司;RIPA蛋白裂解液、二辛可宁酸(BCA)试剂盒、SDS-PAGE试剂盒购自碧云天生物技术研究所;超氧化物歧化酶(Superoxide dismutase,SOD)、总抗氧化能力(Total antioxidantcapacity,T-AOC)、丙二醛(Malonaldehyde,MDA)试剂盒购自南京建成生物工程研究所;荧光定量RT-qPCR试剂盒购自上海经科化学科技有限公司。
1.2 细胞处理与分组 人成骨细胞hFOB 1.19用含15%胎牛血清和双抗的RPMI-1640培养基培养在37℃,含5% CO2的细胞培养箱中。将其分为Con组、H2O2组、H2O2+pcDNA组、H2O2+pcDNA-Linc01135组及H2O2+pcDNA-Linc01135+SB203580组。正常培养的细胞作为Con组;0.1 mmol/L H2O2处理的细胞作为H2O2组,将pcDNA、pcDNA-Linc01135分别转染至hFOB 1.19中,再用0.1 mmol/L H2O2处理,记为H2O2+pcDNA组和H2O2+pcDNA-Linc01135组;将pcDNA-Linc01135转染至hFOB 1.19中,再加入10 μM SB203580和0.1 mmol/L H2O2处理,记为H2O2+pcDNA-Linc01135+SB203580组。
1.3 MTT法检测细胞活力 各组细胞培养48 h,加入20 μL的MTT溶液,继续培养4 h,加入DMSO,振荡反应10 min,用酶标仪检测波长490 nm处吸光度(OD)值,即代表细胞活力。
1.4 流式细胞仪检测细胞周期 收集细胞,用预冷的PBS洗涤3次,离心弃上清;重悬细胞后加入预冷的80%乙醇,4℃固定过夜;PBS洗涤3次,加入核糖核酸酶A(RNase A),37℃孵育30 min,加入碘化啶(PI)染色液,4℃染色15 min,上机检测激发波长488 nm处红色荧光,用流式细胞仪和DNA细胞周期分析软件对细胞周期进行分析。
1.5 蛋白质印迹(Western blot)法检测Runx2、OCN、Cleaved-caspase3、Pro-caspase3、p-p38MAPK蛋白表达 提取各组细胞总蛋白,用BCA试剂盒进行定量。各组蛋白经SDS-PAGE后,转移至PVDF上。用5%脱脂牛奶封闭,加入一抗4℃孵育过夜,加入二抗室温孵育2 h,暗室中曝光显影,定影,用Quantity One软件测定各组蛋白条带灰度值,以目的条带和GAPDH条带的比值作为蛋白表达水平。
1.6 流式细胞术检测细胞凋亡 取各组培养48 h的细胞,用冷PBS漂洗2次,加入10 μL的Annexin V-FITC,再加入5 μL的PI,混匀后避光孵育10 min;用流式细胞仪检测细胞凋亡率。
1.7 SOD活性、T-AOC及MDA含量的检测 细胞培养48 h后,收集各组细胞及细胞培养上清液,按试剂盒说明书进行操作。
1.8 实时荧光定量PCR(RT-qPCR)检测Linc01135表达水平 各组细胞培养48 h后提取细胞总RNA,反转录成cDNA,Linc01135以β-actin为内参进行PCR扩增,相对表达量采用2-△△Ct法计算。Linc01135上游引物序列:5′-CTCATAAATACATA CAGCCCAC-3′,下游引物序列:5′-GAGATTCCTCA TAGAAATAGCC-3′;β-actin上游引物序列:5′-CTA CAATGAGCTGCGTGTGG-3′,下游引物序列:5′-A AGGAAGGCTGGAAGAGTGC-3′。
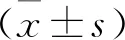
2 结果
2.1 Linc01135对过氧化氢作用的成骨细胞增殖分化的影响 与Con组相比,H2O2组和H2O2+pcDNA组细胞OD值降低,G0-G1期细胞所占比例升高,S期细胞所占比例降低,Runt相关基因2(Runx2)、骨钙素(OCN)蛋白表达水平降低(均P<0.05);与H2O2组和H2O2+pcDNA组相比,H2O2+pcDNA-Linc01135组细胞OD值升高,G0-G1期细胞所占比例降低,S期细胞所占比例升高,Runx2、OCN蛋白表达水平升高(均P<0.05),见图1、表1。
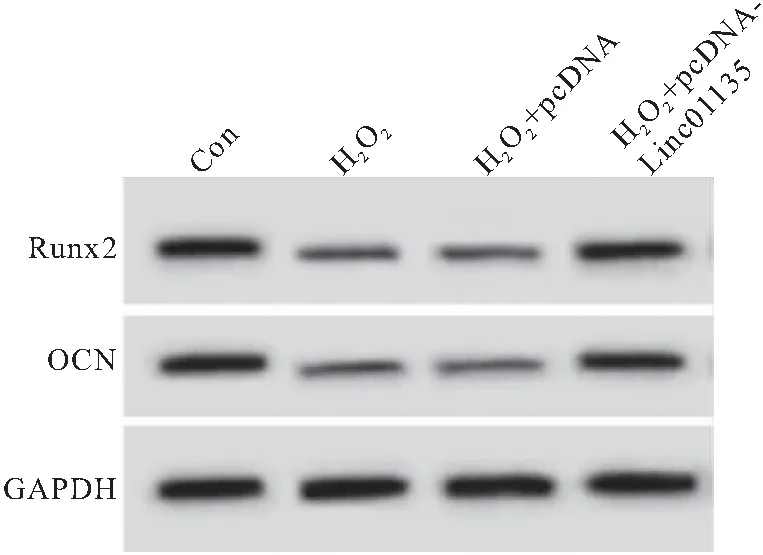
图1 Linc01135对过氧化氢作用的成骨细胞中Runx2、OCN蛋白表达的影响

表1 Linc01135对成骨细胞增殖分化的影响
2.2 Linc01135对过氧化氢作用的成骨细胞氧化应激损伤的影响 与Con组相比,H2O2组和H2O2+pcDNA组细胞凋亡率升高,活化的半胱氨酸天冬氨酸蛋白酶-3(Cleaved-caspase3)表达水平升高,caspase3前体(Pro-caspase3)表达水平降低,T-AOC及SOD活性降低,MDA含量升高(均P<0.05);与H2O2组和H2O2+pcDNA组相比,H2O2+pcDNA-Linc01135组细胞凋亡率降低,Cleaved-caspase3表达水平降低,Pro-caspase3表达水平升高,T-AOC及SOD活性升高,MDA含量降低(均P<0.05),见图2、表2。

表2 Linc01135对成骨细胞氧化应激损伤的影响
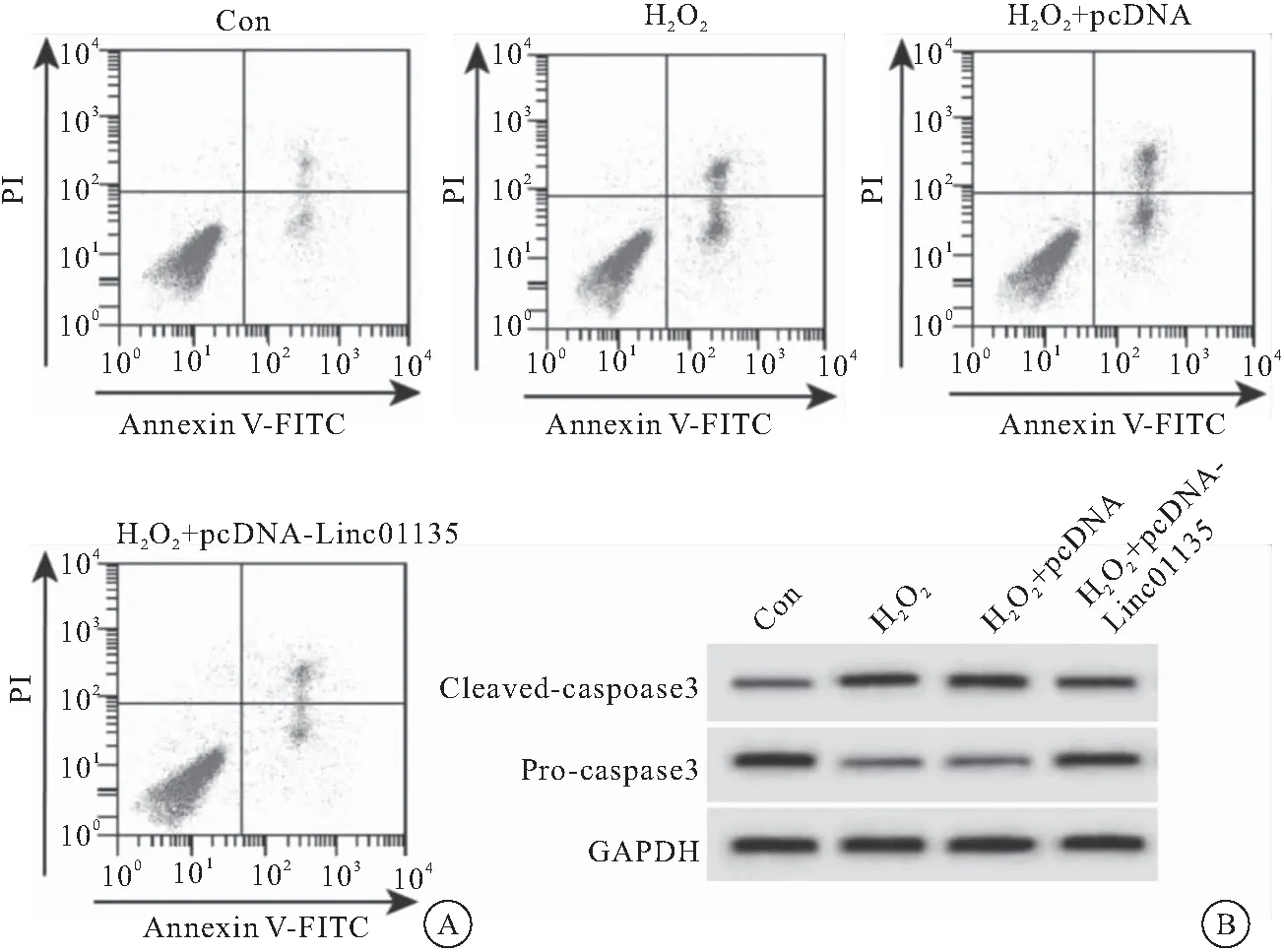
图2 Linc01135对过氧化氢作用的成骨细胞凋亡及caspase3蛋白表达的影响
2.3 Linc01135对过氧化氢作用的成骨细胞中p38MAPK信号通路的影响 与Con组相比,H2O2组和H2O2+pcDNA组Linc01135表达水平降低,p-p38MAPK蛋白表达水平降低(均P<0.05);与H2O2组和H2O2+pcDNA组相比,H2O2+pcDNA-Linc01135组Linc01135表达水平升高,p-p38MAPK蛋白表达水平升高(均P<0.05),见图3、表3。

表3 Linc01135对成骨细胞p38MAPK信号通路的影响

图3 p-p38MAPK蛋白的表达
2.4 p38MAPK信号通路阻断剂可减弱Linc01135对过氧化氢作用的成骨细胞增殖分化的影响 与H2O2+pcDNA-Linc01135组相比,H2O2+pcDNA-Linc01135+SB203580组细胞OD值降低,G0-G1期细胞所占比例升高,S期细胞所占比例降低,Runx2、OCN蛋白表达水平降低(均P<0.05),见图4、表4。
图4 SB203580可减弱Linc01135成骨细胞中Runx2、OCN蛋白表达的影响

表4 SB203580可减弱Linc01135成骨细胞增殖分化的影响
2.5 p38MAPK信号通路阻断剂可减弱Linc01135对过氧化氢作用的成骨细胞氧化应激损伤的影响 与H2O2+pcDNA-Linc01135组相比,H2O2+pcDNA-Linc01135+SB203580组细胞凋亡率升高,Cleaved-caspase3表达水平升高,Pro-caspase3表达水平降低,T-AOC及SOD活性降低,MDA含量升高(均P<0.05),见图5、表5。
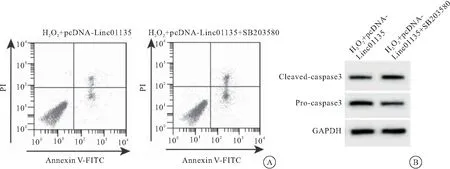
图5 SB203580可减弱Linc01135成骨细胞凋亡及caspase3蛋白表达的影响

表5 SB203580可减弱Linc01135成骨细胞氧化应激损伤的影响
3 讨论
骨质疏松是一种全身性骨骼疾病,骨形成不足或骨量丢失是其发病的重要原因,成骨细胞是骨形成的重要细胞,增强成骨细胞的骨形成是治疗骨质疏松症的理想策略[12]。骨量的丢失与氧化应激有关,且氧化应激可抑制成骨细胞分化,促进骨质疏松的发展[13-14]。过氧化氢可诱导成骨细胞凋亡和功能障碍,造成氧化损伤[15-16]。本实验用过氧化氢作用成骨细胞后细胞OD值降低,G0-G1期细胞所占比例升高,S期细胞所占比例降低,Runx2、OCN蛋白表达水平降低,细胞凋亡率升高,Cleaved-caspase3表达水平升高,Pro-caspase3表达水平降低,T-AOC及SOD活性降低,MDA含量升高。Runx2和OCN是成骨细胞活性及分化的指标,其高表达促进成骨分化[17-18]。SOD是抗氧化酶,可减轻氧化应激反应;MDA是脂质过氧化的终产物,其含量可反应细胞氧化应激水平[19]。本研究结果表明,过氧化氢可抑制成骨细胞增殖、分化,诱导细胞凋亡和氧化应激,体外骨质疏松模型建立成功。
lncRNA参与骨质疏松的发展过程,影响成骨细胞增殖分化等,如lncRNA NEAT1可抑制成骨细胞分化诱发骨质疏松[20]。lncRNA AK045490通过β-catenin/T细胞因子1(T cell factor-1,TCF1)/Runx2信号轴促进成骨细胞分化和骨形成[21]。上调Linc01135可促进人炎症牙周膜干细胞成骨分化[7]。本实验结果显示,过氧化氢作用的成骨细胞中Linc01135表达水平降低,过表达Linc01135后成骨细胞中细胞OD值升高,G0-G1期细胞所占比例降低,S期细胞所占比例升高,Runx2、OCN蛋白表达水平升高,细胞凋亡率降低,Cleaved-caspase3表达水平降低,Pro-caspase3表达水平升高,T-AOC及SOD活性升高,MDA含量降低。这表明过表达Linc01135可促进成骨细胞增殖、分化,抑制过氧化氢诱导的成骨细胞凋亡和氧化应激损伤。
细胞松弛素D可上调Runx2、OCN和OSX的表达,通过p38-MAPK信号通路促进MC3T3细胞的成骨分化[22]。淫羊藿次苷Ⅱ可通过p38MAPK信号通路促进成骨细胞分化[23]。柠檬烯通过激活p38MAPK和蛋白激酶B(Protein kinase B,AKT)信号通路诱导成骨细胞分化和葡萄糖摄取[24]。以上研究表明,激活p38MAPK信号通路可促进成骨细胞分化。有研究报道,lncRNA MALAT1可通过p38MAPK途径促进人晶状体上皮细胞的凋亡和氧化应激[25]。本实验结果显示,过氧化氢作用的成骨细胞中p-p38MAPK蛋白表达水平降低,过表达Linc01135可提高p-p38MAPK蛋白表达水平,表明过表达Linc01135可能活化p38MAPK信号通路。本实验还发现,p38MAPK信号通路阻断剂可减弱Linc01135对过氧化氢作用的成骨细胞增殖分化及氧化应激损伤的影响。Linc01135可能通过p38MAPK信号通路影响成骨细胞增殖分化及氧化应激。
4 结论
过表达Linc01135可能通过激活p38MAPK信号通路促进成骨细胞增殖、分化,抑制过氧化氢作用的成骨细胞凋亡及氧化应激损伤。
