miR-16-5p靶向PTEN/PI3K/AKT信号通路对非小细胞肺癌细胞活性和迁移能力的影响*
2022-01-20陈民彪蔡仁中黄明芳黄修明廖绪强
陈民彪 蔡仁中 黄明芳 黄修明 廖绪强
(海南省人民医院·海南医学院附属海南医院胸外科,海南 海口 570311)
肺癌是常见的恶性肿瘤之一,以非小细胞肺癌(Non-samll cell lung cancer,NSCLC)发病率最高,占肺癌发病率的80%以上[1-3]。目前,NSCLC的临床治疗主要以手术切除、化疗、放疗为主,但预后不理想[4-6]。MicroRNA(miRNA)是一类内源性表达的非编码小分子RNA,长度约为22个核苷酸,能通过与靶基因相互作用调节基因表达,其失调涉及癌细胞的各个方面,包括细胞的生长、凋亡、增殖、迁移和侵袭等过程[7-8]。蛋白酪氨酸磷酸酶基因(PTEN)是近年被发现的包括NSCLC在内的各种癌症类型中众所周知的肿瘤抑制因子,通过介导磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase, PI3K)/丝氨酸-苏氨酸激酶(Protein kinase B, AKT)信号通路的活化,与癌症进展密切相关[9]。miR-16-5p在NSCLC中低表达,其被认为是NSCLC的抑癌基因。因此,本研究旨在探讨NSCLC中低表达的miR-16-5p对A549细胞活性、迁移和PTEN/PI3K/AKT信号通路的影响。
1 材料与方法
1.1 细胞株和主要材料 人源性NSCLC A549细胞株购自中科院上海细胞库;TRIzol和LipofectamineTM2000转染试剂购自Invitrogen公司(美国);AS-miR-16-5p及miR-NC序列的设计合成委托上海康成生物工程有限公司(中国);含双抗的RPMI 1640培养基购自Invitrogen公司(美国);胎牛血清购自Hyclone公司(美国);MTT试剂购自Sigma公司(美国);Transwell小室购自Millipore公司(美国);PTEN抗体、p-AKT抗体PI3K抗体购自Invitrogen公司(美国)。
1.2 细胞培养 A549细胞培养于含10%胎牛血清RPMI 1640培养基中,置于37 ℃、5% CO2的培养箱内培养并进行传代。取传代后对数期细胞用于后续实验。
1.3 细胞转染 收集A549细胞接种于6孔板中,分为Blank组、miR-NC组和AS-miR-16-5p组。根据LipofectamineTM2000说明书,在无血清RPMI 1640培养基中转染miR-NC和AS-miR-16-5p质粒。在转染6 h后,培养基替换为含10%胎牛血清的RPMI 1640培养基培养48 h。收获细胞用于qRT-PCR分析。
1.4 qRT-PCR检测 TRIzol试剂提取细胞mRNA,根据反转录试剂盒步骤合成cDNA,然后扩增目的基因,检测miR-16-5p表达水平。
1.5 MTT检测 将每组A549细胞以每孔2×104个细胞接种在96孔板,置于37 ℃培养箱中分别培养至24、48、72、96 h,然后小心弃掉上清液。每孔中加入20 μL MTT溶液,并在培养箱中孵育4~6 h,然后小心弃掉上清液。每孔中加入150 μL DMSO溶液,避光震荡10 min,通过酶标仪测定A549细胞在570 nm波长时的吸光度(OD值)。
1.6 细胞划痕实验 将每组A549细胞接种于6孔板,待细胞融合度达到90%时,使用无菌移液器在细胞上进行垂直刮擦,然后将培养板用PBS洗涤2次,然后加入含10%胎牛血清的RPMI 1640培养基培养24 h后拍照。
1.7 Transwell实验 将每组A549细胞接种于24孔板中Transwell上室中,将500 μL含10%胎牛血清的RPMI 1640培养基加入下室中,37℃培养箱中培养细胞24 h。4%多聚甲醛固定后去除上室细胞,用0.1%结晶紫染色,通过酶标仪测定A549细胞在570 nm波长时的吸光度(OD值)。
1.8 蛋白质印迹法 收集每组A549细胞并用PBS洗涤3次。RIPA裂解缓冲液提取细胞的总蛋白,并通过BCA法进行蛋白定量。对总蛋白(25 μg蛋白/泳道)进行SDS-PAGE凝胶电泳,然后将蛋白转移到PVDF膜上,5%脱脂牛奶封闭2 h。将膜与一抗在4℃孵育过夜,然后与二抗在室温孵育1 h。使用ECL发光剂显影并通过软件进行定量。
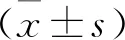
2 结果
2.1 AS-miR-16-5p对NSCLC A549细胞miR-16-5p表达水平的影响 与Blank组、miR-NC组相比,AS-miR-16-5p组miR-16-5p表达水平下降(P<0.05);Blank组与miR-NC组相比,差异无统计学意义(P>0.05);表明AS-miR-16-5p抑制miR-16-5p在NSCLC A549细胞的表达,见图1。
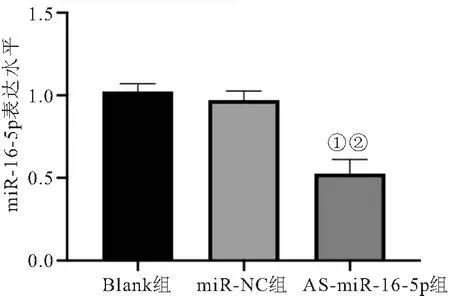
图1 AS-miR-16-5p对NSCLC A549细胞miR-16-5p表达水平的影响
2.2 AS-miR-16-5p对NSCLC A549细胞活性的影响 与Blank组、miR-NC组比较,AS-miR-16-5p组细胞活性降低(P<0.05);Blank组与miR-NC组比较,差异无统计学意义(P>0.05);表明AS-miR-16-5p显著抑制NSCLC A549细胞的活性,见图2。

图2 AS-miR-16-5p对NSCLC A549细胞活性的影响
2.3 AS-miR-16-5p对NSCLC A549细胞迁移能力的影响 细胞划痕实验结果显示,经处理24 h后,AS-miR-16-5p组较同期Blank组和miR-NC组细胞愈合率降低(P<0.05),见图3。此外,Transwell实验结果显示,AS-miR-16-5p组较同期Blank组和miR-NC组细胞迁移能力降低(P<0.05),表明AS-miR-16-5p对NSCLC A549细胞的迁移能力具有明显的抑制作用,见图4。
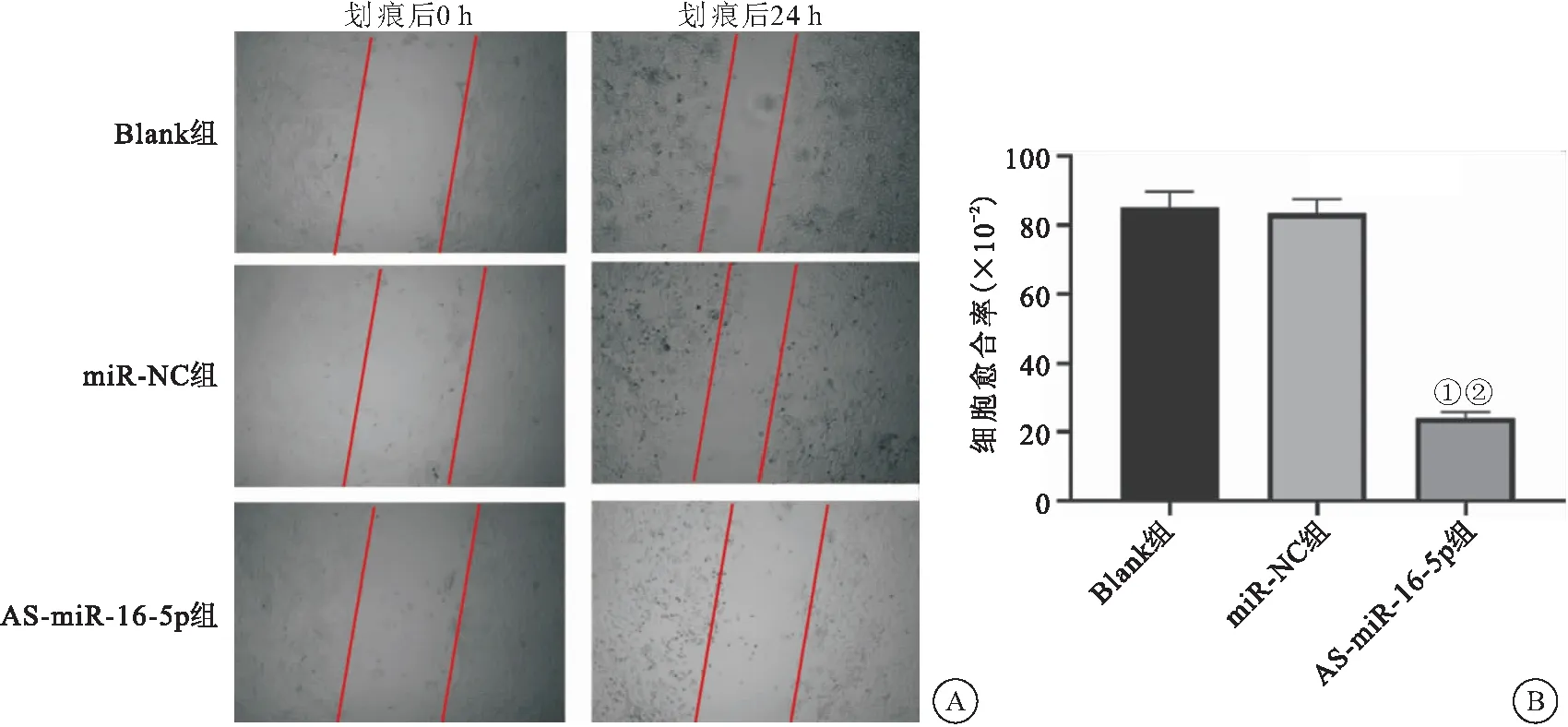
图3 AS-miR-16-5p对NSCLC A549细胞愈合率的影响
图4 AS-miR-16-5p对NSCLC A549细胞迁移能力的影响(×200)
2.4 AS-miR-16-5p对PTEN/PI3K/AKT通路蛋白表达的影响 与miR-NC组和Blank组相比,AS-miR-16-5p组PTEN蛋白表达显著升高(P<0.05);相反,PI3K和p-AKT蛋白表达显著下降(P<0.05);表明AS-miR-16-5p调节PTEN/PI3K/AKT通路蛋白表达,见图5。

图5 AS-miR-16-5p对PTEN/PI3K/AKT通路蛋白表达的影响
3 讨论
NSCLC是一种常见的呼吸系统恶性肿瘤,其发病率和死亡率逐年增加,占肺癌的总发病率80%左右[10-11]。miRNA是由19-24个核苷酸组成的内源性非编码RNA,与靶标mRNA的5′-URT或3′-UTR互补位点结合以调节靶标基因的表达,并进一步抑制翻译和降解靶标基因。目前发现的miRNAs达1000余种,在癌症的疾病进程中呈现高表达或低表达,发挥癌基因或抑癌基因的作用。miR-16-5p是miRNA-16家族中的一个亚型,现已明确miR-16-5p是一种抑癌基因,在肿瘤的发生、发展过程中具有调节细胞增殖、迁移和侵袭的能力[12-14]。在这项研究中,发现转染细胞中AS-miR-16-5p表达降低。靶向PTEN/PI3K/AKT信号通路的AS-miR-16-5p通过调节细胞活性和迁移对NSCLC具有抗癌作用,这可能为NSCLC的精确治疗提供理论参考。
PTEN/PI3K/AKT通路参与细胞增殖、凋亡等多种生命活动[15-18]。PTEN为人第10号染色体缺失的磷酸酶及张力蛋白同源的基因,是NSCLC中已知的预后标志物和肿瘤抑制因子,同时具有脂质磷酸酶和蛋白磷酸酶活性[19]。PTEN的低表达或者失活能够增强PI3K/AKT信号通路活化。PI3Ks家族包含在PI3K/AKT信号通路中,通过调节抗肿瘤药物研究中的各种细胞过程,成为重要的肿瘤靶标[20-21]。有研究证实,在许多肿瘤中减少或不存在的抑癌基因PTEN具有双重特异性磷酸酶活性,其脂质磷酸酶活性通过灭活PI3K/AKT信号通路来阻止生物过程,从而抑制肿瘤的发展[22]。也有文献记载,PTEN的失活通过激活PI3K/AKT信号通路增强了NSCLC细胞的侵袭能力,PTEN表达的上调可以抑制NSCLC细胞增殖并促进细胞凋亡,说明在NSCLC细胞中PTEN通过负调节PI3K / Akt通路来发挥其抑癌作用,而PI3K/Akt通路在生长发育、增殖、凋亡、迁移、浸润过程中发挥重要作用[23-25]。miR-16-5p已经被证实参与肿瘤细胞的迁移、侵袭和血管生成[26-28]。随后也被证实通过靶向PTEN靶标来调节细胞周期蛋白和PI3K/AKT信号通路来促进恶性黑色素瘤进展。本研究通过转染AS-miR-16-5p 48 h后A549细胞内miR-16-5p表达下调,又分别通过MTT实验、划痕实验和Transwell实验,证实AS-miR-16-5p能明显抑制A549细胞的活性和迁移。并且发现,应用AS-miR-16-5p抑制miR-16-5p后,PTEN蛋白表达增高,证明miR-16-5p调控PTEN表达,进而影响其下游PI3K和AKT蛋白表达。
4 结论
AS-miR-16-5p能够抑制NSCLC A549细胞活性和迁移。此外,AS-miR-16-5p通过负调控PTEN/PI3K/AKT信号通路有可能成为NSCLC新靶点之一。本研究为NSCLC的生物靶向治疗提供了新的思路和依据。
