柚皮苷对兔骨髓基质细胞成骨分化、增殖和迁移及对OPG/RANKL信号通路的调节作用*
2022-01-20覃浩然宋泉生覃海飚钟远鸣付拴虎谷金卢大汉陈勇喜
覃浩然 宋泉生 覃海飚 钟远鸣 付拴虎 谷金 卢大汉 陈勇喜
(广西中医药大学第一附属医院骨一科,广西 南宁 530023)
股骨头坏死的治疗一直是临床骨科的主要问题,治疗周期长且困难,给患者的生理、心理和财务状况带来了巨大负担[1- 2]。随着间充质干细胞研究的进展,多能干细胞已成为重要的种子细胞,而骨髓基质细胞是髓内多能基质细胞,可以分化为成年细胞,如骨细胞、软骨细胞等[3]。这些细胞产生大量的细胞外基质分子和细胞因子(胶原蛋白、纤连蛋白、层粘连蛋白,白介素-3/6/8,MCS-F和血小板生成素),不仅有促进局部造血作用,而且还有效促进骨修复。骨髓基质细胞不仅易于管理,而且不会引起自身免疫反应。因此,如何有效促进骨髓基质细胞的成骨分化成为骨损伤相关疾病治疗的热点。
柚皮苷属于类黄酮,是重要的次生代谢产物,是水果中发现的生物活性化合物,广泛分布在植物来源的食物,如蔬菜、水果、茶和葡萄酒等[4]。这些植物、药物因其不易上瘾且无毒的性质,在传统医学中具有重要意义。有研究表明,柚皮苷具有抗氧化、抗白内障、抗微生物、抗诱变、抗癌、抗炎和降低胆固醇的作用[5-7]。进一步的研究还表明,柚皮苷的配方可促进骨骼再生,并具有预防PM10引起的肺损伤的作用[8]。柚皮苷口服或直接与骨髓基质细胞注射对兔膝关节软骨缺损具有修复作用[9]。但柚皮苷是否影响骨髓基质细胞的成骨分化和迁移依然不太清晰,故本研究旨在探讨柚皮苷对骨髓基质细胞的成骨分化和迁移的作用和机制。
1 材料与方法
1.1 试剂 DMEM细胞培养液、胎牛血清(FBS)均购自GIBIC(USA);柚皮苷(阿拉丁,中国);十六烷基氯化吡啶鎓(CPC,Sigma,USA);RNA提取试剂(Takara,中国);CCK-8试剂盒(MCE,中国);碱性磷酸酶(ALP)试剂盒(南京建成,中国);茜素红S(ARS)染色(上海歌凡生物,中国);anti-OPG、anti-RANKL、anti-OCN、anti-β-Actin(Abcam,USA);结晶紫染色液(碧云天,中国)。
1.2 细胞培养 提取兔骨髓基质细胞原代培养[10]:选用2~3月龄新西兰大白兔,戊巴比妥钠麻醉,酒精消毒,切开两侧股骨和胫骨,用含有5 mL生理盐水和肝素(100 μL/mL)的20 mL注射器抽取骨髓,收集细胞悬液于离心管。1500 r/m离心10 min,弃上清,加入含有10% FBS的DMEM培养基制备细胞悬液,反复吹打均匀,细胞计数,接种于25 mL细胞培养瓶,于37℃和5% CO2条件下培养,隔日换一次液,待细胞长至80%时,胰酶消化传代,待细胞长至第3代则开始用于后续试验。
1.3 细胞活性测量 将兔骨髓基质细胞以每孔1000个细胞的密度接种在96孔板中。然后用不同浓度的柚皮苷(0、5、10、25、50、100、1000 μM)处理细胞48 h。根据CCK-8试剂盒说明,每孔加入10% CCK-8液,继续孵育1 h,于450 nm处的吸光度测量细胞活力。
1.4 ALP活性 将兔骨髓基质细胞以3×104/cm2的密度接种到12孔板中,然后用不同浓度的柚皮苷(0、10、25、50 μM)处理细胞48 h。然后将板用PBS洗涤3次,根据制造商的说明使用ALP活性测定法确定ALP活性。
1.5 ARS染色 将兔骨髓基质细胞用不同浓度的柚皮苷(0、10、25、50 μM)处理细胞48 h,根据制造商的说明ARS染色。首先,在室温下将样品在4%多聚甲醛中固定30 min。用PBS洗涤3次后,使用0.5%ARS(PH 4.1)染色细胞。然后,将兔骨髓基质细胞再次用PBS洗涤3次,并使用10%的CPC提取钙沉积物。然后通过测量560 nm处的吸光度对进行定量。
1.6 细胞划痕试验 将兔骨髓基质细胞每孔4×104个细胞的密度接种在6孔板中,然后使用无菌微量移液器吸头从6孔细胞培养板的一端到另一端刮擦细胞层。然后用不同浓度的柚皮苷(0、10、25、50 μM)处理细胞48 h,于倒置显微镜下观察拍照。
1.7 细胞结晶紫染色 将Transwell小室置于24孔板,用含不同浓度柚皮苷的培养基重悬细胞,并以3×104/cm2的密度接种到Transwell上室。下室中加入含10% FBS的培养基,于细胞培养箱培养48 h。吸弃上室中的细胞,将小室置于4%多聚甲醛溶液中室温固定30 min,随后用0.01%的结晶紫溶液染色30 min,用PBS漂洗3次。显微镜拍照观察,ImageJ图像软件计数,并计算细胞迁移率。
1.8 实时荧光定量-聚合酶链式反应(RT-PCR) 兔骨髓基质细胞以每孔4×104个细胞的密度接种在6孔板中。细胞达到80%后,用不同浓度的柚皮苷(0、10、25、50 μM)处理细胞48 h。使用RNAiso试剂提取细胞总RNA。然后,根据制造商的说明使用PrimeScriptTM RT Master Mix(Takara,日本)通过反转录获得cDNA,qPCR使用ABI Step One Plus实时PCR系统(Applied Biosystems,Warrington,英国)。将反应循环设置为95℃ 30 s,然后将95℃ 5 s和60℃ 30 s设置为45个循环。本实验使用GAPDH作为内参基因,并通过2-ΔΔCt方法表示目标基因的相对表达。引物序列如下:OPG Forward 5′-TACAGCATCACT ACGTAGGAC-3′,OPG Reverse 5′-ACGTCATGCG ATCACATATCG-3′;RANKL Forward 5′-GACAG GCACGGACTCGTA-3′,RANKL Reverse 5′- CGCT CATGCTAGTCGTCTA-3′;Runx2 Forward 5′-AGCG CTTCTCAGGAGTTCCA-3′,Runx2 Reverse 5′-GCCG GGCCACATCGA-3′;OCN Forward 5′-CTGGCTG CGCTCTGTCTCT-3′,OCN Reverse 5′-TGCTTGG ACATGAAGGCTTTG-3′;GADPH Forward 5′-CA ACTTTGGCATTGTGGAAGG-3′,GADPH Reverse 5′-ACACATTGGGGGTAGGAACAC-3′。
1.9 蛋白免疫印迹(Western blot) 使用RIPA蛋白裂解液提取细胞总蛋白,使用BCA测定试剂盒蛋白定量。用15% SDS-聚丙烯酰胺凝胶分离蛋白,然后转移到PVDF膜。在室温下用5%脱脂奶封闭1 h,将膜与相应抗体于4℃孵育过夜:抗OPG(1∶1000稀释),抗RANKL(1∶1000稀释),抗RunX2(1∶1000稀释),抗OCN(1∶1000稀释)和β-Actin(1∶1000稀释)。将膜用TBST洗涤,然后与HRP标记的二抗在室温下孵育45 min。用化学发光检测试剂检测,用ImageJ图像软件分析相对蛋白水平,并根据β-Actin进行归一化。
2 结果
2.1 柚皮苷对兔骨髓基质细胞活性的影响 细胞活性测量结果表明,与0 μM组比较,柚皮苷100 μM和1000 μM明显抑制细胞活性,但50、25、10、5 μM对细胞活性无影响,因此后续采用柚皮苷50 μM、25 μM和10 μM进行后续试验,见图1。
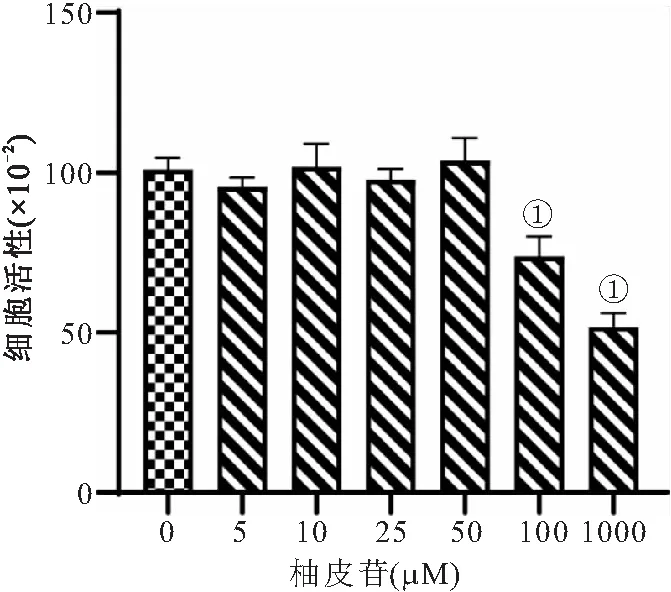
图1 柚皮苷对兔骨髓基质细胞活性的影响
2.2 柚皮苷对兔骨髓基质细胞成骨分化的影响 ALP染色结果表明,与0 μM组比较,柚皮苷25 μM和50 μM组细胞中ALP活性明显增强(P<0.05),见图2A~B。ARS染色结果同样表明,与0 μM组比较,柚皮苷25 μM和50 μM组细胞有明显的钙沉积物形成,差异有统计学意义(P<0.05),见图2C~D。
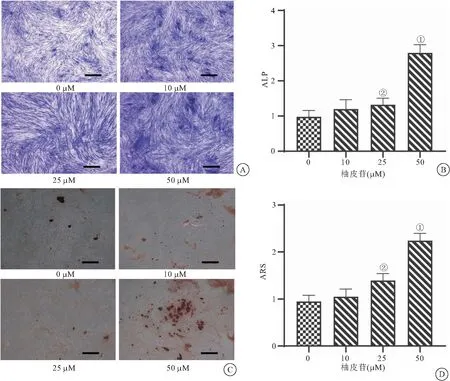
图2 柚皮苷对兔骨髓基质细胞成骨分化的影响
2.3 柚皮苷对兔骨髓基质细胞迁移的影响 细胞划痕和结晶紫染色结果表明,与0 μM组比较,柚皮苷10 μM、25 μM和50 μM组细胞的迁移能力增强,且随浓度升高而增强,呈浓度依赖性(均P<0.05),见图3。
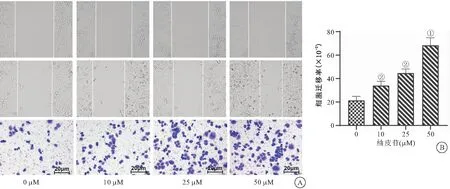
图3 柚皮苷对兔骨髓基质细胞迁移的影响
2.4 柚皮苷对兔骨髓基质细胞中OPG和RANKL相关基因表达的影响 与0 μM组比较,柚皮苷处理组细胞中OPG、Runx2和OCN mRNA水平明显上调,且呈浓度依赖性。但柚皮苷处理组细胞中RANKL mRNA水平较0 μM组明显下调,差异有统计学意义(均P<0.05),见图4。
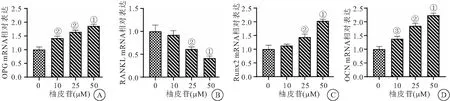
图4 柚皮苷对兔骨髓基质细胞中OPG/RANKL相关基因表达的影响
2.5 柚皮苷对兔骨髓基质细胞中OPG和RANKL相关蛋白表达的影响 与0 μM组比较,柚皮苷处理组细胞中OPG、Runx2和OCN蛋白水平明显上调,且呈浓度依赖性。但柚皮苷处理组细胞中RANKL蛋白水平较0 μM组明显下调(均P<0.05),见图5。
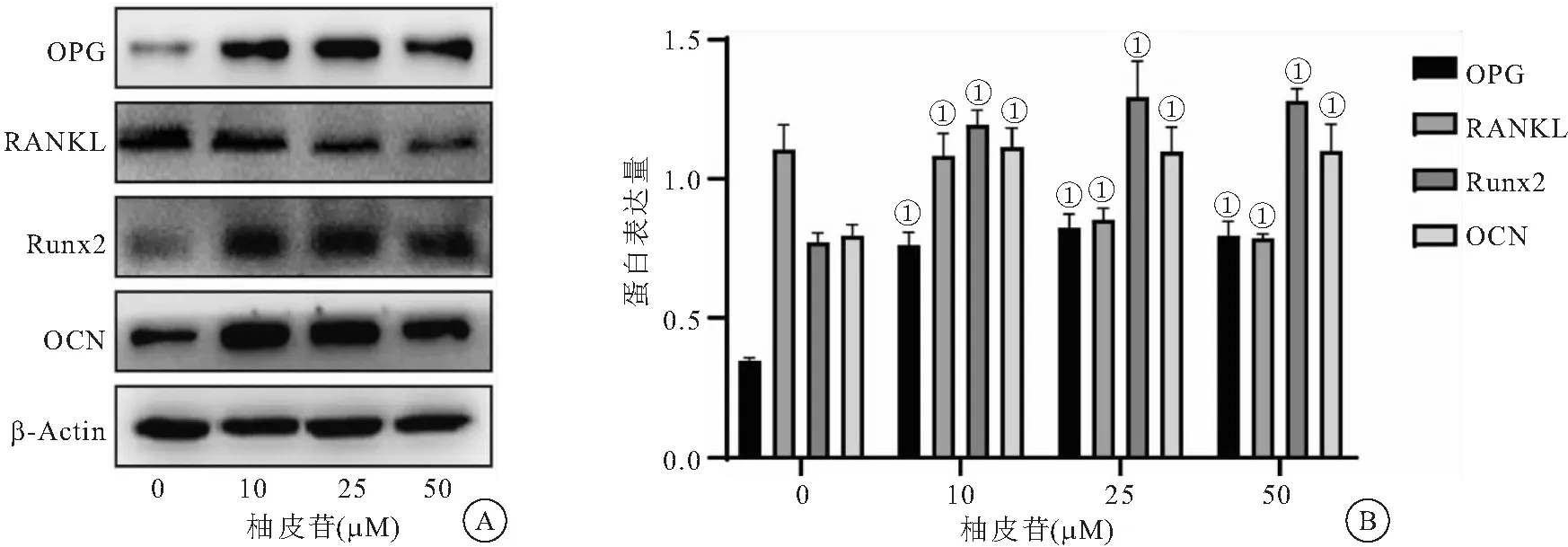
图5 柚皮苷对兔骨髓基质细胞中OPG和RANKL相关蛋白表达的影响
3 讨论
股骨头坏死主要是由于临床长期大剂量使用类固醇激素治疗,如系统性红斑狼疮、类风湿性关节炎、多发性骨髓瘤以及其他炎性和自身免疫性疾病引起的严重并发症[11]。随着疾病的进展,病变逐渐涉及关节和骨髓,然后在晚期发展为股骨头塌陷和髓样骨关节炎,导致难以忍受的疼痛,折断甚至残疾。当疾病严重到一定程度时,通常需要进行人工关节置换手术以确保关节的正常功能和减轻症状[12]。但手术费用昂贵,且二次手术风险较高,给社会和家庭带来了沉重的经济负担。深入分析股骨头坏死的发病机理以及开发相应的新药对于缓解患者的压力非常重要[13]。到目前为止,虽然尚不清楚股骨头坏死的发病机理,但主要的机制理论集中于骨髓基质细胞的成骨分化稳态过程。
骨髓基质细胞是机体骨髓中的一类多功能干细胞,可用作种子细胞以分化为骨细胞、软骨细胞、脂肪细胞等[14]。越来越多的证据表明,股骨头坏死患者骨髓基质细胞的成骨分化能力下降,而脂肪形成分化能力增强,这导致细胞组织的供血和供氧不足,促进细胞功能障碍和细胞凋亡,然后导致股骨头坏死的恶性循环[15]。因此,提高骨髓基质细胞的成骨分化和迁移有望成为股骨头坏死治疗的新策略。口服柚皮苷在骨关节炎模型中具有治疗软骨破坏的潜力[16]。柚皮苷也能够调节炎症性蛋白分泌并促进软骨细胞浸润[17]。柚皮苷能够促进骨骼再生以及口服或直接与骨髓基质细胞注射对兔膝关节软骨缺损具有修复作用[18]。本研究发现,柚皮苷能够直接促进骨髓基质细胞成骨分化和迁移。
本研究选择茜素红S染色和ALP染色评价骨髓基质细胞的成骨分化能力。其中,ALP是一种膜结合酶,可以水解有机磷酸盐以释放无机磷并开始钙化过程,标志着成骨细胞分化的开始。茜素红S可以与钙离子螯合形成复合物,识别细胞中的钙盐成分,并标记骨髓基质细胞的成骨分化形成的钙结节。根据染色结果,柚皮苷诱导的骨髓基质细胞中茜素红S染色和ALP染色均为阳性,且染色强度具有浓度依赖性。另外,柚皮苷与骨髓基质细胞合用能够促进膝关节炎大鼠的软骨修复[19]。这些实验现象表明,柚皮苷可以诱导骨髓基质细胞的成骨分化。另外,骨髓基质细胞迁移至骨损伤部位是骨修复的重要环节,柚皮苷也能够促进骨髓基质细胞的迁移能力。
成骨细胞是骨代谢中最重要的细胞之一,骨髓基质细胞的成骨分化过程涉及许多信号通路。柚皮苷通过转化生长因子β(TGF-β)信号通路促进大鼠软骨组织修复[20]。柚皮苷也能够通过影响NF-κB信号通路缓解骨关节炎大鼠基质破坏[17]。柚皮苷通过抑制NF-кB信号通路的活化来逆转TNF-α诱导的骨髓基质细胞成骨抑制[19]。本研究发现,柚皮苷通过调控OPG/RANKL信号通路直接促进骨髓基质细胞的成骨分化和迁移。
OPG/RANK/RANKL系统与骨重塑紧密相关,对调节骨代谢平衡至关重要。RANKL作为配体的肿瘤坏死因子(TNF)超家族的一员,主要表达于成骨细胞和骨髓基质细胞,并以膜结合的形式存在于细胞表面,对淋巴细胞、树突状细胞和破骨细胞活化至关重要。RANK是破骨前体细胞中RNAKL唯一的受体,可以直接与RANKL结合,RANK可以与TRAF2,TRAF5和TRAF6结合,其中TRAF6与破骨细胞的产生密切相关,可通过NF-κB、JNK、蛋白质激酶B(PKB)和钙调神经磷酸酶/活化T细胞的核因子(CN/NFATcl)等信号转导促进破骨前体细胞的分化、活化、成熟以及组织细胞凋亡。OPG作为肿瘤坏死因子受体超家族的成员,是成骨细胞分化的诱饵受体,可以与RANKL竞争并抑制RANKL和RANK之间的相互作用,从而阻碍了成骨细胞诱导的破骨细胞前体的分化和融合,同时调节破骨细胞的分化,增殖和凋亡[21]。本研究发现,柚皮苷呈依赖性促进骨髓基质细胞OPG表达,且抑制RANKL表达水平,这说明柚皮苷的促骨髓基质细胞分化能力与调控OPG/RANKL信号通路有关。目前认为干细胞向特定细胞系的分化主要是由特定的转录因子介导的。RUNX2是骨髓基质细胞分化为成骨细胞系所必需的关键转录因子,它可以直接促进成骨细胞分化所需的基因(如OCN和COL1A1)的合成和分泌[22]。COL1A1是骨基质的主要有机成分,可以控制骨细胞的形态、分化和其他生物学功能,在维持骨骼结构的完整性和生物力学特性方面起着重要作用。OCN是骨骼钙化的重要因素,在维持正常矿化中起关键作用,并且是成骨晚期分化的标志之一。通常RUNX2,OCN和COL1A1的表达降低表明细胞的成骨分化减少,而这些指标的表达升高则提示成骨分化能力增强[23]。本研究结果显示,柚皮苷明显上调骨髓基质细胞RUNX2和OCN表达。
4 结论
柚皮苷能促进骨髓基质细胞的成骨分化和迁移能力,这可能与调控OPG/RANKL信号通路有关,暗示柚皮苷可能具有抗股骨头坏死的潜在活性。但柚皮苷抗股骨头坏死的活性和机制还需更进一步研究。
