血清PCNA、MIC-1及Hcy水平与非小细胞肺癌患者预后的相关性分析
2022-01-20王慧敏斯琴王方颖李晓华
王慧敏 斯琴 王方颖 李晓华
非小细胞肺癌(NSCLC)是肺癌最为常见的类型之一,约占肺癌病例总数的80%~85%,在我国发病率较高,已严重影响人类生命健康[1]。对于早期NSCLC患者而言,手术治疗是首选治疗方案,但由于发病早期无典型临床症状,且病情进展迅速,往往患者一经确诊便已处于中晚期,从而错过最佳手术时机,其5年生存率不足15%[2]。目前,血清肿瘤标记物检测由于具有检测快捷、简便等特点,常作为临床上对NSCLC患者进行早期诊断与预后评估的重要指标[3]。临床研究表明NSCLC患者血清PCNA、MIC-1及Hcy水平均有不同程度升高,且其水平升高与NSCLC患者病情转归及预后关系密切[4],但用于评估NSCLC患者预后的相关性报道却极为少见。为此,本研究选取2016年2月~2018年1月本院收治的123例NSCLC患者的临床资料进行回顾性研究,对血清PCNA、MIC-1及Hcy水平与NSCLC患者预后的相关性进行探讨,以期为NSCLC患者预后评估提供理论指导。现汇报如下。
资料与方法
一、一般资料
回顾性分析2016年2月~2018年1月本院收治的123例NSCLC患者的临床资料,其中男性68例、女性55例,年龄49岁~78岁,平均(58.09±10.13)岁。病理类型:腺癌71例(占比57.72%)、鳞癌52例(占比42.28%),TNM分期:Ⅰ期19例(占比15.45%)、Ⅱ期26例(占比21.14%)、Ⅲ期48例(占比39.02%)、Ⅳ期30例(占比24.39%),分化程度:高分化32例(占比26.02%)、中分化64例(占比52.03%)、低分化27例(占比21.95%)。纳入标准:⑴参照非小细胞肺癌NCCN指南2017第5版[5]对所有NSCLC患者进行诊断,并经病理学检查加以确诊;⑵所有NSCLC患者均为首次确诊,且临床病理资料完整。排除标准:⑴患者伴发其他恶性肿瘤;⑵患者有精神类疾病史;⑶患者伴有免疫系统疾病或严重感染性疾病;⑷患者伴有心肝肾等主要脏器功能不全;⑸患者有化疗或靶向治疗史。
二、观察指标及方法
收集所有NSCLC患者临床资料,记录两组患者入院24h内血清PCNA、MIC-1及Hcy水平。
患者入院24h内清晨空腹抽取外周肘静脉血5 mL于肝素抗凝管中,以转速3000 r/min离心10 min分离血清,血清PCNA、MIC-1水平采用ELISA法测定、血清Hcy水平采用循环酶法测定。所用迈克生物全自动生化分析系统C 800及配套试剂与试剂盒均由迈克生物股份有限公司提供。本研究中血清PCNA截断值选取:以本研究中所有NSCLC患者血清PCNA水平中位数452 pg/mL为分界线;血清MIC-1正常参考值[6]:0~1000 pg/mL;血清Hcy正常参考值[7]:10~22 μmol/L。
三、统计学处理

结 果
一、血清PCNA、MIC-1及Hcy水平与临床病理指标的关系 不同性别、年龄以及病理类型的NSCLC患者血清PCNA、MIC-1及Hcy水平比较均无明显差异(均P>0.05);而不同TNM分期、分化程度NSCLC患者血清PCNA、MIC-1及Hcy水平比较均差异明显(均P<0.05)(见表1)。
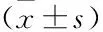
表1 血清PCNA、MIC-1及Hcy水平与临床病理指标的关系
二、NSCLC患者预后影响因素的单因素分析
不同TNM分期、分化程度、PCNA、MIC-1、Hcy的DLBCL患者总生存期比较均差异明显(均P<0.05),说明TNM分期、分化程度、PCNA、MIC-1、Hcy可能影响NSCLC患者预后(见表2)。

表2 NSCLC患者预后影响因素的单因素分析
三、NSCLC患者预后影响因素的多因素COX回归分析
以NSCLC患者预后(总生存期)为因变量,变量赋值表(见表3),对单因素分析中NSCLC患者预后的可能影响因素(TNM分期、分化程度、PCNA、MIC-1、Hcy)进行多因素COX回归分析,结果显示TNM分期、分化程度、PCNA、MIC-1、Hcy均为NSCLC患者预后的独立危险因素(均P<0.05)(见表4)。

表3 多因素Cox回归分析的变量赋值表

表4 NSCLC患者预后影响因素的多因素COX回归分析
四、血清PCNA、MIC-1及Hcy表达水平生存曲线分析
采用Kaplan-Meier法绘制血清PCNA、MIC-1及Hcy表达水平ROC曲线,并计算总生存期,研究结果表明血清PCNA≤452 pg/mL患者总生存期(16.85±2.36)个月,明显大于血清PCNA>452 pg/mL患者(9.53±1.48)个月(t=20.029,P<0.001);血清MIC-1≤1000 pg/mL患者总生存期(18.29±2.92)个月,明显大于血清MIC-1>1000 pg/mL患者(9.47±1.26)个月(t=23.289,P<0.001);血清Hcy≤22 μmol/L患者总生存期(13.76±2.04)个月,明显大于血清Hcy >22 μmol/L患者(11.61±1.68)个月(t=6.405,P<0.001)(见图1)。
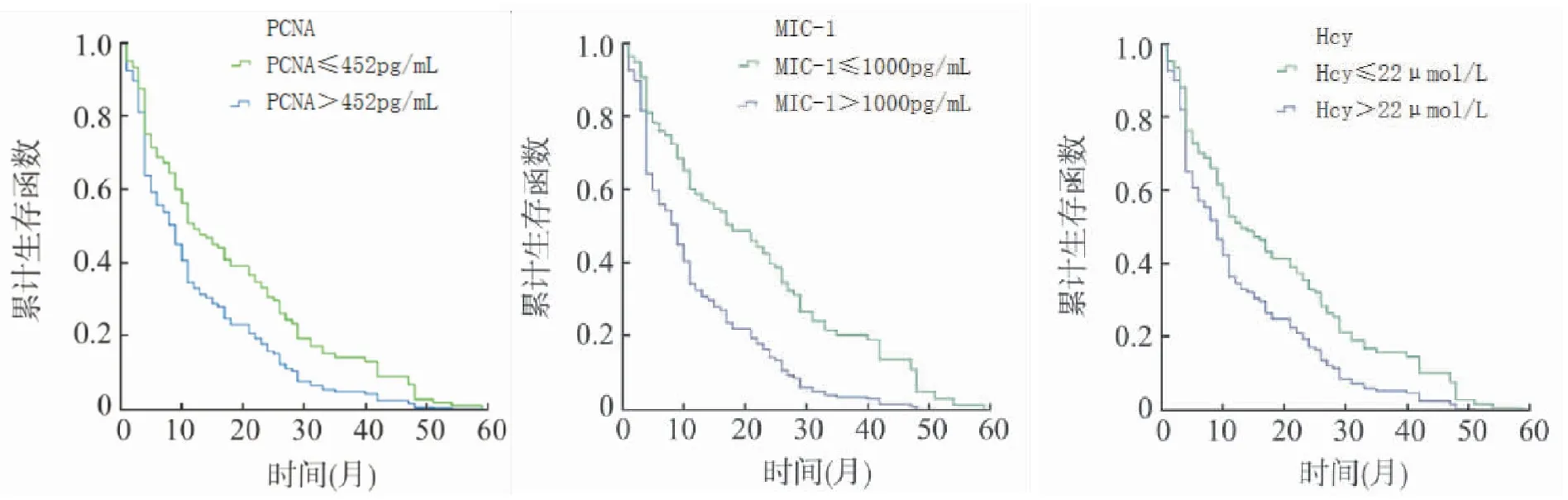
图1 血清PCNA、MIC-1及Hcy表达水平生存曲线
讨 论
目前临床上对于早期NSCLC患者多采用手术治疗为主,化疗为辅助的治疗方案[8]。虽然近年来医疗技术的革新,使得靶向治疗等新的治疗方案不断应用于NSCLC患者临床治疗,但NSCLC在病情进展过程中的生物学行为亦有其多样性(转移、突变等),导致NSCLC患者预后普遍较差[9]。临床研究表明[10]血清肿瘤标记物(常见的有血清癌胚抗原、C 反应蛋白等)参与了NSCLC发生发展以及转移、突变等多个生理过程,且对其进行检测快捷、简便,常作为临床上对NSCLC患者进行早期诊断与预后评估的重要指标。在对血清肿瘤标记物检测过程中我们也发现受NSCLC患者吸烟、饮食以及感染等因素的干扰,影响血清肿瘤标记物检测的敏感度与特异度,导致检验结果假阳性或假阴性率较高[11];因此,如何寻找可以准确预测、评估NSCLC患者病情及预后进展的评价指标,对NSCLC患者个性化用药方案的制定以及治疗效果评估具有重要的临床价值[12]。
PCNA、MIC-1及Hcy,均是临床上较为常见的血清学指标[13],但有关血清PCNA、MIC-1及Hcy联合应用于评估NSCLC患者预后的相关性报道却并不多见。PCNA是一种在细胞核内合成的DNA聚合酶δ辅助蛋白,其合成量多少与细胞周期关系密切,并参与了NSCLC肿瘤细胞增殖及迁移等多个过程,当NSCLC发生后,机体内PCNA表达水平会异常升高,因此可作为评估NSCLC患者细胞增殖、预后、复发的重要肿瘤标志物[14]。MIC-1是人转化生长因子β家族中的重要成员之一,NSCLC发生后患者血清MIC-1表达水平明显上调,临床研究表明MIC-1参与了NSCLC细胞侵袭、转移以及凋亡等多个生物学过程,在NSCLC肿瘤发生发展过程中,可起到调控作用[15-16]。而Hcy是人体中常见的一种含硫氨基酸,当NSCLC发生后机体血清Hcy水平会异常升高,其产生的细胞、基因毒性,会对原癌基因的激活及细胞增殖过程(如鳞状上皮化增生)起促进作用,并参与了NSCLC的发生发展等多个生理过程[17]。在本研究中,不同性别、年龄以及病理类型的NSCLC患者血清PCNA、MIC-1及Hcy水平比较均无明显差异,而不同TNM分期、分化程度NSCLC患者血清PCNA、MIC-1及Hcy水平比较均差异明显,表明血清PCNA、MIC-1及Hcy水平与TNM分期、分化程度显著相关。以NSCLC患者预后为因变量,对单因素分析中NSCLC患者预后的可能影响因素进一步进行多因素COX回归分析,研究结果表明TNM分期、分化程度、PCNA、MIC-1、Hcy均为NSCLC患者预后的独立危险因素,可为NSCLC患者患者预后评估提供相应参考。通过采用Kaplan-Meier法绘制ROC曲线及计算总生存期,本研究发现血清PCNA≤452 pg/mL、MIC-1≤1000 pg/mL、Hcy≤22 μmol/L的NSCLC患者总生存期明显较长,提示血清PCNA、MIC-1及Hcy水平可作为对NSCLC患者进行预后评估的肿瘤标记物。本研究局限性:所纳入的NSCLC患者样本数偏少,可能会因血清PCNA、MIC-1及Hcy水平截断值的选取引起统计结果的偏差,因此血清PCNA、MIC-1及Hcy水平与NSCLC患者预后的相关性仍有待于收集大量NSCLC患者的临床资料进行更深入探讨。
总之,TNM分期、肿瘤分化程度较低、PCNA、MIC-1以及Hcy均为NSCLC患者预后的独立危险因素,且血清PCNA、MIC-1及Hcy呈低表达水平的NSCLC患者总生存期较长。
