PD-1阻断剂所致皮肤不良反应分析及文献回顾
2022-01-18胡菊丽刘文丽牟宽厚
孙 靓 韩 丹 胡菊丽 刘文丽 周 艳 梁 艳 穆 欣 牟宽厚
1西安交通大学第一附属医院皮肤科,陕西西安,710061;2陕西省咸阳市旬邑县医院皮肤科,陕西旬邑,711300
抗程序细胞死亡蛋白1(programmed death-1,PD-1)及配体(PD-1 ligand,PD-L1)系免疫检查点抑制剂的治疗靶点,其阻断剂在肿瘤的免疫治疗中取得了突破性进展,被美国食品药品管理局(FDA)批准用于恶性黑素瘤、非小细胞肺癌、霍奇金淋巴瘤等多种恶性肿瘤的治疗,但随着PD-1/PD-L1阻断剂在临床上逐步推广,越来越多的免疫相关不良反应(immune-related adverse events,irAEs)引起关注,其中皮肤反应可表现为不典型非特异性皮损、湿疹、银屑病等改变,亦可出现重症药疹等严重皮肤反应,重者可危及生命。本文对一组PD-1阻断剂在肿瘤免疫治疗过程中引起的不同皮肤不良反应以及诊治进行分析讨论并对相关文献进行回顾,进一步探讨 PD-1抑制剂可能导致的皮肤irAEs及诊治,从而提高临床医生对PD-1/PD-L1阻断剂所致免疫相关性皮损的认识、诊断、预防及治疗,改善肿瘤患者生存质量。
1 材料和方法
1.1 材料 汇总2020-2021年间我院治疗的住院患者PD-1/PD-L1阻断剂免疫治疗所致的一组不同表现的皮肤不良反应4例,分别为湿疹、多形红斑、TEN、嗜酸细胞增多性皮炎样皮肤免疫相关不良反应各1例。
1.2 方法 在Pubmed数据库检索2015年以内发表的PD-1/PD-L1免疫治疗导致皮肤不良反应的病例报道及文献回顾中汇总病例126例,进行统计并回顾性分析患者的年龄及性别分布、前驱发病时间、致皮肤irAEs的药物、皮肤irAEs类型、前驱皮损、合并用药/治疗情况、肿瘤背景等。
2 结果
2.1 我院收治PD-1/PD-L1阻断剂免疫治疗所致的一组皮肤不良反应病例资料 2020-2021年间我院收治PD-1/PD-L1阻断剂免疫治疗所致的一组皮肤不良反应4例,其中男3例,女1例,年龄32~71岁,发病前驱时间(从开始使用PD-1/PD-L1阻断剂治疗至出现皮损)3~12周(表1)。
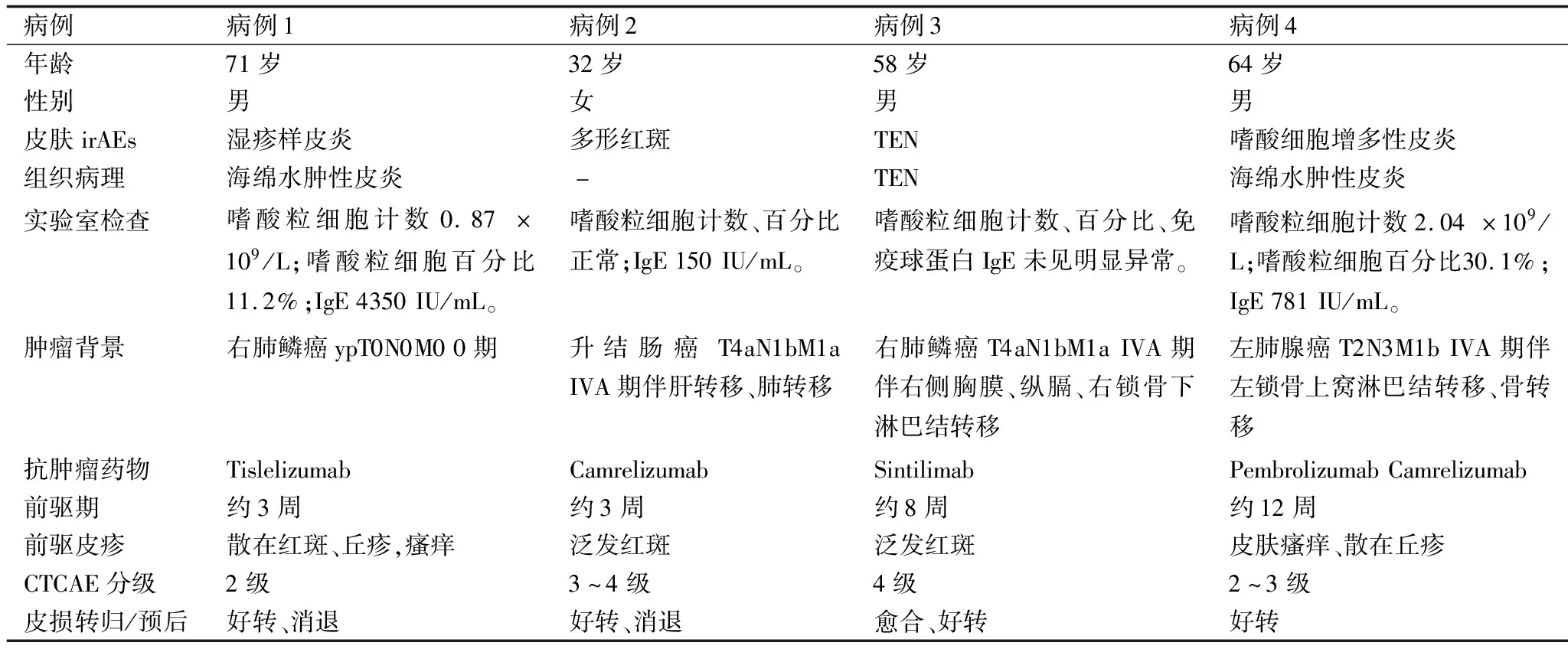
表1 PD-1阻断剂免疫治疗所致的一组皮肤不良反应
病例1,男,71岁。确诊右肺鳞癌(ypT0N0M0 0期)4个月。替雷丽珠单抗(Tislelizumab)治疗约20天后出现双下肢散在红斑、丘疹,伴瘙痒、脱屑,后红斑迅速蔓延至全身,伴四肢皮损部位潮红、水肿,考虑符合湿疹样皮损改变(图1)。实验室检查:嗜酸粒细胞计数、百分比及免疫球蛋白IgE升高。组织病理符合海绵水肿性皮炎改变(图2)。系统治疗给予糖皮质激素、抗组胺药,辅以外用药物,皮损及瘙痒显著好转。停药半年未见皮损反复及嗜酸粒细胞升高。

图1 病例1临床湿疹样皮损(1a:颈后部;1b:躯干部;1c:上肢;1d:下肢) 图2 病例1组织病理:表皮不规则增生,角化过度伴角化不全,海绵水肿、浆液渗出,未见明显坏死角质形成细胞,真皮浅层血管周围可见淋巴细胞、组织细胞及较多嗜酸粒细胞浸润(HE,2a:×100;2b:×200) 图3 病例2躯干(3a)、手背(3b)水肿性红斑,部分红斑呈靶型损害 图4 病例3面部(4a), 躯干、上肢(4b)、臀部(4c)、会阴部下肢弥漫性红斑,散在薄壁水疱、大疱,松弛易破,尼氏征阳性,表皮剥脱;4d:表皮海绵水肿,角质形成细胞凋亡、坏死,基底细胞液化变性,真表皮可见明显裂隙、部分全层分离,淋巴细胞浸润(HE,×100)
病例2,女,32岁。确诊升结肠癌(T4aN1bM1a IVA)伴肝转移肺转移2年。卡瑞丽珠单抗(Camrelizumab)治疗3周后出现全身进行性加重红斑伴瘙痒、发热。体检:皮温高,颜面、四肢、躯干可见片状红斑,部分融合成片,无明显破溃、渗出,唇部干燥脱屑,部分红斑呈靶型损害,符合多形红斑(图3)。系统治疗给予IVIG(静脉注射丙种球蛋白)、糖皮质激素、抗组胺药,辅以外用药物,自觉症状及皮损好转。该患者失访。
病例3,男,58岁。确诊右肺鳞癌(T4aN1bM1a IVA)伴右侧胸膜转移、纵膈及右锁骨下淋巴结转移3个月。信迪利单抗(Sintilimab)治疗2个月余后躯干四肢出现散在红斑,逐渐出现水疱,继而皮肤黏膜进行性糜烂剥脱,伴发热,体温最高39℃。体检:颜面肿胀,全身弥漫性红斑,散在薄壁水疱、大疱,松弛易破,尼氏征阳性,皮肤剥脱>80%BSA,剥脱表皮呈灰褐色皱纹纸样粘于渗出、糜烂面上;结膜充血,眼睑、口鼻糜烂,基底鲜红潮湿,局部有黑痂及黄白色脓性分泌物,全口内黏膜糜烂严重,张口、伸舌不能;外生殖器、肛周等部位皮肤均可见不同程度糜烂、水疱、大疱、表皮剥脱,龟头结黑痂;手足皮肤可见表皮呈手套、袜套样剥脱;全身皮肤触痛明显、大量渗出(图4a~4c)。组织病理示:中毒性表皮坏死松解症(图4d)。给予抗感染、免疫球蛋白、糖皮质激素、抗组胺药、TNF-α抑制剂、对症支持、加强护理,皮损愈合。停药后2个月未见复发。
病例4,男,64岁。确诊左肺腺癌(T2N3M1b IVA期)伴左锁骨上窝淋巴结转移、骨转移11个月。帕博利珠单抗(Pembrolizumab)继以卡瑞丽珠单抗(Camrelizumab)治疗7个月后四肢及躯干皮肤出现红斑、丘疹、渗出,瘙痒明显,口服左西替利嗪、司他斯汀无缓解,皮损逐渐出现泛发色素沉着、苔藓样变、增厚、干燥,有僵硬、束缚感,瘙痒加重,查血嗜酸粒细胞计数、百分比显著升高,免疫球蛋白IgE显著升高,考虑符合嗜酸粒细胞增多性皮炎改变(图5a~5c)。组织病理符合海绵水肿性皮炎改变(图5d)。系统给予糖皮质激素、抗组胺药,外用糖皮质激素软膏等治疗,瘙痒及皮损显著好转,呼吸科调整肿瘤治疗方案,停药后1月余未见皮损反复及嗜酸粒细胞升高。

图5 病例4侧面颈部(5a)、躯干(5b)、下肢(5c),泛发色素沉着、苔藓样变;5d:角化过度伴角化不全,表皮不规则增生,轻度海绵水肿,真皮血管周围淋巴细胞及组织细胞浸润(HE,×400)
2.2 国外报道PD-1/PD-L1免疫治疗导致皮肤不良反应文献回顾 在Pubmed数据库检索2015年以内发表的PD-1/PD-L1免疫治疗导致皮肤不良反应的病例报道及文献回顾中汇总病例126例,其中男76例,女50例,男女比例1.52∶1;年龄18~85岁,平均年龄约63.8岁,中位年龄63岁;发病前驱时间(从开始使用PD-1/PD-L1阻断剂治疗至出现皮损)3天~105周不等,平均时间约17.5周,中位时间约12周[7-9,11,12]。对于部分记载较详细的病例中患者的年龄及性别分布、前驱发病时间、致皮肤irAEs的药物、皮肤irAEs类型、前驱皮损、合并用药/治疗情况、肿瘤背景等进行统计并回顾性分析,汇总如表2。
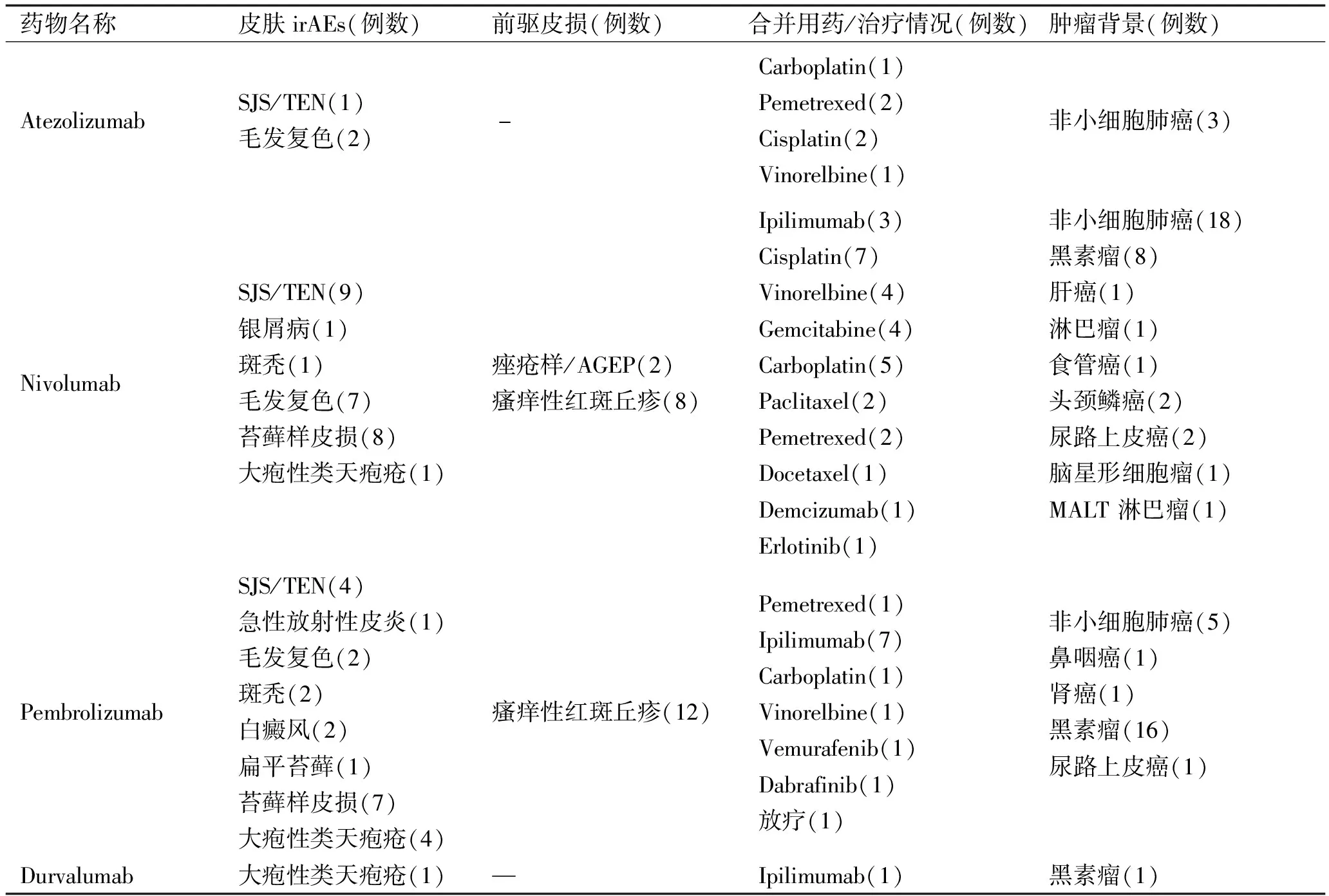
表2 接受PD-1/PD-L1阻断剂治疗部分国外病例中皮肤不良反应回顾性分析
3 讨论
随着对肿瘤机制及肿瘤免疫学认识的深入,研究者发现通过阻断PD-1/PD-L1相互作用解除免疫抑制,恢复肿瘤抗原特异性T细胞的活化从而阻断肿瘤免疫逃逸,可以增强患者自身T细胞抗肿瘤效应,PD-1/PD-L1免疫治疗相关的研究和临床应用为多种晚期实体肿瘤和转移性肿瘤的治疗提供了重大突破[1-3,5]。随着PD-1/PD-L1这对负性免疫共刺激分子的阻断剂逐步在国内外肿瘤免疫治疗领域临床应用的推广,越来越多的不良反应引起关注,由于其独特的作用机制,在增强T细胞抗肿瘤效应的同时,也可能影响自身正常免疫耐受,累及到机体正常组织从而出现自身免疫样炎症反应,称为免疫相关副反应(immune-related adverse events, irAEs),这主要是由细胞毒性CD4+/CD8+T细胞激活介导,可导致皮肤粘膜、消化、心血管、呼吸甚至内分泌、神经系统等多系统受累,其中皮肤不良反应往往是最常见也是最早发生的irAEs,目前没有irAEs特定分级标准,常遵循美国卫生及公共服务部2017年颁布的常见不良事件评价标准第5版(Common Terminology Criteria for Adverse Events Version 5.0 , CTCAE)进行评估,此标准将皮肤不良反应分为5级,其中中毒性表皮坏死松解症(toxic epidermal necrolysis, TEN)最严重,一旦出现即定义为4级以上不良反应[4-7]。
皮肤相关irAEs多种多样,其严重程度也不尽相同,除本文中湿疹样、多形红斑样皮损以及严重的TEN表现外,还有瘙痒、白癜风、大疱性类天疱疮、口腔黏膜改变、脱发以及荨麻疹样、苔藓样、银屑病样、痤疮样、狼疮样皮损、皮肌炎或口腔黏膜和指甲改变,以及未分类皮损(not otherwise specified, NOS)等[4-7,11],同时也有报道导致放疗敏感性增强从而引起急性放射性皮炎改变[8]。Stevens-Johnson综合征/中毒性表皮坏死松解症(SJS/TEN)等严重不良反应在免疫检查点抑制剂治疗后的病例报道中相对罕见。
目前PD-1/PD-L1免疫治疗导致皮肤不良反应的机制尚不明确,研究认为免疫检查点抑制剂干扰皮肤黏膜免疫耐受的维持,增加免疫相关不良反应的倾向。一项研究表明,炎症环境中干扰素-C诱导PD-L1表达,与保护角质形成细胞免于受损的机制有关[9];另一项研究发现PD-1/PD-L1信号参与了皮肤完整性的维持,而PD-1/PD-L1抑制剂影响此功能可能导致皮肤不良反应发生[10]。此外,研究发现联合使用药物和免疫检查点抑制剂的治疗与单一药物相比,通常与更严重和更早发生的皮肤不良反应相关[11]。
一项系统回顾免疫检查点抑制剂治疗的癌症患者SJS/TEN样的皮肤症状往往需要数周才能出现,其中TEN样反应发生时间的中位数为4周(平均5.38周)其中40%在6周及以上出现症状;同时部分病例在TEN症状出现前也有包括非典型的红斑、AGEP(急性泛发性发疹性脓疱病)样皮疹、麻疹样皮疹和放射性皮炎等前驱症状。该研究还汇总了包括系统使用糖皮质激素、静脉注射免疫球蛋白、血浆置换、环孢素为代表的免疫抑制剂、英夫利昔单抗或支持性治疗作为SJS(CTCAE≥3级)、TEN(CTCAE≥4级)的治疗方案选择[10]。而对于较轻的皮肤不良反应,可以根据CTCAE分级进行评估,根据肿瘤治疗获益情况权衡停药利弊,并给予皮肤科对症处理。
