表阿霉素纳米粒联合生育三烯酚的抗肝癌作用及心脏毒性研究
2022-01-18王跃武
王跃武 张 琦
宁波市医疗中心李惠利医院药剂科 (浙江 宁波, 351000)
肝细胞癌(HCC)是最常见的原发性肝癌,也是第三大常见的癌症死亡原因,5年生存率低,对现有药物疗法反应不良且耐药性强[1]。盐酸表阿霉素(EPI)是一种蒽环类抗肿瘤抗生素,是治疗肝癌的主要药物之一,但心肌病和充血性心力衰竭等严重副作用限制了其作为肝癌患者的长期用药[2]。因此,开发针对HCC副作用小且有效的治疗策略至关重要。纳米载体因其能够选择性靶向癌细胞对健康细胞影响较小而受到广泛关注[3],在可生物降解的纳米载体中,壳聚糖修饰的PLGA纳米粒子(NP)被证明具有增强细胞吸收药物的潜力[4,5]。当前研究主要集中在纳米载体介导的药物的传递[3],而关注有效且安全的应对HCC的EPI治疗药物较少。生育三烯酚(Ts)对神经退行性疾病、动脉粥样硬化和癌症是一种有效的抗氧化剂[6],有报道显示Ts对癌细胞分泌的血管生成因子具有抑制作用,并具有抗细胞增殖活性[7],其通过苯甲酚环上清除过氧自由基的能力可防治蒽环类药物诱导的心脏毒性。因此,本研究将EPI封装在可生物降解的壳聚糖PLGA纳米颗粒中,探讨EPI-NPs单独或与Ts组合后的抗肿瘤活性和心脏毒性,以期建立一种更有效、更安全的HCC化学治疗策略。
1 材料和方法
1.1 材料 EPI从武汉德美凯生物科技有限公司获得,Ts由四川省维克奇生物科技有限公司提供。二乙基亚硝胺(DEN)、3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)购自Sigma Aldrich公司。聚乳酸-羟基乙酸共聚物70∶30(PLGA)购自上海雅吉生物科技有限公司。壳聚糖氯化物(Protasan CL 113)购自挪威NovaMatrix公司。聚乙烯醇(Mowiol 4-88)购自北京海德创业生物科技有限公司。乙酸乙酯和二氯甲烷购自温州吉康化工有限公司。三乙胺购自温州市太行聚氨酯有限公司。杜氏改良版Eagle培养基(DMEM)和胎牛血清(FBS)购自上海连桥生物科技有限公司。
1.2 细胞系 人肝癌细胞HepG2细胞系购自美国LGC Promochem公司。采用含10%热灭活FBS的DMEM,37℃、95%相对湿度和5% CO2环境培养细胞。
1.3 动物 SPF级雄性BALB/c小鼠(6~8 周龄,体重20~25 g)购自常州卡文斯实验动物有限公司,在光照、相对湿度和温度可控的条件下饲养,允许随意获取食物和水。
1.4 EPI纳米粒子的制备和表征 用三乙醇胺和二氯甲烷将盐酸EPI沉淀到基底后,参考文献[8]通过乳液扩散法制备EPI-NPs。EPI基底(0.33 mg/ml)与PLGA在乙酸乙酯溶液中混合,在搅拌的同时将有机相滴加到等体积的PVA和壳聚糖氯化物的水溶液中,然后将预乳液在13 500 rpm下均化10 min,在搅拌下逐步添加去离子水至50 ml,同时去除有机溶剂,所得的胶态分散体包含0.2% w/v PLGA、0.2% w/v PVA和0.03% w/v壳聚糖。用离心超滤法纯化产生的EPI负载的脱乙酰壳多糖PLGA纳米颗粒,使用3 250 g的Centrisart I(MWCO 300 KDa),3℃超滤离心20 min除去过量的药物和聚合物,在4℃下保存。使用Malvern Zetasizer Nano ZS(Malvern Instruments,Malvern,UK)测定负载EPI的NP性质(平均粒径、多分散系数和Zeta电位)。
通过分别测定NP和上清液中被包封的和游离的EPI的浓度来确定包封效率(EE)。将EPI-NP在3 250 g的Centrisart I(MWCO 10 KDa)中离心20 min,然后通过HPLC测定上清液中的游离EPI。此外,纯化的NP被溶解在乙腈中,然后采用C18反相柱(美国安捷伦科技公司)进行HPLC分析,对封装的EPI进行定量。流动相为乙腈-0.02 M磷酸二氢钠-三乙胺(体积比34∶66∶0.3,pH 4),流速为1 ml/min。紫外分光光度计检测240 nm波长的峰值。实验进行3次。记录平均值和标准差。
1.5 体外释放EPI EPI-NPs置于透析袋(MWCO 10 kDa),浸于磷酸缓冲液(5 ml,pH 7.4)中,100 rpm,37℃下摇匀,在预定的时间点通过HPLC测定释放的EPI的浓度。
1.6 体外细胞存活率测定 通过MTT法测定游离EPI,EPI-NP以及EPI-NP结合Ts(10 μmol/L)在不同EPI浓度(0.25~2 μg/ml)下对HepG2细胞的细胞毒性。HepG2细胞(106个细胞/ml)接种于96孔板(0.2 ml/孔)中,并在37℃、5% CO2、95%相对湿度条件下孵育48 h。各组HepG2细胞分别加入不同药物孵育3 h,并研究不同Ts浓度(10、20、30 μmol/L)对药物作用的影响,以含空白NP、2% Triton X-100的DMEM孵育的HepG2细胞作为对照组。各组HepG2细胞用PBS洗涤两次,加入0.5% MTT溶液再孵育3 h后,按0.5 ml/孔加入酸化的异丙醇溶解甲瓒晶体,并测量540 nm吸光度。细胞存活率用平均值和标准差表示。根据剂量反应曲线确定半数最大抑制浓度(IC50)值。实验设置4复孔。
1.7 在小鼠体内的研究
1.7.1 HCC诱导 每周腹膜内注射75 mg/kg DEN持续3周,然后注射100 mg/kg DEN持续3周诱导HCC。在最后一次注射DEN后2周,通过肝组织切片的病理组织学检查证实诱导肿瘤成功。将小鼠随机分为8组(每组8只小鼠),4组为药物治疗组,即游离EPI组(1.25 mg/kg EPI-PBS溶液)、EPI-NPs组(1.25 mg/kg EPI-NPs溶液)、EPI-NPs/低剂量Ts组(14.6 mg/kg EPI-NPs/Ts橄榄油溶液)、EPI-NPs/高剂量Ts组(62.5 mg/kg EPI-NPs/Ts橄榄油溶液),其中EPI/PBS溶液和EPI-NPs溶液分别在第4 d和第6 d进行腹腔内注射,而Ts是通过灌胃橄榄油溶液给药;4组为对照组,包括正常对照组、HCC对照组、空白NPs对照组和橄榄油对照组。实验期结束时,处死动物。
1.7.2 抗肿瘤活性评估 将切除的小鼠肝脏切成切片用于组织病理学,免疫组织化学检查以及血管内皮生长因子(VEGF)测定。将小鼠肝脏的组织标本固定在10%的中性福尔马林缓冲液中,梯度浓度乙醇脱水,二甲苯透明化,石蜡包埋,制备4~5 μm石蜡切片进行常规HE染色进行组织病理学分析。
1.7.3 心脏毒性评估 采集实验小鼠心脏组织,制备组织匀浆用于心脏毒性评估。
1.7.3.1 谷胱甘肽(GSH)的测定:将200 ml三氯乙酸(TCA)心脏组织匀浆加到4.7 ml 0.1 mmol/L磷酸钠缓冲液(pH 8)中,然后加入100 ml 0.01 mmol/L 5,50-二硫代双-2-硝基苯甲酸(DTNB)并立即涡旋,25 min后分光光度法检测412 nm处吸光度。
1.7.3.2 硫代巴比妥酸反应性物质(TBARS)的测定 将0.1 ml心脏组织匀浆与等体积的十二烷基硫酸钠(SDS)溶液混合,然后添加0.75 ml乙酸、0.75 ml硫代巴比妥酸(TBA)和1 ml蒸馏水,涡旋混合后沸水温浴1 h,冷却后在正丁醇中萃取。在535 nm下检测分离的有机层的吸光度,以确定MDA的浓度(nmol/ml)。
1.7.3.3 超氧化物歧化酶(SOD)活性的测定 通过邻苯三酚法检测SOD活性,即SOD活性抑制超氧阴离子自由基的产生、抑制邻苯三酚自氧化,导致420 nm处吸光度的增加。1个单位的SOD活性定义为可将邻苯三酚的自氧化率抑制50%的酶量。
1.7.3.4 硝酸盐和亚硝酸盐浓度的测定 通过Griess方法测定硝酸盐/亚硝酸盐浓度。首先亚硝酸盐在酸性介质中用重氮化试剂(磺酰胺)处理以形成瞬态重氮盐,然后使该中间体与偶联剂N-(1-萘基)乙二胺反应,形成稳定的偶氮化合物,分光光度法测定540 nm吸光度。
1.7.3.5 肿瘤坏死因子-α(TNF-α)的测定 根据酶联免疫吸附测定法(ELISA),使用ELISA试剂盒(eBioscience)并根据制造商说明测量上清液中的TNF-α。
1.8 统计学方法 使用Kolmogorov-Smirnov检验对定量变量的分布进行了正态检验。对于正态分布的数据,单向方差分析和事后检验(Scheffe's)进行多重比较。对于非正态分布的数据,使用KruskalWallis检验比较,使用Mann-Whitney检验对两组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1 EPI-NPs的特性 EPI在壳聚糖包被的PLGA NP中粒径从135 nm增大至283 nm,并且PDI由0.14增加到0.23,Zeta电位显着降低。NPs性质见表1。NPs的EPI体外释放可分为两个阶段:在初始阶段,EPI在最初的6 h释放率低(<15%),随后为持续释放期,见图1。

表1 纳米粒结构特点
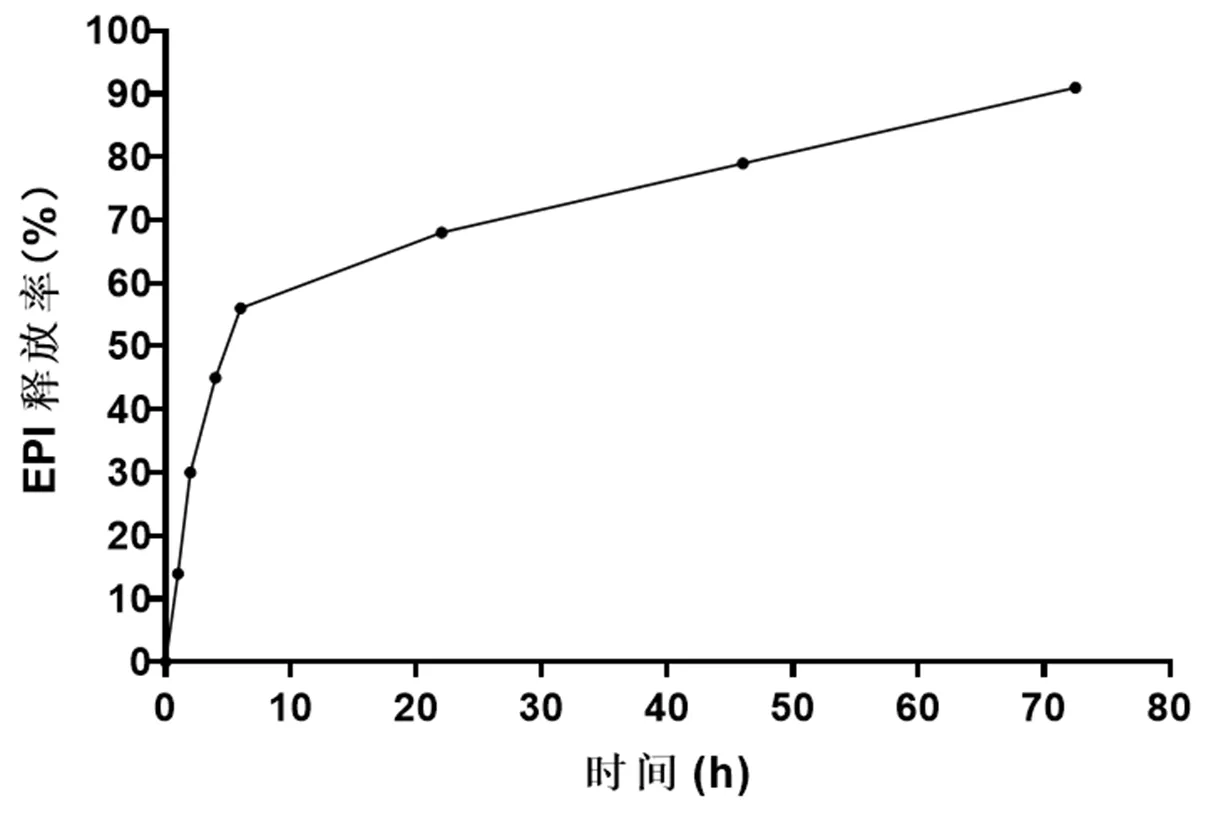
图1 NPs的EPI体外释放
2.2 体外培养细胞存活率测定 游离EPI的细胞存活率>90%,EPI-NP导致细胞存活率显着下降(P<0.05),IC50为0.9 μg/ml;而EPI-NPs中添加Ts后(10 μmol / L)细胞存活率上升,IC50约为2 μg / ml,见图2A。使用EPI-NP(0.25 μg / ml)的Ts(10、20、30 μmol / L)研究了Ts浓度对细胞活力的影响,观察到细胞存活率呈浓度依赖性地从93.9%降低至60.4%,见图2B。
2.3 EPI在HCC小鼠体内的抗肿瘤活性 EPI组小鼠肝组织出现点状坏死,而EPI-NPs治疗组出现轻度细胞凋亡和大面积坏死;在EPI-NPs/Ts联合治疗中,含浓缩染色质的凋亡肝细胞变得更加明显,尤其是在较高的Ts剂量下。相比之下,正常对照组、HCC组、空白NPs组和橄榄油组未检测到凋亡细胞。各组实验小鼠肝组织病理情况见图3。游离EPI治疗显著降低实验小鼠肝组织VEGF水平(P<0.001),EPI-NPs治疗组小鼠肝组织VEGF水平进一步降低(P<0.001),使用Ts辅助治疗时小鼠肝组织VEGF水平显著协同下降(P<0.001)。各组实验小鼠肝组织VEGF水平见图4。

图2 体外细胞活力测定(A.与游离EPI、EPI-NPs以及EPI-NPs/Ts孵育后HepG2的细胞活力,B.不同浓度Ts对细胞活力的影响)
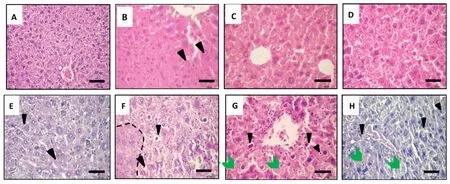
图3 各组实验小鼠肝组织病理图(HE染色,400×;A.正常对照组;B.HCC组;C.空白NPs组;D.橄榄油组;E.EPI组;F.EPI-NPs组;G.EPI-NPs/低剂量Ts组;H.EPI-NPs/高剂量Ts组)

图4 各组实验小鼠肝组织VEGF水平
2.4 HCC小鼠的心脏毒性 心脏/体重比值(HW/BW)降低是出现心脏毒性的常见标志,游离EPI治疗组小鼠HW/BW比值最低,在62.5 mg/kg EPI-NPs/Ts组小鼠HW/BW比值几乎恢复到对照组水平,见图5。与对照组比较,游离EPI治疗后实验小鼠心脏组织MDA水平增加;与游离EPI治疗组比较,EPI-NPs治疗组MDA水平显着降低(P<0.001),而结合Ts共同给药使其进一步降低;见图6A。游离EPI处理后实验小鼠心脏组织GSH水平最低,EPI-NPs治疗后GSH水平与HCC组水平一致,且GSH水平随Ts剂量增加显著增加(P<0.001),见图6B。与HCC组相比,EPI显著降低了实验小鼠SOD活性;与游离EPI治疗组相比,EPI-NPs治疗显著升高SOD活性(P<0.001),且SOD活性也随Ts剂量增加而显著增加,高剂量Ts使SOD活性恢复到HCC组水平,见图6C。游离EPI治疗后实验小鼠体内测出了高浓度的硝酸盐/亚硝酸盐,而EPI-NPs组水平显著降低(P<0.001),Ts结合EPI-NPs可使浓度恢复到HCC组的水平,图6D。与游离EPI组比较,EPI-NPs的使用以及与Ts的进一步组合均可降低TNF-α水平,见图6E。
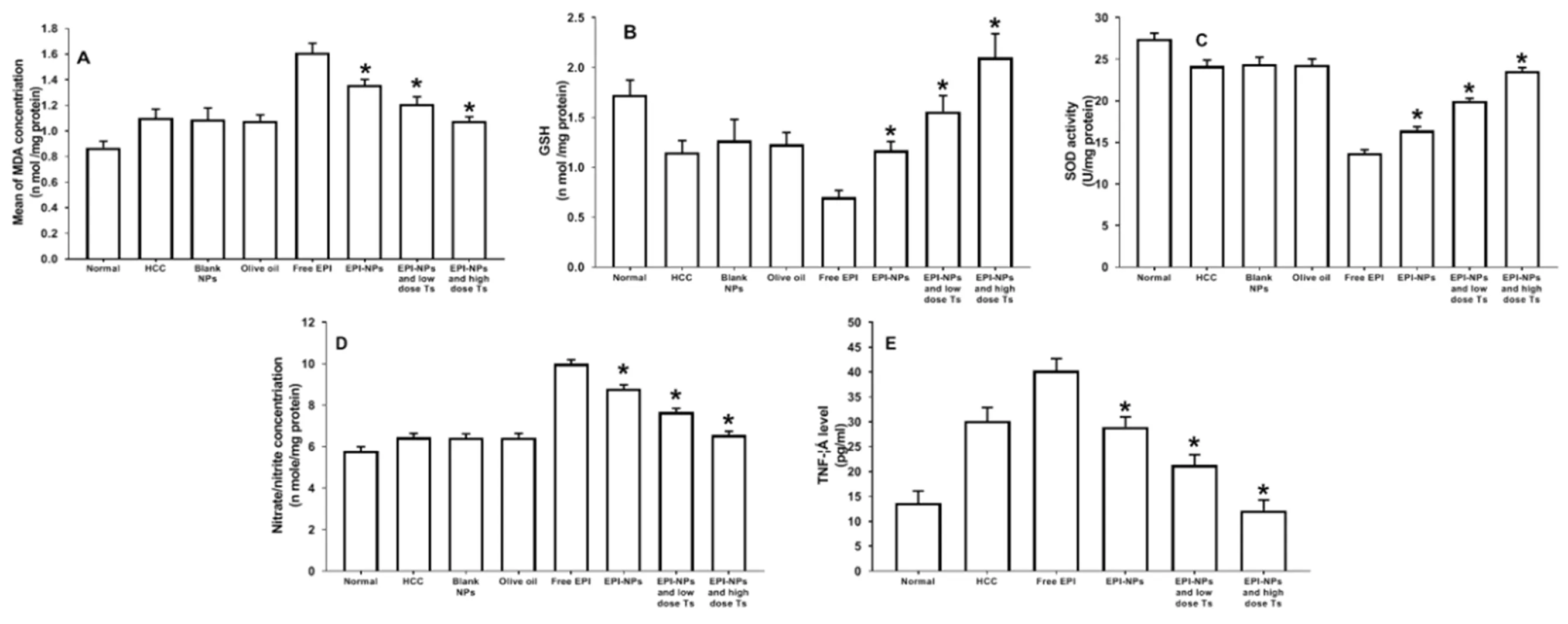
图6 各组实验小鼠心脏毒性指标比较(A.MDA;B.谷胱甘肽;C.SOD活性;D.硝酸盐或亚硝酸盐;E.TNF-α)

图5 各组实验小鼠HW/BW比值
3 讨论
蒽环类药物治疗HCC等耐药性癌症所呈的剂量依赖性会增加心力衰竭风险,从而限制其临床应用。本研究使用强效抗氧化剂(生育三烯酚)作为辅助治疗降低蒽环类药物产生的心脏毒性,并选择壳聚糖修饰的PLGA纳米粒子作为载体。据报道,壳聚糖-PLGA NPs给药可延长其在血液中的循环,从而显示出比游离药物更好的体内治疗效果[9]。壳聚糖-PLGA NPs表现出高包封率,并能使EPI在3 d内受控释放,从而使肿瘤持久地暴露于药物中。EPI由于具有疏水性蒽环和亲水糖基团,因此是两亲性弱碱(pHa=7.7)。先前研究发现EPI的释放与pH有关,在pH>7.4时慢,在酸性pH中更快,这提示其较高的细胞内释放率[10]。该研究还表明,在聚氰基丙烯酸丁酯纳米粒(PBCA-NPs)中包封的EPI,在最初的3 h内最大包封效率为50%,药物的50%迅速释放,其余药物在整个过程中均与颗粒紧密结合[10]。
EPI在靶向肝细胞的NP中的封装增强了其对HepG2细胞的抗增殖作用,这很可能是由于细胞摄取药物能力的增强和EPI在肝细胞中的大量积累所致。相对于游离EPI(细胞存活率>90%),EPI-NP与Ts共同给药后,细胞存活率显著降低。本研究还观察了Ts作为靶向肝细胞的NPs的辅助抗癌治疗手段的效果。在EPI-NP中添加10 μmol/L Ts导致IC50略有增加。尽管Ts具有强大的抗血管生成活性,但其为强抗氧化剂,可中和自由基并破坏脂质过氧化的链反应,从而保护细胞膜[7]。之前有报道称,Ts对包含EPI在内的化学治疗剂治疗的肿瘤细胞具有增敏作用,并证实Ts的安全性和耐受性[11]。 Postescu等[12]发表了类似的结果,表明Ts降低了阿霉素的细胞毒性。用靶向的EPI-NP孵育HepG2细胞并提高Ts的浓度会导致细胞毒性潜能的浓度依赖性增加,从而揭示Ts的协同抗增殖作用。我们对HCC小鼠的体内测定结果与对HepG2细胞的体外测定结果是一致的。肝脏的组织病理学检查显示,在游离EPI处理的小鼠中,HCC分化良好,有斑点坏死,在EPI-NPs处理组中坏死更为显着。据报道,在乳腺癌大鼠模型中,负载EPI的丙二醇脂质体的观察结果相似[13]。此外,通过增加Ts浓度,小体的凋亡更为频繁。Ts显著增强了EPI-NPs治疗组的细胞凋亡,但抑制了坏死。
血管生成对于肿瘤生长和转移的传播是必不可少的,VEGF是血液中内皮细胞的生存因子,其升高提示肿瘤血管生成的促进[7]。未经治疗的HCC小鼠的肝VEGF水平高于正常水平。与其他蒽环类药物一样,EPI治疗后VEGF表达下调。EPI-NPs给药下,VEGF水平进一步降低,提示EPI-NP对肿瘤血管形成具有强效抑制作用,并通过长时间释放药物使血管平滑肌细胞增殖被完全抑制。Ts与EPI-NPs并用导致肝VEGF水平严重下降,这与先前研究Ts在体外及体内对VEGF作用的报道相吻合[11,14]。Ts通过下调VEGF和VEGF受体的表达来抑制VEGF依赖性肿瘤血管生成。VEGF信号传导途径的配体和受体的同时减少可能解释了Ts对炎症或与肿瘤相关的血管生成的严重抑制。
在蒽环类化疗中,心脏毒性依旧是一个值得重视的问题。尽管其机制尚未明确,但可能与EPI产生自由基所引起的氧化应激有关,该反应导致了内皮细胞凋亡。在本研究中,氧化应激反应通过EPI治疗后GSH的降低和TBARS的升高体现。在肝细胞靶向的NP中封装EPI会限制药物进入其他组织(如心脏)。因此,EPI-NP的使用可保护心脏组织免于脂质过氧化,并降低了EPI对SOD活性的抑制作用。根据先前报道,Ts辅助治疗可抑制TBARS水平并改善GSH水平[15]。除本身具有抗氧化性能外,Ts通常还可以通过与抗过氧化物酶(包括SOD)相互作用而影响氧化应激。
在mRNA和蛋白质水平上,重复给予蒽环类药物均会通过增加诱导型一氧化氮合酶(iNOS)蛋白的表达而不影响组成型一氧化氮合酶(cNOS)的表达来诱导心肌内一氧化氮的产生。本研究中NP的靶向特性以及Ts的抗氧化潜力降低了硝酸盐/亚硝酸盐水平,从而降低了EPI引起的心脏毒性。TNF-α与心脏肥大和功能障碍有关,我们的体内研究表明,用EPI治疗后,HCC小鼠心脏中的TNF-α水平升高,而用EPI-NPs与Ts联合治疗的小鼠的TNF-α水平则明显降低了。如先前报道,Ts通过抑制脂多糖诱导下产生的一氧化氮、前列腺素E(2)和炎症前细胞因子(TNF-α、IFN-c、IL-1b和IL-6)表现出强大的抗炎活性[16]。因此,Ts的抗氧化和抗炎机制有助于抵抗EPI诱导的心脏毒性,起到心脏保护作用。
总之,这项研究为肝癌化疗的两个重要方面提供了明确的证据:首先,在肝癌化疗中,使用基于靶向纳米技术的治疗方案比游离药物治疗更有效,通过降低癌细胞耐药性和提高药物效率,在小鼠模型中对抑制HCC中起了重要作用。第二,纳米颗粒/生育三烯酚的联合疗法减轻了药物心脏毒性的副作用。该治疗方案在抗肿瘤活性和安全性的双重改善可能可以为HCC的临床治疗带来更多希望。
