中药复方和益生素对热应激大鼠肠道菌群的影响
2022-01-17黎增权郭世宁石达友
李 桦,黎增权,屈 倩,刘 翠,郭世宁,石达友
(1. 广州医科大学附属第二医院,广东 广州 510260 ; 2. 华南农业大学兽医学院,广东 广州 510642)
热应激的机制被认为是由中枢神经系统而不是周围器官的紊乱引起的,对肠道功能的理解也集中在营养物质的消化和吸收上[1-2]。补益类中药所含多糖成分对于肠道益生微生物有扶植作用,其所产的代谢物又对致病微生物的生长有间接抑制作用[3-5]。口服中药被机体肠道菌群代谢后,产生的代谢产物具有高效药理作用[6-8]。多糖、皂苷、黄酮类等物质是中药药效的基础成分,在宿主肠道菌群或与宿主共代谢的条件下,可促进乳酸杆菌、双歧杆菌的繁殖,导致大肠杆菌等肠道致病菌繁殖受阻[9]。本试验旨在探讨大鼠热应激与肠道菌群变化的关系,并为中药复方和益生素干预热应激的作用机制提供理论依据。
1 材料与方法
1.1 实验动物 试验在华南农业大学实验动物中心开展[许可证号:SYXK(粤)2019—0136]。7周龄SPF级雄性Wistar大鼠,(180±10) g,购自南方医科大学实验动物中心,质量合格证号:440021000005777。
1.2 试验药品与制备 中药复方由紫锥菊、黄芩、藿香、香薷、石膏、陈皮、白术、甘草8味中药组成,其中香薷、藿香和陈皮加8倍量水泡0.5 h,提取挥发油5 h,收集挥发油备用,蒸馏后的水溶液另器收集。药渣与其余5味药材加10倍量水煎煮3次,每次2 h,合并煎液,滤过,减压浓缩至含量为1.12 g/mL生药,滤过,即得。益生素:上海申亚动物保健有限公司,批号:5405201506HF。大鼠血清HSP70试剂盒,南京建成生物技术有限公司,批号:DZE30341。
1.3 试验设计 20只成年Wistar雄性大鼠,随机分成4个组,每组5只,常温空白组(Normal temperature control group, NC group)、中药组(Traditional Chinese medicine group, TCM group)、益生素组(Probiotic group, Pro group)和热应激组(Heat stress group, HS group)。常温空白组于温度20~26 ℃环境下饲养;其余3个组用室内加热器将环境温度保持在35~38 ℃,湿度在50%~60%。中药组在热应激下,每天按7 mg/(kg·bw)灌服中药,灌服浓度和体积按实验动物质量计算[10],益生素组灌服与中药组等体积0.04%益生素,热应激组和常温空白组分别于热应激下和常温下灌胃等量生理盐水,自由饮水、采食,试验期7 d。分别在热应激3 h、1 d、3 d和7 d后,麻醉后腹主动脉采血,用于检测血清HSP70蛋白,采用抗大鼠 HSP70 单抗包被于酶标板上,标准品和样品中的 HSP70与单抗结合的双抗体夹心 ABC-ELISA法。收集盲肠内容物约5 g,提取总DNA,进行16S rDNA v3~v4段测序和盲肠肠道微生物群分析。
1.4 生物信息学与统计分析 剔除小于200 bp且不明确的碱基标记,合并相同或重复的序列,检查并移除嵌合体序列。α多样性包括Chao 1指数、Shannon指数和稀释曲线。通过单样本分析(α多样性)可以反映微生物群落的丰度和多样性,包括一系列统计分析指标来估计环境群落物种的丰度和多样性。β多样性分析包括主成分分析(PCA)和主坐标分析(PCOA),样本间的差异和距离可以通过PCA用方差分解来反映,如样品的组成比较相似,反映出PCA图中距离越近。通过PCOA分析得到不同样本的距离矩阵信息。群落功能预测与分析是将每个试验组的肠道微生物基因集与基因组数据库(KEGG)进行比较,通过构建测序基因组的功能基因获得16S rDNA测序中的物种组成信息。
2 结果
2.1 大鼠不同时期血清HSP70浓度的变化 由表1可知,热应激各时期,热应激组血清HSP70浓度均极显著升高(P<0.01);热应激3 h到热应激3 d,中药组和益生素组大鼠血清HSP70浓度差异不显著(P>0.05)。

表1 大鼠不同时期血清HSP70浓度Table 1 Serum HSP70 concentration in rats at different stages (ng/L,n =5)
2.2 热应激对大鼠肠道菌群α多样性指数的影响热应激3 h、1 d、3 d和7 d各试验组之间的多样性指数分别如表2~5所示。由表2可知,热应激3 h时,中药组Chao1指数和Shannon指数与热应激组相比显著升高(P<0.05),中药组PD_whole_tree极显著高于热应激组(P<0.01),常温空白组Shannon指数显著高于热应激组(P<0.05);由表3可知,热应激试验1 d时,各组多样性指数无显著差异(P>0.05);由表4可知,热应激3 d时,热应激组Chao1指数和Shannon指数显著低于中药组(P<0.05)和常温空白组(P<0.05),各组PD_whole_tree指数无显著差异(P>0.05),中药组Shannon指数与益生素组相比显著升高(P<0.05);由表5可知,热应激7 d时,益生素组Chao1指数和PD_whole_tree指数分别与热应激组相比显著和极显著升高(P<0.05和P<0.01),而热应激组Chao1指数和PD_whole_tree指数分别与常温空白组相比也显著和极显著降低(P<0.05和P<0.01),各试验组Shannon指数无显著差异(P>0.05)。可见,大鼠盲肠肠道微生物的多样性因处热应激环境而降低,通过中药复方口服液和益生素,可使热应激下肠道菌群物种多样性处于高于正常水平,从而抵御热应激对肠道的损伤。

表2 热应激3 h各试验组肠道菌群多样性指数Table 2 Intestinal microflora diversity index of each experimental group after 3 hours of heat stress
表3 热应激1 d各试验组肠道菌群多样性指数Table 3 Intestinal microflora diversity index of each experimental group after 1 day of heat stress

表4 热应激3 d各试验组肠道菌群多样性指数Table 4 Intestinal microflora diversity index of each experimental group after 3 days of heat stress

表5 热应激7 d各试验组肠道菌群多样性指数Table 5 Intestinal microflora diversity index of each experimental group after 7 days of heat stress
2.3 热应激对大鼠肠道微生物群β多样性指数的影响 本试验采用了主成分分析(PCA)和基于UniFrac距离上对各试验组之间进行加权(Weighted)和非加权(Unweighted)的主坐标分析(PCoA)。见图1,代表2个样本的点的距离越近其样本组成越相似。在热应激3 h阶段,各试验组组内数据比较集中,各组内个体差异较小,中药组、益生素组和热应激组的肠道菌群开始出现差异性,说明在经历热应激3 h时各组大鼠盲肠肠道菌群开始出现变化,与常温大鼠的肠道菌群多样性相比,这种变化由中药复方、益生素引起;到了热应激7 d,各试验组组内散点基本聚在一起,说明各组内个体差异较小,常温空白组与其余3个组的散点、热应激组与其余3个组散点,还有常温空白组与热应激组散点完全分开,而中药组与益生素组的散点基本交叠,表明大鼠经历了7 d热应激后,未经治疗的热应激大鼠肠道菌群多样性与常温大鼠相比已有明显差异,这是由热应激带来的损伤引起的;7 d热应激过程中,一直用中药复方和益生素治疗确实对大鼠盲肠肠道菌群多样性差异带来显著影响,而中药和益生素产生的积极影响相似。

图1 各试验组大鼠肠道菌群多样性差异的PCA分析Fig.1 PCA analysis of differences in intestinal flora diversity among each experimental groupA:热应激3 h后; B: 热应激7 d后; 黑色:中药组; 红色:益生素组; 绿色:热应激组; 蓝色:常温空白组A:3 h after heat stress; B:7 d after heat stress; Black:Traditional Chinese medicine group; Red:Probiotic group; Green:Heat stress group; Blue:Normal temperature control group
如图2所示,在热应激3 h,基于UniFrac分析的非加权和加权差异分析,第1主成分和第2主成分的贡献率分别为13.99%、8.71%和52.76%、12.92%,各试验组组内出现比较明显的分离,但试验组间趋向于不同象限,说明大鼠盲肠肠道微生物的多样性差异因热应激环境以及口服中药与益生素发生变化。如图3所示,在热应激7 d,第1主成分和第2主成分的贡献率分别为29.21%、18.84%和9.67%、8.68%,各试验组散点完全分离,组间象限分布趋势较试验3 h时明显,其中热应激组和常温空白组分离的距离最远,中药组和益生素组介于中间,但分离距离与常温空白组靠近。说明随着热应激的进行,各试验组肠道菌群多样性的差异较在热应激3 h明显,随着热应激下口服中药复方和口服益生素,热应激大鼠肠道微生物多样性有趋向于正常大鼠的变化。

图2 热应激3 h后的加权(A)和非加权(B)分析Fig.2 Weighted(A) and Unweighted(B) analysis charts after 3 hours of heat stress红色:中药组; 深蓝色:热应激组; 青色:益生素组; 绿色:常温空白组;下图同Red:Traditional Chinese medicine group; Dark blue:Heat stress group; Cyan:Probiotic group; Green:Normal temperature control group. The same as the following figures
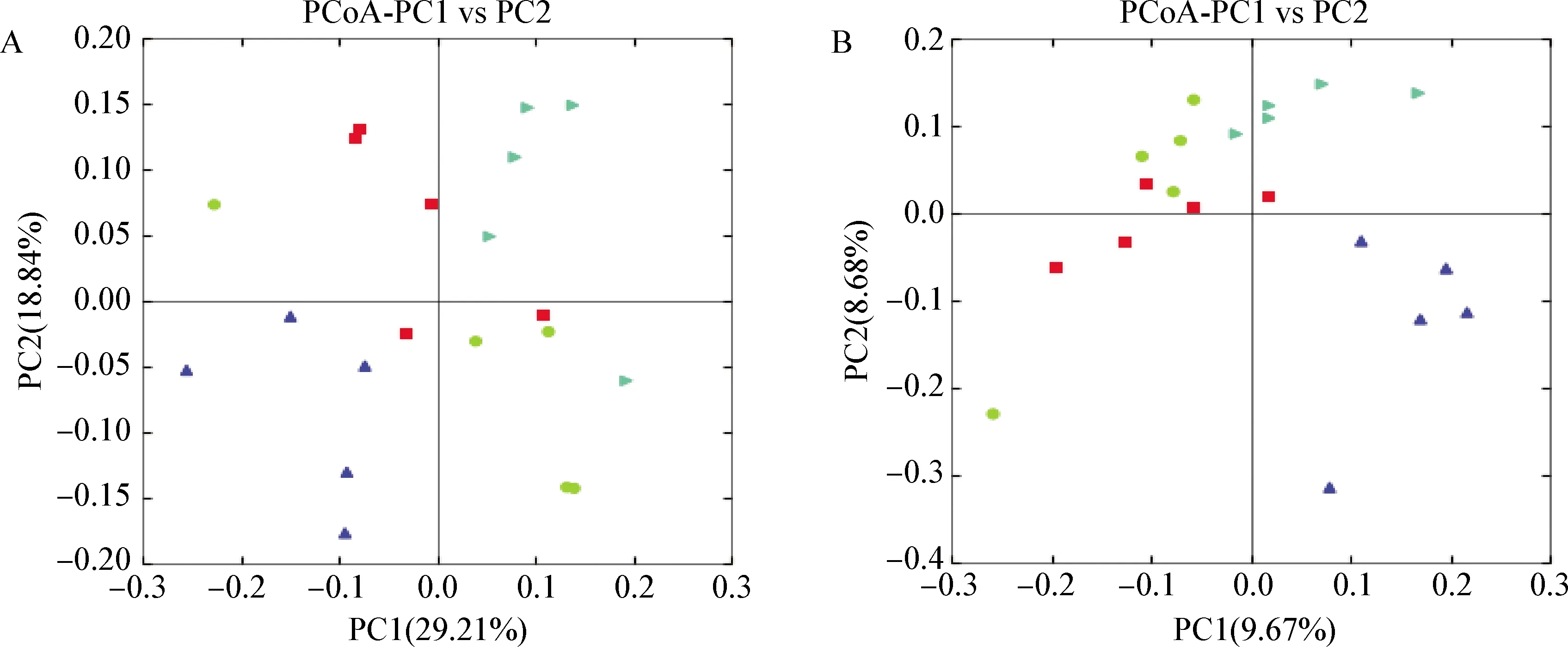
图3 热应激7 d后的加权(A)和非加权(B)分析图Fig.3 Weighted(A) and Unweighted(B) analysis after 7 days of heat stress
2.4 物种丰度与群落组成分析 本试验采用Pynast软件和Greengenes数据库,比较各试验组已知序列属水平相对丰度。如图4,试验在热应激3 h时,益生素组梭菌属与热应激组相比显著降低(P<0.05),热应激组梭菌属也显著高于常温空白组(P<0.05),中药组颤螺旋菌属(Oscillospira)均极显著高于其余3个试验组(P<0.01),益生素组的瘤胃球菌属显著高于热应激组(P<0.05),中药组的拟杆菌属也显著高于常温空白组(P<0.05);热应激1 d时只有4个菌属显著变化,其中中药组乳酸杆菌属(Lactobacillus)均极显著高于各试验组(P<0.01),益生素组的乳酸杆菌属也显著高于热应激组,中药组毛螺菌属含量显著低于益生素组和热应激组(P<0.05);在热应激3 d时,有15个菌属有显著性差异,其中热应激组与常温空白组相比乳酸杆菌属极显著降低(P<0.01),中药组拟杆菌属(Bacteroides)和脱硫弧菌属(Desulfovibrio)与常温空白组相比显著升高(P<0.05),益生素组颤螺旋菌属(Oscillospira)也显著高于常温空白组;而到了热应激7 d时,菌属的差异性变化有18个,随着热应激的进行,常温空白组的拟杆菌属(Bacteroides)与各试验组相比均极显著升高(P<0.01),与热应激组相比,各试验组颤螺旋菌属和瘤胃球菌属均极显著升高(P<0.01),中药组粪球菌属(Coprococcus)显著高于常温空白组(P<0.05),各试验组毛螺菌属显著高于热应激组(P<0.05),但中药组、益生素组和热应激组3个试验组的梭菌属比常温组的显著升高(P<0.05)。说明热应激下肠道微生物的一些优势菌属发生了变化,中药与益生素的治疗在热应激阶段对肠道优势菌属有一定的积极作用。
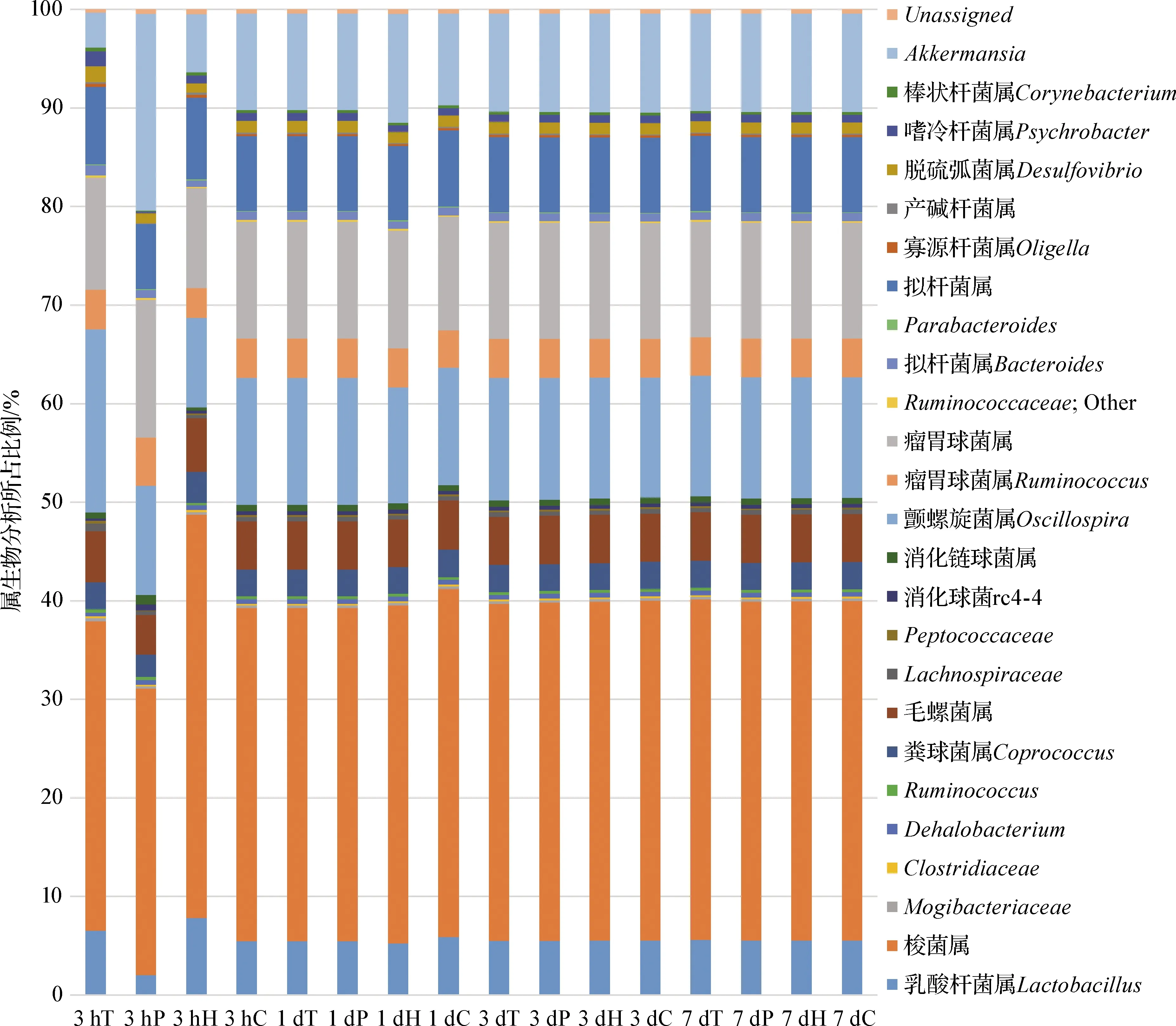
图4 各试验组不同时期肠道菌群属生物分类水平占比Fig.4 Proportion of intestinal microflora in different periods of each experimental group3 hT、1 dT、3 dT和7 dT:中药组分别在热应激3 h、1 d、3 d和7 d肠道菌群属分类所占比例; 3 hP、1 dP、3 dP和7 dP:益生素组分别在热应激3 h、1 d、3 d和7 d肠道菌群属分类所占比例; 3 hH、1 dH、3 dH和7 dH:热应激组分别在热应激3 h、1 d、3 d和7 d肠道菌群属分类所占比例; 3 hC、1 dC、3 dC和7 dC:常温空白组分别在试验3 h、1 d、3 d和7 d肠道菌群属分类所占比例3 hT,1 dT,3 dT and 7 dT: Proportion of intestinal flora classification of traditional Chinese medicine group at 3 h,1 d,3 d and 7 d of heat stress; 3 hP,1 dP,3 dP and 7 dP: Proportion of intestinal flora classification of probiotic group at 3 h,1 d,3 d and 7 d of heat stress;3 h H,1 dH,3 dH and 7 dH: Proportion of intestinal flora classification of heat stress group at 3 h,1 d,3 d and 7 d of heat stress;3 hC,1 dC,3 dC and 7 dC: Proportion of intestinal flora classification of normal temperature control group at 3 h,1 d,3 d and 7 d
2.5 KEGG群落功能预测注释 本试验通过种属功能基因构成共获得6 909个与KEGG数据库有显著配对的功能基因,这些途径被分为5个主要种类:代谢(Metabolic)、遗传信息处理(Genetic information processing)、环境信息处理(Environment information processing)、细胞过程(Cellular processes)和生物系统(Organismal systems)。5个功能分类,选出35个主要的KEGG途径,主要的KEGG途径如图5所示。各试验组生物途径的变化主要集中在代谢、遗传信息处理、环境信息处理和细胞过程这4类生物途径,其中热应激组各种生物途径均比其余3个试验组活跃,与其他各试验组相比,热应激组在糖代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)和膜转运(Membrane transport)的基因表达活跃,中药组、益生素组和常温空白组各生物途径差异不显著,且中药组生物路径上的基因活动最低,益生素组的生物路径与常温空白组接近,说明:(1)热应激下,机体多个生物功能途径反应剧烈,以糖代谢、氨基酸代谢和膜转运最为活跃;(2)热应激下通过中药复方口服液和益生素的治疗,各生物功能途径趋于正常,其中益生素组与常温空白组最接近。
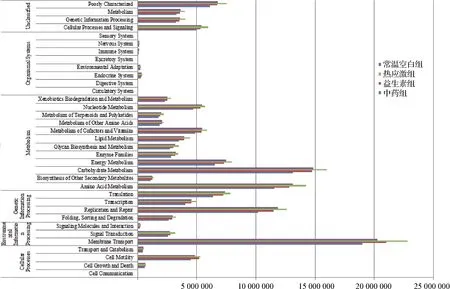
图5 功能基因的KEGG统计Fig.5 KEGG statistics of functional genes
3 讨论
热休克蛋白(Heat shock proteins,HSPs)被认为是机体受到热应激之后产生的保护细胞的蛋白质家族,在机体发生应激的过程中,其他蛋白的合成受到抑制,热休克蛋白大量合成。热休克蛋白可分为不同的蛋白分子,其中的HSP70蛋白家族,在温度变化等应激反应下最具有指导意义。
中医的阴阳消长平衡与机体肠道菌群的平衡有着相似之处。在机体的肠道菌群活动也处于这种消长的变化中,肠道菌群出现失调,机体就会发生疾病[11]。采用16S rDNA 的变性梯度凝胶电泳(DGGE)技术,对热应激蛋鸡小肠段肠道微生物的多样性和数量进行检测,发现热应激下肠道微生物菌株丰富,且对乳酸杆菌等优势菌属有抑制作用[12]。社会混乱(Social disruption,SDR)应激会降低拟杆菌属的相对丰度,增加梭菌属的相对丰度[13]。本试验可得出,大鼠盲肠肠道微生物的多样性由于处在热应激环境而降低,通过灌服中药复方和益生素,可以使热应激下肠道菌群物种多样性恢复至高于正常水平,从而抵御热应激对肠道的损伤。
通过主成分分析(PCA)和主坐标分析(PCoA)对各试验组在热应激3 h和热应激7 d肠道菌群的组成进行了整体的评价,可以看出热应激3 h时,中药组、益生素组和热应激组的肠道菌群菌落开始出现差异性的趋势,热应激7 d后,未经治疗的热应激大鼠肠道菌群多样性与常温大鼠相比已有明显差异,这是由热应激带来的损伤引起的,7 d热应激过程中,一直用中药复方和益生素治疗确实对大鼠盲肠肠道菌群多样性差异带来显著影响,而中药和益生素产生的积极影响相似。
中药含有的成分多糖、生物碱、皂甙和黄酮等在肠道菌群转化为有活性的生物物质,反过来也会影响肠道菌群的生长模式[14-16]。本试验中,中药复方在热应激发挥的作用,有可能是复方中含有黄芩,黄芩苷通过肠道微生物水解成黄芩素,从而在机体发挥更重要的生理作用。芳香类药物的藿香、香薷和陈皮提取挥发油,其中的藿香挥发油,可通过抑制细胞因子TNF-Q(肿瘤坏死因子Q)的合成,减少对肠道上皮优势菌群的侵害,从而保护肠上皮细胞的结构组成与功能,达到保护肠屏障功能的作用[17-18]。
本试验中,热应激下肠道微生物的一些优势菌属发生了变化,乳酸菌属极显著减少,梭菌属增加,中药组的拟杆菌属和益生素组的乳酸菌属显著升高,说明中药与益生素的治疗在热应激阶段对肠道优势菌属有一定的积极作用。肠道细菌可以合成参加反应的激素和神经递质,乳酸杆菌能产生乙酰胆碱和γ-氨基丁酸(GABA),双歧杆菌能产生γ-氨基丁酸,链球菌和肠球菌能产生血清素,大肠杆菌能产生去甲肾上腺素、血清素和多巴胺,芽孢杆菌能产生去甲肾上腺素和多巴胺[20]。有研究指出,大肠杆菌和变形菌门的大量增加是由于生理浓度的去甲肾上腺素的释放,是应激反应对感染的直接影响[21]。益生菌和益生素对肠道的保护是通过减少肠道通透性,减少肠道对内毒素的吸收,减少炎性细胞因子的产生。中枢神经系统和神经内分泌活动,特别是应激反应,可能反过来通过改变细菌种类和细菌毒力因子的生长影响肠道微生物群的组成[22]。肠道细菌及其分泌物影响肠神经系统(ENS)的神经兴奋,调节肠道运动和感觉传入向大脑传递信号[23]。KEGG被认为是提供一个系统分析基因功能的基本平台,从组装基因进一步预测生化途径[24]。本试验得出,热应激状态下,机体通过糖代谢、氨基酸代谢和膜转运的变化来防御外界应激[25],从而影响全身从血液到肠道相互作用的变化。
