胰腺炎患犬肠道菌群构成的多样性分析
2022-01-17杨晓雯王家伟吴清民
项 夫,杨晓雯,王家伟,吴清民
(1.中国农业大学动物医学院,北京 海淀 100193 ; 2.北京宠爱国际动物医院,北京 朝阳 100124 ; 3.中国疾病预防控制中心传染病预防控制所,北京 昌平 102206)
犬胰腺炎是指胰腺分泌的胰蛋白水解酶在病理条件下被激活,对自身的组织器官造成损伤,进而导致全身性炎症反应的一种疾病[1]。该病常见于犬和猫,病死率高。临床上呈现出从急性到慢性、从轻度到严重程度不等的一系列病症。转为慢性型则可能引起顽固性疼痛、进行性胰腺外分泌和内分泌功能障碍[2]。犬胰腺炎发病机制尚不明确,通常与环境变化、应激和饲料结构不合理或高脂肪物质饲喂过量等有关[3]。犬肠道菌群能为机体提供营养和能量,调节机体免疫反应,拮抗病原微生物,甚至影响宿主的行为[4-5]。研究发现,细菌16S rRNA基因具有保守区和可变区交替排列的特征,其保守区能反映物种的亲缘关系,可变区序列具有种属特异性。因此,近年来细菌16S rRNA基因测序分析在肠道复杂菌群分类与鉴定中得到广泛应用[6]。本试验基于16S rRNA扩增子测序技术,分别对健康犬和胰腺炎患犬的粪便样品进行检测分析,探索其肠道菌群组成及多样性变化和肠道菌群功能变化,旨在为胰腺炎患犬肠道菌群组成提供基础数据,同时为胰腺炎患犬的治疗提供新思路。
1 材料与方法
1.1 样品采集 本试验从2016年1月—2018年12月共收集整理了北京观赏动物医院就诊的胰腺炎患犬8例(标记为PA),北京3个犬场收集的同龄健康犬粪样8份(标记为HE),共计16份。对患犬和健康犬的病史资料、性别及饲养情况、发病时间、临床症状和实验室检测结果等进行了详细问诊和记录。
1.2 16S rRNA扩增子测序 无菌采集粪便样品200 mg,加入样品保存液,按粪便DNA快速提取试剂盒(QIAamp Fast DNA Stool Mini Kit)操作说明书提取粪便内微生物总DNA,经1%琼脂糖凝胶电泳确定DNA样品完整性后,用Nanodrop检测调整DNA浓度。以细菌16S rRNA 基因V3~V4区域为目的片段,以341F~806R引物[7]进行PCR扩增,样品送交奥美德诺(北京)基因科技有限公司经Miseq2500 PE250平台测序,获得原始数据(Raw tags)。
1.3 测序结果过滤 原始数据以Trimmomatic软件[8]进行低质量序列扫描,当质量低于 20 时只保留前面高质量部分,去掉3′端或5′端一些模糊碱基或低质量碱基(可提高拼接率);然后去除单碱基重复6个以上的序列,并去除长度小于50 bp的序列;以 FlASH软件[9]将上一步合格的双端数据拼接,序列拼接时最大重叠(Overlap)为200 bp,得到完整组装序列;用QIIME程序[10]中的Split_libraries软件去除序列中含有N碱基的序列,去除单碱基重复大于6 的序列,去除长度小于200 bp的序列,得到过滤后序列(Clean tags);再用UCHIME软件[11]去除其中的嵌合体,最终得到用于后面操作分类单元(Operational taxonomic units,OUT)划分的可用序列(Valid tags)。
1.4 菌群结构及多样性分析 用QIIME程序对质控过滤后得到的有效序列(Valid tags)以97%相似度进行单元OTU(OTUs是按照一致性和相似性聚类的Tags集合体)分类,选取每个 OTU中丰度最大的序列作为该OTU的代表序列,以RDP Classifier Naive Bayesian分类算法对代表序列与Greengenes数据库[12]进行比对,注释得到每个OTU的物种信息。根据每个OTU在各个样本中包含的序列数,构建OTU在各个样本中丰度矩阵文件;根据序列比对结果,用 PyNAST软件[13]对 OTU 代表序列进行系统进化关系的构建,获得系统发育树文件;并按照最小深度法对所有样本随机抽取,建立OTU表格。将OUT矩阵文件均一化后,用QIIME软件中的alpha_diversity.py输出可观察种类(Observed_species)、香农(Shannon)、辛普森(Simpson)指数等多样性指数数值,获得测序样品的丰富度和多样性,使用R软件绘制稀释曲线(Rarefaction curve),判断测序数据的合理程度,同时使用R软件绘制关系图。
1.5 菌群功能预测 与Greengenes数据库比对,获得的OUT丰度矩阵文件标准化后,用PICRUSt软件[14]先根据已测微生物基因组的16S rRNA基因全长序列,推断其共同祖先的基因功能谱;对Greengenes数据库中其他未测物种的基因功能谱进行推断,构建细菌域全谱系的基因功能预测谱;最后,将测序得到的菌群组成“映射”到KEGG数据库中,对菌群代谢功能进行预测。
1.6 数据统计分析 试验数据经Excel 2016初步处理后,采用SPSS中ANOVA对分析结果进行统计分析,P<0.05为差异显著,R软件用于绘制韦恩图、热图等。
2 结果
2.1 测序数据分析 通过Illumina Miseq测序后健康犬(HE)和胰腺炎患犬(PA)样品测序值在87 131~24 850,所有样品的有效数据(Effective tags)长度均在38~505。在97%相似水平下聚类成OTU并进行物种注释分析,结果表明,健康犬样品OTU总体为56 227,患犬样品OTU总体为41 293。利用R软件绘制Shannon指数稀释曲线(图1),结果表明,当测序深度达2 000 时,Shannon曲线已经达到饱和状态,表明当前的测序量足够进行菌群多样性分析。
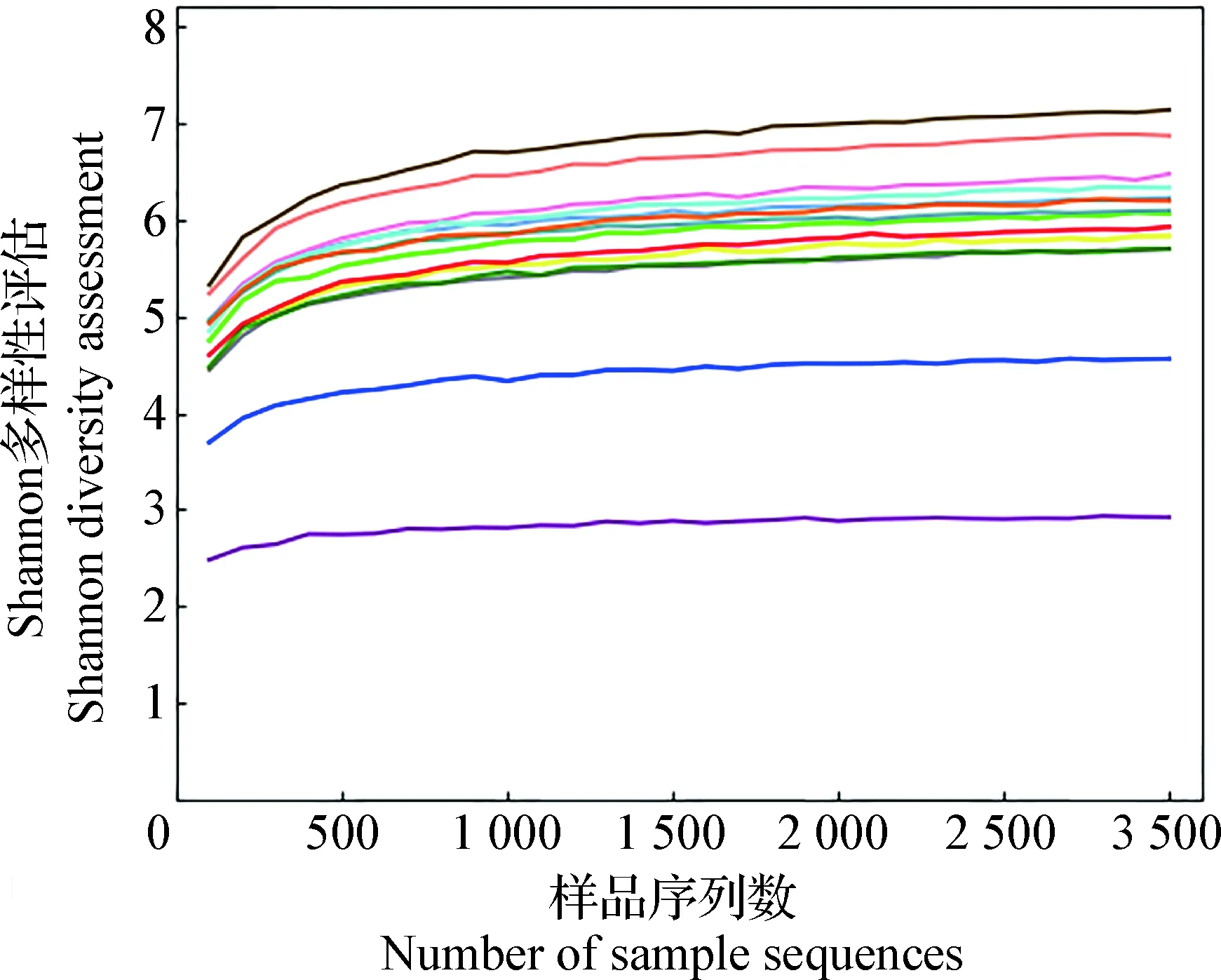
图1 测序样品与稀释曲线Fig.1 Sequencing sample and dilution curve不同颜色为不同测序样品的稀释曲线Different color was the dilution curve of different sequencing samples
2.2 肠道菌群结构及多样性分析 测序样品注释随注释等级的减小而递减,大部分序列能注释到属水平,但能注释到种水平的序列远远小于属水平。根据OTU聚类和注释分析结果(图2A),分析不同测序样品的信息,结果表明测序样品共有142物种(图2B),主要集中于厚壁菌门、变形菌门和拟杆菌门等,特别是乳杆菌科(Lactobacillaceae)、梭杆菌科(Fusobacteriaceae)等;针对特异性物种,健康犬样品43个,胰腺炎患犬样品107个;健康犬样品特异性物种主要为伯克氏菌科(Burkholderiaceae)、脱铁杆菌科(Deferribacteraceae)和琥珀酸弧菌科(Succinivibrionaceae)等;胰腺炎患犬样品特异性物种主要为红蝽杆菌科(Coriobacteriaceae)、Ruminococcaceae和Leptotrichiaceae等。

图2 健康犬与胰腺炎患犬肠道菌群组成Fig.2 Composition of intestinal flora in healthy dogs and pancreatitis dogsA:健康犬肠道菌群组成; B:健康犬与胰腺炎患犬肠道菌群种类及分布A:Composition of intestinal flora in healthy dogs; B:Species and distribution of intestinal flora in healthy dogs and pancreatitis dogs
对测序样品的α-多样性分析结果发现,多样性指数Chao1、Observed species、Shannon指数、Simpson指数(Mean±SD)健康犬分别为93.85±58.77、27.75±6.50、3.73±0.40和0.86±0.04,胰腺炎患犬样品分别为83.83±52.93、29.13±9.73、3.77±1.15和0.82±0.20。以上结果表明,胰腺炎患犬肠道菌群的组成及多样性与健康犬仍然差异较大(P=0.000 3)。
健康犬与胰腺炎患犬肠道菌群丰度比较结果发现,乳酸杆菌属、双歧杆菌属和链球菌属等有益菌群丰度,健康犬分别为0.007 3、0.001和0.006,而胰腺炎患犬分别为0.002 7、0.002和0.002。健康犬双歧杆菌属和链球菌属菌群丰度略高于胰腺炎患犬,表明胰腺炎患犬有益菌群丰度低。
2.3 菌群功能预测 健康犬和胰腺炎患犬样品菌群在糖类和氨基酸等代谢功能分布的分析结果见图4。两组犬肠道菌群代谢相关功能的分析数据显示,健康犬与胰腺炎患犬遗传信息过程相关功能比值为17.5%/17.2%,其中复制和修复功能为7.7%/7.4%、翻译功能为4.7%/4.5%;细胞过程相关功能比值为3.0%/2.5%,其中细胞运动功能为2.3%/1.8%。因此,健康犬的遗传信息过程和细胞过程相关功能分布值比胰腺炎患犬略高。而环境信息过程相关功能比值为15.6%/16.5%,其中膜转运功能为13.3%/14.2%,健康犬环境信息过程相关功能分布值比胰腺炎患犬略低。综上,健康犬与胰腺炎患犬在肠道菌群代谢相关功能分布值上略有差异,但总体差异不显著(P=0.352)。
3 讨论
本试验结果表明,犬肠道正常菌群主要以厚壁菌门和拟杆菌门为主,该结果与已报道的研究结果一致[15]。在肠道细菌的所有功能研究中,促进宿主健康和预防疾病方面的研究较多,如通过产生抗微生物物质(如有机酸、细菌素)以及竞争营养和生存空间预防病原微生物[16];探讨发病机制以及肠道菌群如何保护宿主并设计治疗方法、保护宿主[17]。目前,尚无胰腺炎患犬与肠道菌群相关性的研究。在消化系统疾病中,通过比较腹泻幼犬和健康幼犬粪便样品菌群差异发现,腹泻犬样品肠球菌和乳酸杆菌的数量降低极为显著,双歧异杆菌和类杆菌的数量显著减少,而肠杆菌的数量变化不显著[18]。本试验对健康犬和胰腺炎患犬的肠道菌群组成及多样性比较发现,两者主要菌群结构未变,部分菌群特异性出现/消失;同时发现胰腺炎患犬与健康犬相比,肠道菌群种类和多样性降低,乳杆菌属、链球菌属等有益菌群丰度显著下降。
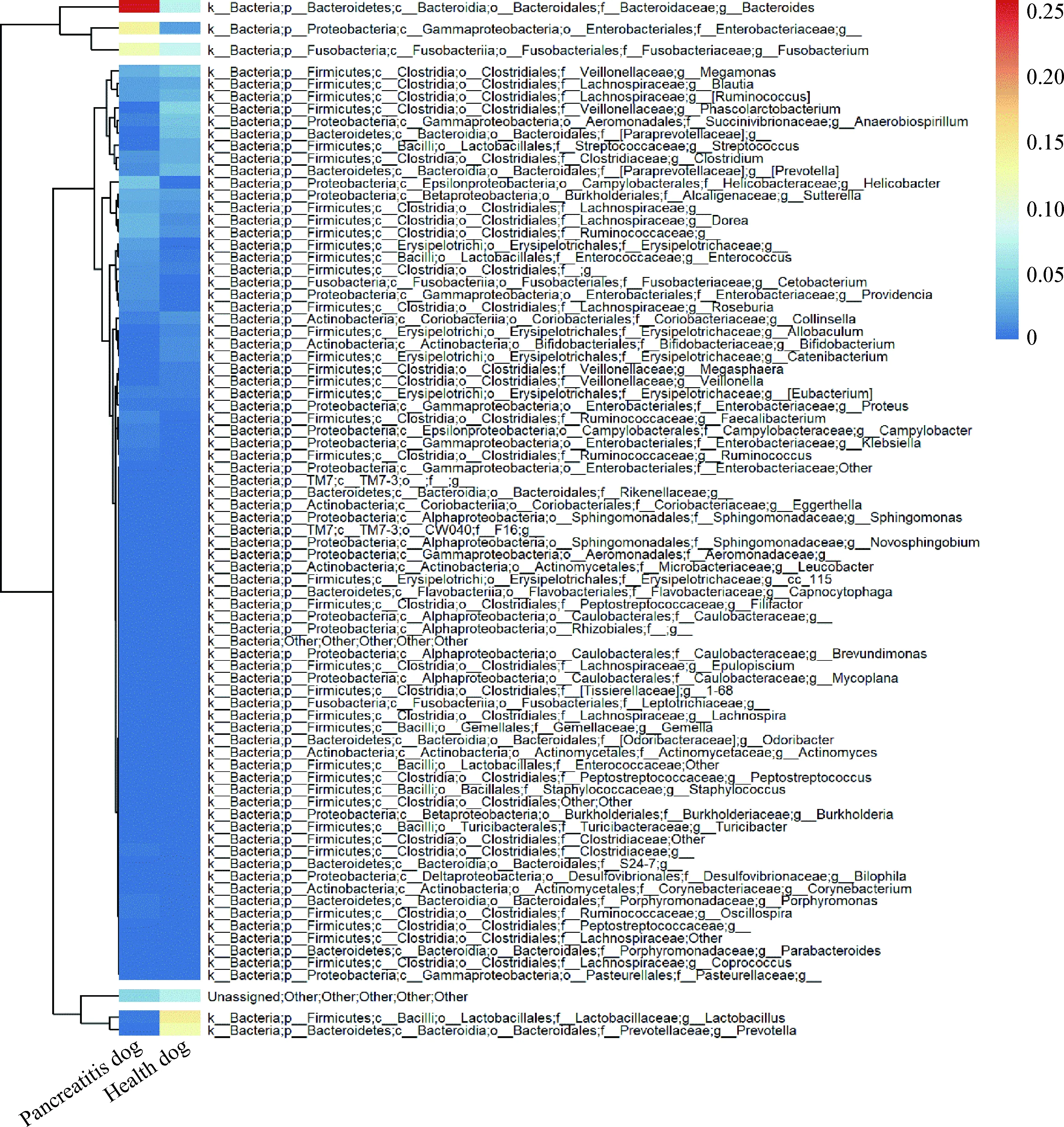
图3 健康犬与胰腺炎患犬的肠道菌群丰度Fig.3 Abundance of intestinal flora in healthy dogs and pancreatitis dogs

图4 健康犬与胰腺炎患犬的肠道菌群功能分布Fig.4 Functional distribution of intestinal flora in healthy dogs and pancreatitis dogs
目前,益生菌已用于犬胃肠疾病治疗。鉴于胰腺炎患犬的肠道菌群丰度相对较低、有益菌群数量减少,是否可以考虑对胰腺炎患犬进行益生菌治疗呢?已经确认,益生菌无毒副作用、无耐药性以及无残留等特点,可改善肠道微生物平衡从而对宿主健康产生有益的影响[19]。有研究表明,益生菌对宿主健康有不同的有益作用,如免疫调节、抗炎或竞争潜在病原体的营养素或黏附位点[20]。益生菌制剂通常含乳酸杆菌和双歧杆菌、链球菌属、芽孢杆菌属等单一菌株或组合菌株。其中乳酸菌通过粘附定植在动物肠道内可以减少肠道内大肠杆菌的数量,改善肠道菌群结构;同时还可产生天然抗菌物质,刺激肠道局部免疫反应,并抑制致病菌的生长繁殖或将其杀灭,从而达到防治疾病效果[21]。因此,建议临床上可以尝试应用乳酸杆菌、链球菌属等益生菌治疗胰腺炎患犬。
综上所述,本试验基于16S rRNA 扩增子测序技术,分别对健康犬和胰腺炎患犬粪便样品进行检测并分析,结果表明,胰腺炎患犬肠道菌群组成及α-多样性降低;肠道菌群功能总体上不受影响,但部分菌群功能(如遗传信息过程等方面)会受到较大影响。本试验为胰腺炎患犬肠道菌群组成提供基础数据,同时,为胰腺炎患犬的治疗提供新思路。
