不同熔解曲线分析技术在犬细小病毒基因分型中的比较
2022-01-17嘎利兵嘎锡林塔娜刘志成
嘎利兵嘎,锡林塔娜,刘志成
(1. 内蒙古农业大学职业技术学院,内蒙古 包头 014109 ; 2. 锡林郭勒盟生态环境监测站, 内蒙古 锡林浩特 026000 ; 3. 广东省农业科学院动物卫生研究所,广东 广州 510640)
随着聚合酶链式反应 (Polymerase chain reaction,PCR) 技术的不断更新发展,基于PCR方法的单核苷酸多态性 (Single nucleotide polymorphisms,SNP) 位点基因分型技术在畜牧兽医临床中的应用也日趋普遍。目前,基于PCR方法的SNP基因分型方法主要包括单链构象多态性聚合酶链式反应(Single strand conformation polymorphism-PCR,SSCP-PCR)[1]技术、限制性片段长度多态性聚合酶链式反应(Restriction fragment length polymorphism-PCR,RFLP-PCR)[2]技术、扩增片段长度多态性聚合酶链式反应(Amplified restriction fragment polymorphism-PCR,AFLP-PCR)[3]技术、等位基因特异性扩增(Amplification refractory mutation system-PCR,ARMS-PCR)[4]技术、水解探针聚合酶链式反应(TaqMan probe-PCR)[5]技术、双脱氧链终止法测序(Sanger sequence)[6]技术、基因芯片(Gene chip)[7]技术、高分辨率熔解曲线聚合酶链式反应(High resolution melting analysis-PCR,HRM-PCR)[8]技术和探针熔解曲线聚合酶链式反应(Fluorescence melting curve analysis-PCR,FMCA-PCR)[9]技术等。
在以上方法中,HRM-PCR和FMCA-PCR技术均通过PCR扩增产物的熔解温度差异来区分不同SNP位点。HRM-PCR方法通过实时监测升温过程中双链DNA荧光染料与PCR扩增产物的结合情况,来判断是否存在SNP,而且不同SNP位点、是否是杂合子等都会影响熔解曲线的峰形,因此HRM-PCR分析能够有效区分不同SNP位点。FMCA-PCR技术借助普通TaqMan探针近似分子信标的空间二级结构特点,通过其探针的熔解温度差异来分析不同SNP位点的一种新型基因分型技术(图1)。FMCA-PCR技术颠覆了传统TaqMan探针无法做熔解曲线分析的观点,并可在单个PCR管内同时进行多个SNP位点的检测。本试验利用犬细小病毒2型(Canine parvovirus-2,CPV-2)不同基因型样本(CPV-2a、CPV-2b、CPV-2c)来比较2种熔解曲线基因分型方法的优缺点,为熔解曲线基因分型技术在兽医临床中的应用提供实际参考依据。

图1 探针熔解曲线分析原理[10]Fig.1 Principle of probe melting curve analysis[10]
1 材料与方法
1.1 样品 样品为本实验室从江苏省常州市和广东省广州市宠物医院收集的30份犬粪便棉拭子阳性样本(胶体金试纸条阳性)核酸。
1.2 引物与探针设计 根据NCBI上已公布的CPV-2VP2基因序列分别设计出能够区分CPV-2a、CPV-2b和CPV-2c不同基因型的HRM-PCR扩增引物CPV-426F/426R、FMCA-PCR扩增引物cpv-F2/ab-Rev、探针P2以及测序引物CPV-1270F/1270R(表1)。HRM-PCR引物和FMCA-PCR引物扩增片段均包含2个SNP 位点,第1个SNP位点为A4062G,分别对应CPV-2a(AAT)和CPV-2b (GAT);第2个SNP位点为T4064A,分别对应CPV-2b(GAT)和CPV-2c (GAA)(图2)。
1.3 PCR反应与熔解曲线分析 HRM-PCR反应体系参照PremixTaqTMKit[生工生物工程(上海)股份有限公司]产品说明书配制反应液,总反应体系为20 μL:PremixEx-Taq预混液10 μL、CPV-426F 引物1 μL、CPV-426R引物1 μL、Eva Green 核酸染料1 μL、CPV-2病毒核酸模板DNA 1 μL、去离子水6 μL。 将配制好的反应液置于Rotor-GeneTMQ (凯杰,德国)仪器上,HRM-PCR 反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃ 退火30 s,72 ℃延伸30 s, 循环35次;PCR反应结束后68~80 ℃ 以0.3 ℃/s 的熔解速率进行熔解曲线分析。HRM-PCR试验结果用Rotor-GeneTMQ 2.0.2软件进行分析。由于SNP 位点A和T之间熔解温度差异△Tm较小(小于0.2 ℃),为了更好地区分CPV-2b 和CPV-2c 基因型(T4064A),HRM-PCR分析完成后,将对照样本CPV-gd1(CPV-2b)与未知临床样品等体积混合形成杂合子后再次运行HRM-PCR。

表1 引物与探针序列Table 1 Primer and probe sequences
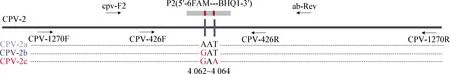
图2 引物及探针设计Fig.2 Primer and probe design
FMCA-PCR反应体系:参照Premix TaqTMKit(南京诺唯赞生物科技股份有限公司)产品说明书配制反应液,总反应体系为20 μL:TaqPlus Master Mix 10 μL、cpv-F2引物1 μL(0.03 μmol/L)、ab-Rev引物1 μL (0.3 μmol/L)、P2 探针1 μL、CPV-2病毒核酸模板DNA 1 μL、去离子水6 μL。将配制好的反应液置于LightCycler®96 (罗氏,瑞士) 仪器上,FMCA-PCR反应程序:95 ℃ 预变性5 min;95 ℃ 变性15 s,55 ℃退火15 s,72 ℃ 延伸15 s,循环55次;PCR反应结束后37~97 ℃ 以0.1 ℃/s的熔解速率进行熔解曲线分析。
1.4 灵敏度对比分析 利用引物CPV-1270R/1270F构建阳性样品质粒CPVpf,用NanoDrop 2000 (美国赛默飞世尔科技公司)测定起始浓度,并把质粒样品梯度稀释后进行HRM-PCR和FMCA-PCR灵敏度试验,比较2种熔解曲线基因分型方法的最低检测限。
1.5 准确性对比分析 为了比较2种熔解曲线基因分型方法的准确性,本试验对来自不同地区30份犬粪便棉拭子临床阳性样本依次进行HRM-PCR和FMCA-PCR分析,并利用测序引物CPV-1270R/1270F对所有30份阳性样本进行测序,比较其2种熔解曲线基因分型方法的准确性。
2 结果
2.1 标准质粒样本不同SNP熔解温度差异比较 CPV-2病毒3种基因型(CPV-2a、CPV-2b、CPV-2c)HRM-PCR和FMCA-PCR熔解曲线基因分型结果如图3、图4。HRM-PCR方法中CPV-2a标准样品Tm为(71.40±0.03) ℃,而CPV-2b和CPV-2c标准样品Tm相对较高,分别为(71.90±0.04) ℃和(71.80±0.03) ℃。由于CPV-2b和CPV-2c基因型之间熔解温度差异(△Tm)只有0.15 ℃,因此为了更好地区分以上2个基因型,通过形成杂合子的方法进一步区分CPV-2b和CPV-2c(图3B)。FMCA-PCR方法中CPV-2各基因型熔解温度差异明显,CPV-2a、CPV-2b和CPV-2c标准样品Tm分别为(58.50±0.20) ℃、(51.80±0.10)℃和(48.80±0.12)℃(图4)。
以上熔解温度比较结果表明,在HRM-PCR方法中CPV-2a型和CPV-2b型、CPV-2b型和CPV-2c型之间△Tm只有(0.60±0.03)℃和(0.20±0.01) ℃;而在FMCA-PCR方法中CPV-2a型和CPV-2b型、CPV-2b型和CPV-2c型之间△Tm分别为(6.85±0.22)℃和(3.01±0.2) ℃。FMCA-PCR方法不同SNP位点熔解温度差异远大于HRM-PCR方法(图5)。

图3 HRM-PCR方法CPV-2标准质粒样品熔解曲线基因分型结果Fig.3 Melting curve genotyping results of CPV-2 standard plasmid samples by HRM-PCRA:杂合前HRM-PCR熔解曲线; B:杂合后HRM-PCR熔解曲线A:HRM-PCR melting curve before ungenerating heteroduplexes; B:HRM-PCR melting curve after generating heteroduplexes

图4 FMCA-PCR方法CPV-2标准质粒样品熔解曲线基因分型结果Fig.4 Melting curve genotyping results of CPV-2 standard plasmid samples by FMCA-PCR
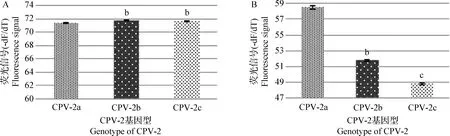
图5 HRM-PCR和FMCA-PCR方法CPV-2不同基因型之间熔解温度差异对比结果Fig.5 Comparison of melting temperature differences between HRM-PCR and FMCA-PCR for genotyping CPV-2A:HRM-PCR; B:FMCA-PCR 不同小写字母表示不同基因型之间熔解温度差异显著,P<0.05Different lowercase letters mean significant difference between different genotypes,P<0.05
2.2 灵敏度和准确性比较 HRM-PCR和FMCA-PCR熔解曲线基因分型方法最低检测限分别11.9 copies/μL和1.0 copy/μL(CPV-2标准质粒样品)。为了对比2种熔解曲线基因分型方法的准确性,本试验对来自不同地区的30份犬粪便棉拭子核酸阳性样本依次进行HRM-PCR和FMCA-PCR熔解曲线基因分型(图6、7),并对基因分型结果进行测序验证。
30份临床样本经过HRM-PCR分析(未形成杂合子)后可归类为19份CPV-2a型、7份CPV-2b型、3份CPV-2b型和1份CPV-2a、CPV-2b混合感染型。CPV-2a、CPV-2b和CPV-2c 各基因型熔解温度(Tm)分别为(71.42±0.07)℃、(72.01±0.07) ℃ 和 (71.77±0.03) ℃。样品CPV-js11(混合感染)的 2个熔解峰Tm分别为(68.78±0.04)℃ 和(71.84±0.00)℃(图6A)。在HRM-PCR方法中CPV-2a基因型与CPV-2b和CPV-2c基因型之间△Tm较大(大于0.6 ℃),因此CPV-2a基因型易与其他2个基因型相互鉴别。而CPV-2b 和CPV-2c基因型之间△Tm较小(只有0.15 ℃),两者如果直接按照Tm值区分基因型的话,会影响分型准确性。为了进一步区分CPV-2b和CPV-2c基因型,在第1次HRM-PCR反应运行结束后7份CPV-2b PCR产物和3份CPV-2c PCR产物中依次加入已知基因型对照样品(CPV-2b)形成杂合子熔解曲线。杂合子熔解曲线结果显示,当PCR产物中加入对照样品CPV-2b时,3份CPV-2c样品中2份样品熔解曲线形状发生改变(形成2个熔解峰),而剩余1份样品和7份CPV-2b样品熔解曲线形状未发生改变(仍然1个熔解峰),如图6B。HRM-PCR基因分型结果(形成杂合子后)与测序结果完全一致(表2)。
30份临床样本经过FMCA-PCR分析可归类为19份CPV-2a型、8份CPV-2b型、2份CPV-2b型和1份CPV-2a、CPV-2b混合感染型。CPV-2a、CPV-2b和CPV-2c 各基因型熔解温度(Tm)分别为(58.34±0.36)℃、(51.70±0.40) ℃ 和(48.81±0.30)℃。样品CPV-js11(混合感染)的 2个熔解峰Tm分别为(51.80±0.30)℃ 和(58.50±0.40)℃。FMCA-PCR基因分型结果与测序结果完全一致(表2)。

图6 HRM-PCR临床样本检测结果Fig.6 Results of HRM-PCR from clinical specimens A:杂合前HRM-PCR熔解曲线; B:杂合后HRM-PCR熔解曲线 A:HRM-PCR melting curve before ungenerating heteroduplexes; B:HRM-PCR melting curve after generating heteroduplexes
3 讨论
本试验比较了2种熔解曲线基因分型技术对不同SNP位点的分型鉴别能力。在本试验中,2种基因分型方法均通过PCR扩增产物的熔解温度差异来区分不同SNP。在FMCA-PCR方法中不同SNP位点之间熔解温度变化远大于HRM-PCR方法。引起这一变化的主要原因为2种方法所产生的DNA双链(熔解片段)差异所致。这种差异一方面体现在2种方法中所产生的DNA双链长度各不相同。DNA双链越短,SNP位点之间熔解温度变化越大[11-12]。在HRM-PCR方法中DNA双链长度即为PCR扩增产物长度52 bp,而在FMCA-PCR方法中由于使用探针序列,DNA双链长度等于探针序列长度即只有27 bp。熔解温度差异另一方面体现在SNP位点氢键数量变化上。在FMCA-PCR方法中由于使用探针序列,当探针和CPV-2a型完全匹配时产生较高的熔解温度;当探针和CPV-2b型有1个碱基错配(氢键数量由3个变为0个)时导致CPV-2a与CPV-2b型△Tm相差约6 ℃;当CPV-2b与CPV-2c型之间存在1个碱基错配(2个氢键变化)时两者 △Tm相差约3 ℃;而CPV-2a与CPV-2c型之间同时存在2个碱基错配(5个氢键变化)时导致更大的△Tm变化约9 ℃。在HRM-PCR方法中,CPV-2 VP2基因序列第4 062位点由A变成G时只有1个氢键变化,导致了CPV-2a与CPV-2b型PCR扩增产物△Tm相差0.6 ℃。而CPV-2b与CPV-2c型核酸序列第4 064位点由T变成A(未涉及氢键数量变化),两者PCR扩增产物△Tm只差约0.15 ℃。虽然HRM-PCR方法中,氢键数量变化较少,导致各个SNP位点熔解温度差异不明显(表2),但该方法通过杂合子熔解曲线峰型变化来提高分型准确率,而FMCA-PCR方法无这一特点。

图7 FMCA-PCR临床样本检测结果Fig.7 Results of FMCA-PCR from clinical specimens
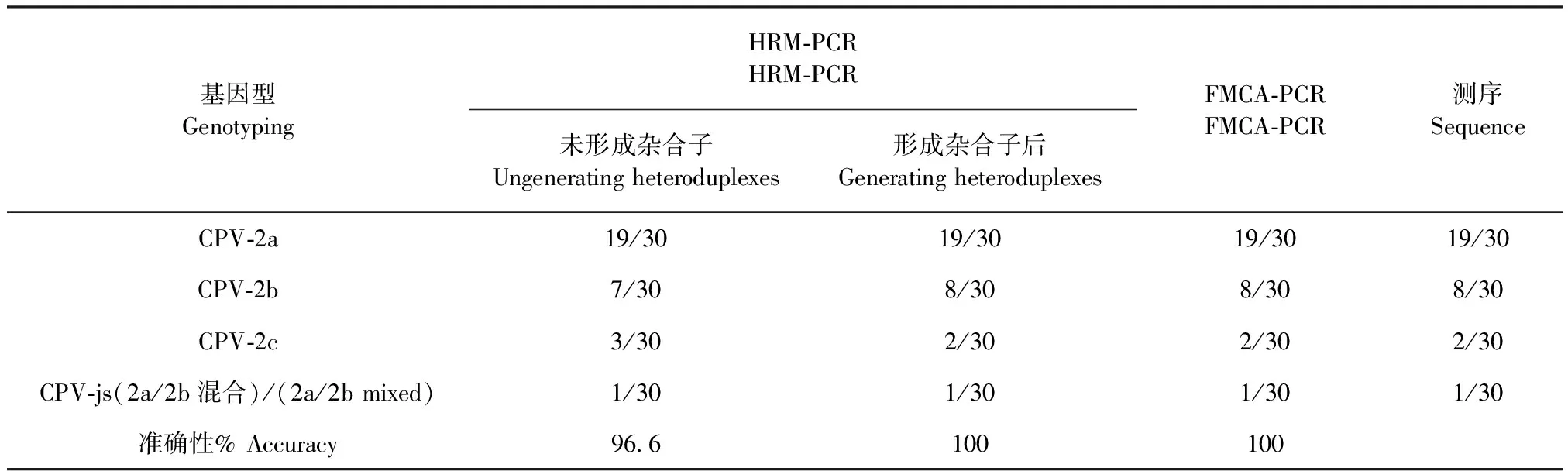
表2 2种熔解曲线基因分型方法准确性比较Table 2 Comparison of accuracy between HRM-PCR and FMCA-PCR
HRM-PCR和FMCA-PCR方法均能区分混合感染样品。然而在HRM-PCR方法中,需要混合标准样品作为对照才可以区分混合感染样品中的每个基因型;但在FMCA-PCR方法中,无需混合标准样品只需纯对照样品即可。这是由于2种方法所使用荧光物不同导致。HRM-PCR方法使用双链DNA嵌合荧光染料,而FMCA-PCR方法使用序列特异性探针作为荧光物。前者凡是遇到双链DNA即可发光,而后者只和特异性序列匹配后才可发荧光。在混合感染样品PCR扩增产物中同时存在2 种DNA双链,即2个同源DNA双链和2个异源DNA双链。在HRM-PCR混合感染样品中,2个同源DNA双链构成温度较高的熔解峰(碱基完全匹配),而2个异源双链构成温度较低的熔解峰(有碱基错配)(图6A)。在FMCA-PCR混合感染样品中,探针和目标序列完全匹配形成了较高温度的熔解峰,探针和目标序列有错配形成了较低温度的熔解峰,而溶液中其他DNA双链则不出现熔解峰(图7)。因此,在检测混合感染样品时FMCA-PCR方法只需纯对照样本即可。
HRM-PCR基因分型方法由于使用DNA嵌合荧光染料,无需探针因此检测成本相对较低。而该方法的缺点为HRM-PCR试验必须在携带HRM分析模块功能的PCR仪上进行。另外,该方法的检测通量相对较低,HRM-PCR方法很难在单个PCR管内同时分析多个SNP位点(3个以上)。FMCA-PCR基因分型方法由于使用探针,该方法的检测通量和灵敏度相对较高,即单个PCR反应管内可同时检测5种不同颜色探针信号(每个探针检测3个SNP),检测限可达到1 copy/μL。另外,该基因分型方法不受荧光PCR仪器种类限制,任何一种普通荧光定量PCR仪上即可实现FMCA-PCR试验。而该方法的缺点为由于使用探针其检测成本较HRM-PCR方法相对要高。
综上所述,2种基于PCR方法的熔解曲线基因分型技术(HRM-PCR和FMCA-PCR)对CPV-2不同SNP位点均有较高的分型鉴别能力,其中HRM-PCR方法试剂检测成本低廉、设计简单,检测通量较低等特点;而FMCA-PCR方法试剂检测成本较高、设计较复杂,检测通量高等特点。本试验为熔解曲线基因分型技术在兽医临床中的应用提供参考依据。
