前入路肝中叶+全尾叶切除治疗肝尾状叶腔静脉旁部肝细胞癌
2022-01-17田秉璋周宁周璐璐李威蒋海博
田秉璋,周宁,周璐璐,李威,蒋海博
(湖南省人民医院肝胆外科,湖南长沙410005)
肝尾状叶腔静脉旁部因其特殊的解剖位置及结构,使涉及此部位的原发性肝癌(HCC)常与第一肝门、下腔静脉、肝静脉关系密切,使手术难度高、风险大[1-2],是肝脏外科手术中的难点,我科自2017年2月—2020年2月施行前入路肝中叶+全尾叶切除术3 例,获得成功,现报告如下。
1 资料与方法
1.1 一般资料
3 例患者均为男性;年龄54~60 岁,平均57 岁;癌灶位置均位于肝尾状叶腔静脉旁部(图1),均为原发性肝癌(HCC),均有慢性乙肝病史,病灶均为单发,癌灶体积4 cm×5 cm×5 cm~8 cm×8 cm×7 cm。术前肝功能均为Child A 级5 分,ICG-15均<10%(表1)。
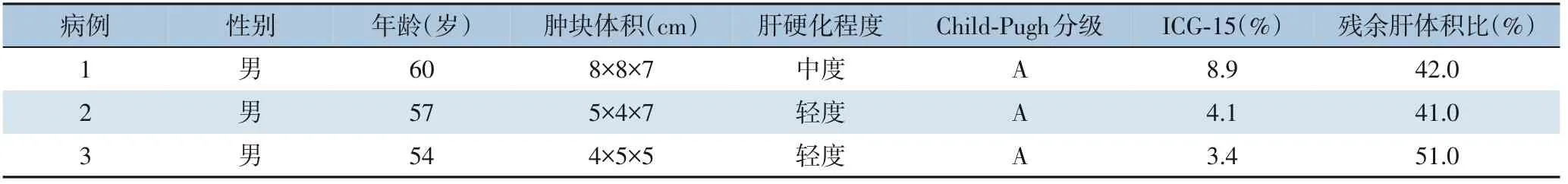
表1 3例肝尾叶腔静脉旁部HCC一般资料
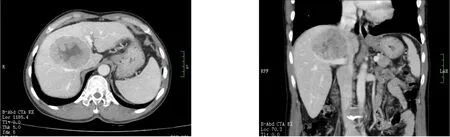
图1 术前CT示癌灶位置均位于肝尾状叶腔静脉旁部
1.2 手术方法
患者均采用右上腹反“L”型切口,进腹探查,常规行术中超声检查,切除胆囊,离断肝圆韧带、肝镰状韧带,显露肝右静脉、肝中静脉、肝左静脉根部,留置Pringle 阻断带,采用Pringle 间隙阻断和右半肝间隙阻断下切肝,15 min+5 min 间隙阻断。先离断左侧面,在肝镰状韧带右侧0.5 cm处断肝,离断左内叶Glisson 蒂,显露第一肝门及左侧Glisson 蒂,离断进入左尾叶的门脉三联,血管吊带悬吊左侧Glisson 蒂,头侧显露肝中静脉根部并用血管吊带悬吊,沿着肝胃韧带离断左外叶与左内叶之间的连结,并离断Arantius 管,将尾状叶和下腔静脉拖向右侧(图2A)。离断进入右尾叶的门脉三联,血管吊带悬吊右侧Glisson 蒂,分离并结扎右肝前叶Glisson 蒂,右肝出现缺血分界线(图2B),在间隙阻断右半肝血流下离断右肝断面,显露肝右静脉(图2C),离断右尾叶与右后叶之间的连结,离断右前叶Glisson 蒂,一直沿肝右静脉至其根部断肝,离断肝中静脉,最后离断数支肝短静脉,将尾叶从下腔静脉上剥离出来(图2D)。移去标本,创面止血后放置腹腔引流管。
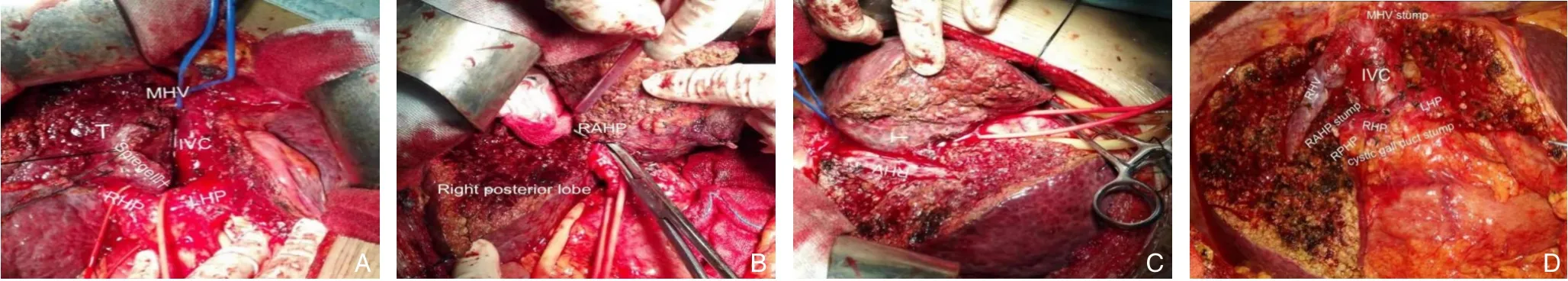
图2 术中照片A:将尾状叶和下腔静脉拖向右侧;B:离断门脉三联,血管吊带悬吊Glisson 蒂,分离并结扎Glisson 蒂,右肝出现缺血分界线;C:离断右肝断面,显露肝右静脉;D:离断数支肝短静脉,将尾叶从下腔静脉上剥离出来
2 结果
所有患者均采用Pringle 阻断+右半肝血流阻断,采用15 min+5 min 模式,手术时间310~360 min,平均330 mL,出血量400~700 mL,平均506 mL,均未输血,术中中心静脉压1~3 cmH2O(1 cmH2O=0.098 kPa),术中断肝完毕后均输白蛋白20 g,术后3 例均未出现肝功能衰竭、出血等严重并发症,3 例均出现胸腔积液,1 例中量积液穿刺置管引流,另2 例少量积液自行吸收,1 例出现术后胆汁漏,无腹痛、畏寒、发热,腹腔引流管每天流出胆汁100~200 mL,术后第15 天拔除腹腔引流管,术后病检均为原发性肝癌。病例1、2 术后口服索拉非尼(2 次/d,每次400 mg;2 例服用过程中未出现明显副作用),病例3 口服仑伐替尼(1 次/d,每次12 mg,服药过程中出现轻度腹泻)(表2)。3 例均健在,病例1 术后1年出现S2 段转移病灶1.5 cm,予以TACE(病灶<3 cm 可考虑微波消融)后未见复发。
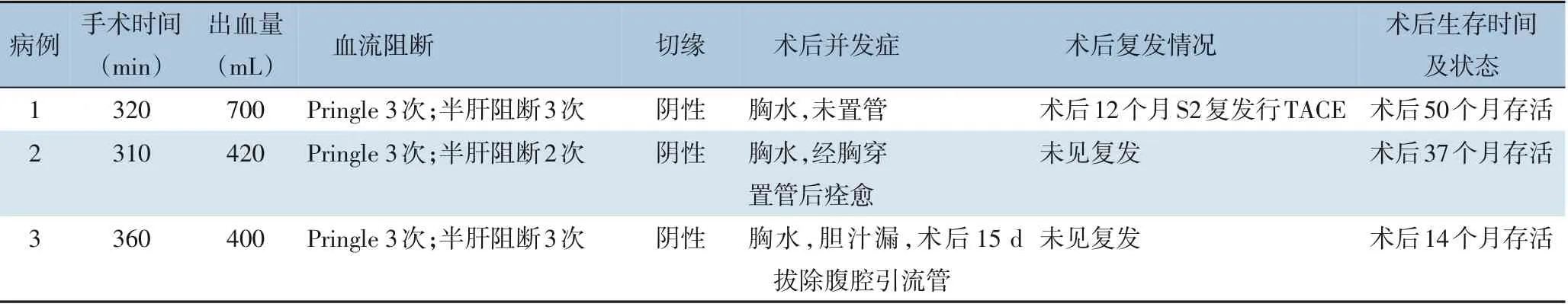
表2 3例患者术中、术后临床资料
3 讨论
HCC 是我国第2 位常见恶性肿瘤。目前手术解剖性切除仍是治疗的首选方式[3],发生于尾叶的肝脏恶性肿瘤也是时有所见,但对于肝尾状叶腔静脉旁部的肝癌因为位置特殊,处于第一、第二肝门及下腔静脉之间,尽管手术难度极大,手术切除仍是治疗尾状叶HCC 首要的、最有效的治疗手段[4-5]。
肝尾状叶位置较深,被第一、第二、第三肝门所包绕,尾状叶分成3 部分:Spiegel 叶、腔静脉旁部、尾状突部[6-7],而腔静脉旁部是尾状叶中间部分,位于腔静脉韧带内侧,肝后下腔静脉前方的半包围结构,右下以门静脉右后干为界与尾状突部相连,右上与肝脏右后段融合,前上方有肝右静脉、肝中静脉及其属支通过,前方紧邻第一肝门,腔静脉旁部动脉主要来自肝右动脉的分支,少部分来源于肝左动脉[8]腔静脉旁部的门静脉主要源自门静脉主干和门静脉分叉部[9],腔静脉旁部的静脉回流不同于其他肝段,通过多支肝短静脉直接汇入下腔静脉。因此腔静脉旁部的肝癌除具有其他部位HCC 所共有的特征外,它还有特殊性,它邻近肝门,由门静脉主干及分叉部的分支供应血液,其静脉回流直接汇入下腔静脉,特殊位置决定了它没有足够的手术切缘,所以较其他部位的肝癌更早发生肝内外转移,因此其预后也较其他部位者差。
对于尾叶的恶性肿瘤,全尾叶切除已形成一项共识[10]。腔静脉旁部HCC 常见入路如下:⑴背侧入路,对于直径<3 cm 腔静脉旁部的癌可以采用此入路,充分游离肝脏,在肝左、中、肝右静脉的背侧切除全尾叶[11-12]。对于较大的腔静脉旁部的癌经常将第一肝门向下、肝中静脉向上挤压变形,从背侧入路根本没有操作空间,除非行扩大右半肝加全尾叶或右三肝+全尾叶切除,而一般患者均有较严重的肝硬化,一般耐受不了右肝三叶切除等大范围肝切除[13],故此入路较少采用。⑵前正中裂劈开途径[14-16],该术式可适用于肿瘤体积较小患者,对患者创伤较小。而对于肿瘤较大,肝硬化程度严重不能耐受大范围切肝的患者,需先充分游离肝脏,沿肝正中裂的右侧或左侧避开肝中静脉直达第一肝门,暴露左右肝蒂,分离结扎并切断通向尾叶的门脉三联,将肿瘤从肝中静脉、肝右静脉上剥离下来而去除标本,此术式也有它的缺点,第一是需将肝脏彻底游离,需将肝周韧带完全游离,下腔静脉完全暴露,破坏了肝脏淋巴回流及侧支血液循环,术后可能出现严重的胸水、腹水及肝脏功能的受损。第二从肿瘤的根治性来说也有缺陷。腔静脉旁部较大肿瘤经常将肝中静脉挤压变形,有时肿瘤与肝中静脉壁融合或者肿瘤静脉支汇入肝中静脉,肝正中裂劈开途径,两侧剥离的创面很大,即使保存了肝中静脉,从肿瘤的根治性来看不是很理想,从根治性来说,腔静脉旁部的癌最好切除肝中静脉,但对于肝硬化严重,ICG-15>10%不能耐受大块切肝,此术式亦是一个理想的术式选择[17]。⑶前入路肝中叶+全尾叶切除术,对于腔静脉旁部HCC,如果体积超过4 cm,第一肝门受肿瘤挤压没有操作空间,同时向前推挤肝中静脉,向后压迫下腔静脉,向上挤压第二肝门,如果肝功能尚可,ICG-15 分值在10%以内,残余肝体积>40%以上,最理想的手术方式是包括肝中静脉在内的S4、5、8+全尾叶切除式,从肿瘤的根治性来说,由于肿瘤处于腔静脉旁部,所以肿瘤常与肝中静脉致密粘连,或者侵犯肝中静脉,如果只是将肿瘤从肝中静脉上剥离下来,难以达到好的治疗效果,再说完全剥离下来手术对度加大,出血量也增多,所以理想的是切除肝中静脉,所以S4、5、8 段切除既增加了肿瘤的根治性,又使手术更为简单,术野显露更好。例如病例1,肿瘤直径达到8 cm,将右肝前叶、左内叶正常肝组织挤压变薄萎缩,如果采用肝正中裂劈开,手术创面会很大且肝中静脉已经与肿瘤融合无法保留,采用S4、5、8+全尾叶切除,使手术更简单,术野更清楚,同时此术式采用前入路技术,具有很大的优点,不需要像肝正中裂劈开那样要将整个肝脏充分游离,不会破坏肝脏的侧支循环,减少术后胸水、腹水的产生。先离断左侧面至第一肝门解剖出左侧Glisson 蒂,结扎并离断进入左尾叶门脉三联,沿着肝中静脉和左肝蒂的下方切断尾叶与左肝IV 段之间的肝实质,使尾状叶与左肝分离,同时离断Arantius 管,将尾状叶及下腔静脉拖向右侧,然后解剖出右侧Glisson 蒂,进入尾状叶的门脉三联离断,并离断右前蒂、肝中静脉,沿肝右静脉平面离断右侧面,离断尾叶与SVI、SVII 段之间的肝实质,使尾状叶与右肝分离,最后游离于下腔静腔之间的肝实质,使尾状叶与右肝分离,最后游离与下腔静脉之间的关系结扎并切断肝短静脉,移除标本,整个术野清晰,不会在狭小的深度空间操作。
上述3 例患者采用S4、5、8+全尾叶切除术后,因为肿瘤部位特殊性,就决定了零切缘,即使该术式可以保证切缘阴性,术后复发转移会较其他部位高[13,18],术后应该靶向治疗,病例1、2 术后3 周后口服索拉非尼,病例3 口服仑伐替尼,除病例1 术后12 个月左外叶复发行TACE 外,另外2 例均未复发,取得了较好的手术疗效。由于此部位的HCC 病例较少,还需完成更多病例数以验证此手术方式的有效性。
综上所述,经过3 例手术的经验,笔者认为对于腔静脉旁部的较大HCC 如果肝功能ICG15<10%,残余肝体积>40%以上,前入路S4、5、8 段切除+全尾叶切除是一个良好的策略,值得临床推广应用。
