血红素加氧酶-1促进导管相关性血栓溶解再通的实验研究
2022-01-17韦佳妮赵慧函蒋庆娟文萃黄欣欣凌瑛应燕萍
韦佳妮,赵慧函,蒋庆娟,文萃,黄欣欣,凌瑛,应燕萍
(广西医科大学第一附属医院护理部,广西南宁530021)
中心静脉导管(central venous catheter,CVC)是置入大静脉的长、软、细、中空的导管,使用CVC 在带来便利的同时,其导致的并发症不容忽略,尤其是导管相关血栓(catheter related thrombosis,CRT)形成[1-2]。CRT 是指因置管或导管直接损伤血管内膜及患者自身状态等因素,使导管外壁或内壁血凝块形成的过程[3]。目前CRT 的治疗主要为抗凝和溶栓治疗,其中抗凝治疗目的是阻止血栓进一步发展,使血栓缓慢地自然机化再通,但并没有加速血栓溶解过程[4]。溶栓治疗可以快速去除血栓,但是其仅适用于新鲜形成的血栓,且在一些特殊病例获利大于出血的风险时才推荐使用[5]。因此,血栓仍需自身缓慢机化再通,而血栓延迟溶解直接影响血栓后并发症的发生及患者预后[6]。血红素加氧酶1(heme oxygenase 1,HO-1)可通过介导复杂炎症反应及炎症依赖性,在血管新生、伤口的愈合、血管重塑过程发挥重要作用[7]。近年有研究发现,HO-1 在血栓的溶解再通过程中发挥重要作用[8],目前对于血栓的研究中大多集中于深静脉血栓形成(deep venous thrombosis,DVT)[9],而对于CRT 的溶解再通过程的研究较少,因此本研究通过构建大鼠CRT 模型,通过注射HO-1 激动剂与抑制剂,观察HO-1 在血栓溶解再通中的作用效果,以期为临床CRT 溶解再通过程及治疗提供依据。
1 材料与方法
1.1 实验动物
SPF 级雄性SD 大鼠72 只,周龄7~8 周,体质量200~250 g,购于广西医科大学动物实验中心(SCXK 桂2020-0003),本实验严格遵循实验动物3R 原则,并通过广西医科大学实验动物伦理委员会审查(审批号:202008006)。
1.2 主要仪器及试剂
多功能酶标仪(Synergy H1,美国)、切片机(Leica,德国)、实时荧光定量PCR 仪(Bio-Rad,美国)、颈静脉导管及堵头(思科诺思生物科技有限公司,中国)、大鼠HO-1、IL-6、IL-10 ELISA 试剂盒(上海酶联生物科技有限公司,中国)、钴原卟啉(Sigma,美国)、锡原卟啉(Senta Cruz Biotechnology,美国)、HE 染色试剂盒(北京索莱宝科技有限公司,中国)、RPLP1 及HO-1 引物(上海生工生物工程股份有限公司,中国)、CD31 抗体(AF6191,Affinity Biosciences,美国)、通用二步法试剂盒(北京中杉金桥生物技术有限公司)。
1.3 实验方法
1.3.1 造模方法 参照课题组前期实验方法[10],采用3%戊巴比妥钠(50 mg/kg)对大鼠进行腹腔注射麻醉,待麻醉满意后,右侧颈部备皮,常规消毒、铺巾,沿气管右侧0.5 cm 纵切颈部1~2 cm,导管至上腔静脉,缝合伤口,常规消毒。
1.3.2 分组及干预 课题组前期研究发现置管7 d后血栓高发,10 d 后血栓形成稳定[11]。因此,本研究选取置管后10 d 经B 超确诊血栓形成的大鼠CRT模型作为研究对象,采用动物随机分组软件将大鼠随机分为模型组、HO-1 激动剂组、HO-1 抑制剂组,每组24 只。激动剂组和抑制剂组在置管10 d后分别腹腔注射钴原卟啉(protoporphyrin IX cobalt chloride,CoPP)和锡原卟啉(tin protoporphyrin IX,SnPP)5 mg/kg 进行干预,模型组不做干预。
1.3.3 样本采集 在干预后的第1、7、14、28 天,每个时间点随机取6 只大鼠,大鼠麻醉后进行腹主动脉采血,离心收集血清后放置于-80 ℃冰箱,用于后续ELISA 检测血清HO-1、IL-6、IL-10 浓度。剪开大鼠置管侧皮肤,取自导管穿刺处至右心房上段血管,一部分血管用于病理切片染色;另一部分血管用于qPCR 检测。
1.4 评价指标
1.4.1 血栓溶解再通情况 血管组织经包埋切片染色后,在光镜下观察血栓溶解再通情况,应用Image J 图像分析软件分析,使用以下公式计算各组血栓溶解率:溶解率=[(静脉管腔面积-血栓面积)/静脉管腔面积]×100%[12]。
1.4.2 CD31 免疫组化染色 血管组织切片、抗原修复后,加入一抗、二抗,DAB 显色、苏木素复染并在光学显微镜下观察,计算其平均光密度值。
1.4.3 血清HO-1、IL-6、IL-10 含量 应用ELISA 法检测大鼠HO-1、IL-6、IL-10 含量,严格按照试剂盒说明书进行操作。
1.4.4 qPCR 检测血管组织HO-1 mRNA 表达 使用TRIzol 提取总RNA,逆转录为cDNA 后,用SYBR Green 法进行PCR 扩增,设置复孔,实验结果重复3 次。HO-1 序列:上游引物:5′-TCT GCA GGG GAG AAT CTT GC-3′,下游引物:5′-TTG GTG AGG GAA ATG TGC CA-3′。大鼠内参RPLP1 序列:上游引物:5′-AAA GCA GCT GGT GTC AAT GTT-3′,下游引物:5′-GCA GAT GAG GCT TCC AAT GT-3′。使用2-△△Ct 法分析qPCR 结果。
1.5 统计学处理
采用SPSS 24.0 软件进行数据处理。计量资料用均数±标准差(±s)描述。不同组之间采用单因素方差分析比较,若方差齐,则使用LSD 法进行两两比较,若方差不齐,则使用TamhaneT2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠基本情况及CRT病理形态
大鼠术后精神状态良好,存活率为100%,置管成功率为100%,导管留置期间无导管脱出。干预1 d 后可观察到各组CRT 形成趋于稳定,血栓胶原蛋白成分增多,并可见肉芽组织从静脉壁向血栓中心形成,血栓开始机化。随着时间增加,血栓体内部裂隙扩大,并可见有新生管腔样结构形成。至干预28 d 后,在血栓内部形成新的血管相互吻合再通,使被阻塞的血管部分血流重建,其中HO-1 激动剂组接近完全再通,HO-1 抑制剂组中管腔内有红细胞形成,仅部分再通(图1)。
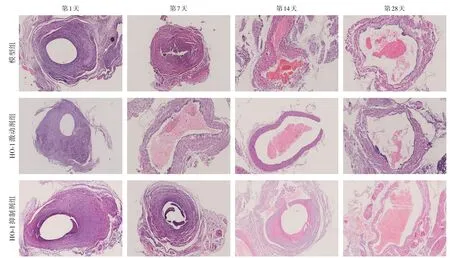
图1 各组干预不同时间点大鼠血管内血栓HE染色(×50)Figure 1 HE staining of thrombosis in the blood vessel in rats in each group at different time points(×50)
2.2 各组血栓溶解率
各组血栓溶解率随时间增长而增加。其中,HO-1 激动剂组各个时间点血栓溶解率高于模型组,而HO-1 抑制剂组均低于模型组,差异均有统计学意义(P<0.05 或P<0.01)(表1)。
表1 各组不同时间点血栓溶解率(%,±s)Table 1 Comparison of thrombolysis rates in each group at different time points(%,±s)
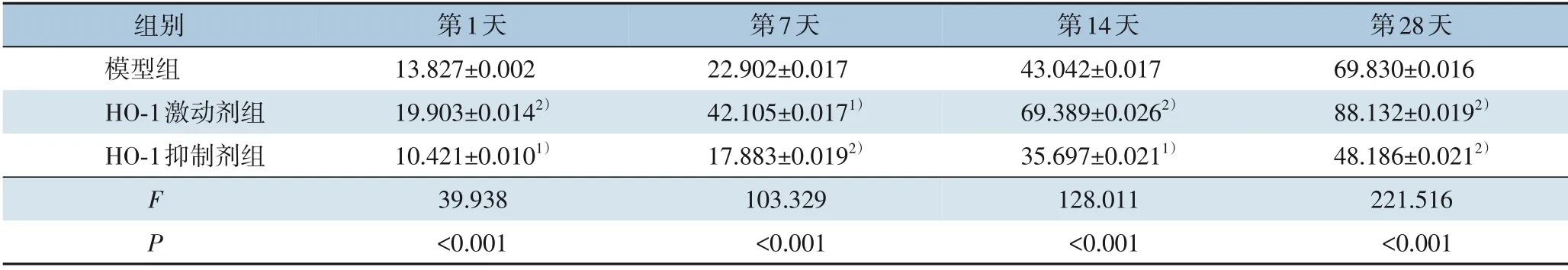
表1 各组不同时间点血栓溶解率(%,±s)Table 1 Comparison of thrombolysis rates in each group at different time points(%,±s)
注:1)与模型比较,P<0.05;2)与模型组比较,P<0.01Note:1)P<0.05 vs.model group;2)P<0.01 vs.model group
第28天69.830±0.016 88.132±0.0192)48.186±0.0212)221.516<0.001组别模型组HO-1激动剂组HO-1抑制剂组FP第1天13.827±0.002 19.903±0.0142)10.421±0.0101)39.938<0.001第7天22.902±0.017 42.105±0.0171)17.883±0.0192)103.329<0.001第14天43.042±0.017 69.389±0.0262)35.697±0.0211)128.011<0.001
2.3 血管组织CD31的免疫组化检测
免疫组化结果显示,CD31 表达于血管内皮间隙,与模型组比较,干预后各时间点HO-1 激动剂组中CD31 的表达明显增高,而HO-1 抑制剂组中CD31 的表达减少,差异均有统计学意义(均P<0.05)(图2)(表2)。
表2 各组不同时间点CD31平均光密度值的变化(±s)Table 2 Changes in CD31 average optical density at different time points in each group(±s)

表2 各组不同时间点CD31平均光密度值的变化(±s)Table 2 Changes in CD31 average optical density at different time points in each group(±s)
注:1)与模型组比较,P<0.01Note:1)P<0.01 vs.model group
第28天0.047±0.001 0.067±0.0011)0.033±0.0021)240.319<0.001组别模型组HO-1激动剂组HO-1抑制剂组FP第1天0.008±0.001 0.014±0.0011)0.003±0.0011)121.525<0.001 0.016±0.001 0.025±0.0011)0.010±0.0011)114.515<0.001第7天第14天0.031±0.001 0.048±0.0011)0.018±0.0011)274.039<0.001
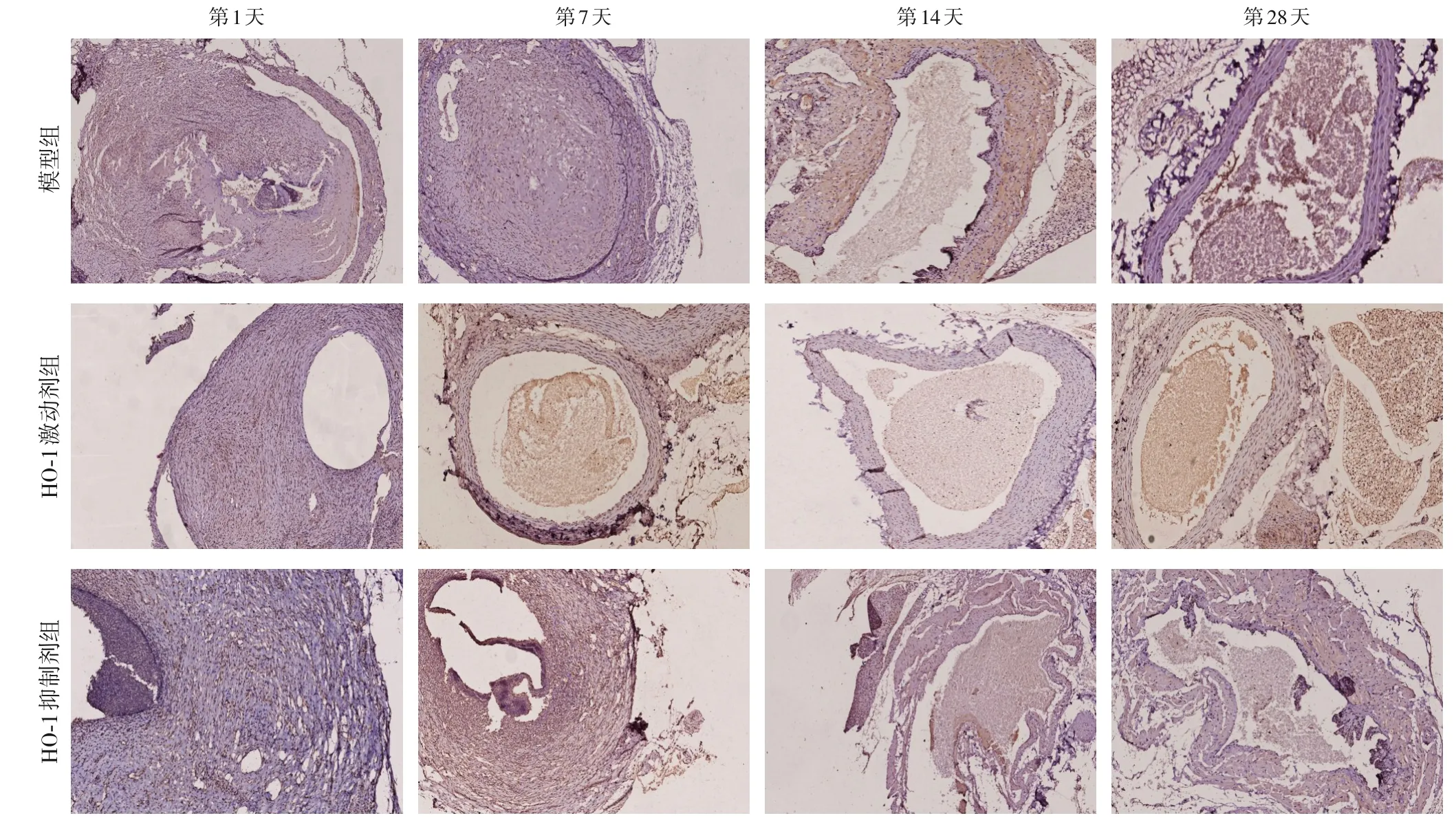
图2 各组不同时间点血管CD31免疫组织化学染色(×100)Figure 2 Immunohistochemical staining of CD31 at different time points in each group(×100)
2.4 各组不同时间点HO-1、IL-6、IL-10含量变化
干预后各时间点,HO-1 激动剂组HO-1、IL-10含量均高于其他两组,而IL-6 含量均低于其他两组,差异均有统计学意义(均P<0.05)。HO-1 抑制剂组干预后各时间点HO-1、IL-10 含量均低于模型组,IL-6 含量均高于模型组,差异均有统计学意义(均P<0.05)(图3)。

图3 各组不同时间点HO-1、IL-6、IL-10含量变化Figure 3 Changes of HO-1,IL-6 and IL-10 content in each group at different time points
2.5 各组不同时间点HO-1 mRNA表达情况
HO-1 激动剂组干预后各时间点血管组织中HO-1 mRNA 表达均高于其他两组,差异有统计学意义(均P<0.05);HO-1 抑制剂组干预后各时间点HO-1 mRNA 表达均低于其他两组,差异有统计学意义(均P<0.05)(图4)。
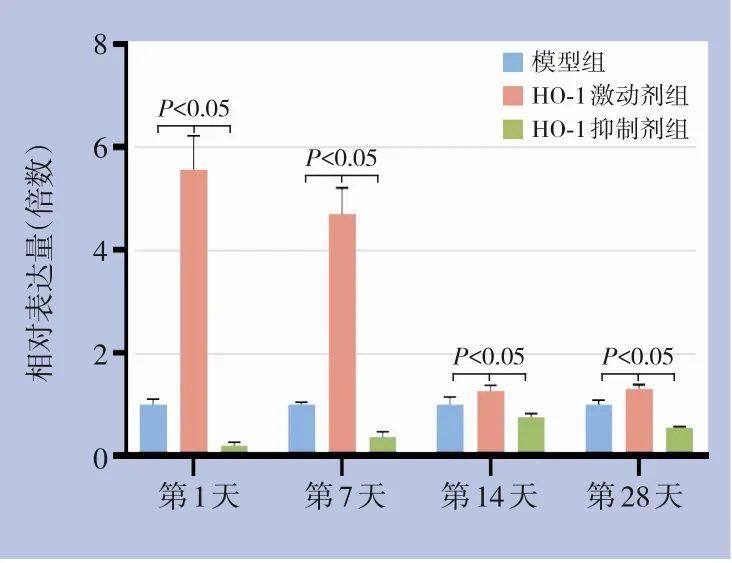
图4 各组不同时间点HO-1 mRNA表达情况变化Figure 4 Changes in HO-1mRNA expression in each group at different time points
3 讨论
前期已成功构建大鼠CRT 模型,并且通过B 超、病理切片染色等观察CRT 发生发展过程,对CRT形成过程进行了动态研究。发现大鼠置入CVC 后1~4 d 为CRT 的形成阶段;7~10 d 为CRT 形成高发时段;10~14 d 为CRT 机化发展阶段,14 d 血栓开始消退[10-11]。因此,导管留置10 d 是观察CRT 形成的一个关键时间点。本研究选用导管留置10 d 后血栓形成稳定的大鼠CRT 模型,在前期研究基础上进一步研究血栓溶解再通的过程。付健等[13]发现大鼠下腔静脉血栓的自然溶解演变过程伴随血管新生,其自然溶解演变过程与本研究相似。
HO-1 是一种诱导酶,其可催化血红素氧化为一氧化碳(CO)、铁和胆绿素(BV),这些产物可分别通过不同途径发挥抗炎症损伤和抗氧化应激损伤的作用[14]。在血管组织中,HO-1 保护内皮细胞免受各种诱导刺激,在伤口的愈合、血管重塑过程发挥重要作用,其具有免疫调节作用和促进血管新生功能[15]。同时,HO-1 在冠状动脉粥样硬化、急性脑梗死等疾病进展过程中具有抗氧化、减轻炎症反应的作用[16]。IL-6 是一种炎症反应因子,能够促进炎症反应;而IL-10 作为一种抗炎因子,能够抑制促炎因子的释放,从而抑制炎症反应[17]。HO-1 被IL-6 高度诱导,而HO-1 负调控IL-6,这表明HO-1 和IL-6 之间存在负反馈循环;而IL-10和HO-1 通过正反馈环相互联系,IL-10 诱导可促进HO-1 高表达,从而可发挥其抗炎作用[18-19]。南川川等[20]研究发现HO-1 能够增加脓毒症大鼠肾脏中血栓调节蛋白(thrombomodulin,TM)表达,发挥抗凝血及抗炎作用,从而改善脓毒症大鼠的肾脏功能。同时,越来越多的证据支持HO-1 诱导在血管损伤中的抗血栓作用,在DVT 形成早期,HO-1可通过减轻氧化应激、抑制血小板功能和抑制炎症反应等机制来实现抑制DVT 的形成[8]。在小鼠静脉血栓模型中,经HO-1 基因转染后,血栓显著减少,血红素诱导的HO-1 上调也降低了血凝块形成和纤溶酶原激活因子抑制物(PAI) 水平,表明HO-1 可能通过其分解产物直接发挥抗血栓作用[7,21]。先前有研究发现,诱导HO-1 高表达后,DVT 机化程度和溶解速度明显加快,抑制HO-1 表达后,其机化速度和溶解速度明显减慢[22]。这与本研究的结果相似,在本研究中,不同时间点HO-1 激动剂组血栓溶解率均高于模型组,HO-1 抑制剂组血栓溶解率均低于模型组,由此证明HO-1能促进血栓的溶解再通。
静脉血栓的溶解对于血管恢复通畅至关重要,其过程类似于正常的伤口愈合过程。需要纤维蛋白溶解、蛋白水解作用、炎症和血管生成的协调作用[23]。血栓形成后,血管壁和白细胞产生的活性氧通过氧化血栓内红细胞的血红蛋白,生成并释放游离亚铁血红素;其具有促炎和氧化作用,能加强炎症反应和凝血之间的相互作用,因此促进血液在血栓表面凝固,从而延迟DVT 的溶解;然而这种氧化能力和促炎可被HO-1 中和[8,24]。本研究发现HO-1 促进CRT 溶解过程中,炎症因子IL-6水平降低,而抑炎因子IL-10 升高,由此说明HO-1的抗炎反应可能有助于血栓溶解。而新生血管形成是血栓溶解再通的关键,血栓机化初期,血栓从血管壁回缩,导致在血栓主体和静脉壁内膜之间形成内皮细胞内衬的口袋样及裂缝结构,形成新的血管腔并相互融合扩大,逐渐恢复成血栓前状态,使堵塞的静脉恢复血流[25]。CD31 作为一种黏附性应激反应蛋白,在内皮细胞细胞连接高表达,是血管新生的标志物,既能维持内皮细胞连接的完整性,又能在炎症或血栓形成后加速血管通透性屏障的修复[26]。本研究通过对血管组织中的CD31 进行检测并分析,发现HO-1 激动剂组血栓溶解加快,其CD31 表达升高,表明诱导HO-1 表达可促进CRT 溶解再通,其机制可能与其促进新生血管形成功能有关。一项研究发现通过药物诱导HO-1 表达和基因修饰都能促进小鼠心肌梗死后的心肌新生血管生成,最终减轻心肌损伤,改善心功能[27]。近期也有研究表明,HO-1 可促进内皮祖细胞(EPCs)的增殖动员及迁移,并聚集至损伤区域向新生内皮细胞分化,从而促进血管修复并能增强其活力及抗氧化应激损伤能力,这可能是HO-1 促进血管新生的关键机制[28]。因此,HO-1 能促进CRT 的溶解再通,可能与抑制炎症反应,促进血管新生的功能有关。
综上所述,HO-1 是组织细胞应对损伤性刺激的一种内源性适应保护方式,且多项研究均证实HO-1 在促进血栓溶解再通中具有重要作用,可通过多种途径和机制促进血栓溶解,其中主要的机制是HO-1 及其分解产物的抑制炎症反应及促血管新生作用。诱导HO-1 表达从而修复血管,抑制炎症反应已在不同研究中发现其临床应用价值,一项研究发现水蛭提取物可通过上调HO-1 表达,提高抗氧化能力,减少氧化应激和减轻血管损伤,从而预防血栓形成[29];Wu 等[30]表明银杏叶提取物可诱导HO-1 表达对钢丝损伤后血管修复中起关键作用;Zheng 等[31]发现在血管移植中的PU 管壁内加入天麻素,可激活HO-1,具有促进血管再生,抑制炎症的潜力。因此继续深入研究HO-1 在血栓溶解再通中促进血管生成,抑制炎症的作用机制及效果,可能会为未来验证HO-1 作为血管修复和相关疾病的潜在治疗策略的药理诱导作用提供新的理论基础。
