褪黑素保护心肌缺血再灌注损伤机制的研究进展▲
2022-01-17郑孝明徐彤彤彭丽覃秋语
郑孝明 徐彤彤 彭丽 覃秋语
1 桂林医学院,广西桂林市 541001;2 桂林医学院附属医院综合科(医疗保健病区),广西桂林市 541001
【提要】 目的 心肌缺血再灌注损伤(MIRI)可加剧缺血心肌的损伤,甚至出现心肌不可逆性损伤,严重损害患者健康,其发生机制包括氧自由基堆积、炎症级联反应、细胞内钙超载和线粒体损伤等。褪黑素(MT)是一种具有苯并五元氮杂环结构的内分泌激素,可以通过抑制细胞凋亡、调控细胞自噬水平、减轻过氧化损伤、抗炎症反应、减轻细胞内钙超载和减轻线粒体损伤等对再灌注心肌发挥保护作用。本文就近年来关于MT对缺血再灌注心肌的保护作用及其作用机制的研究进展综述如下。
统计结果显示,2016年中国居民的急性心肌梗死(AMI)病死率仍保持着往年的上升趋势,2016年城市地区的AMI病死率为58.69/10万,农村地区高达74.72/10万[1]。虽然及时使缺血区的血流再通可以挽救AMI患者的生命,但再灌注同时也会加剧心肌细胞的代谢失调与结构损坏,使心肌组织进一步受损,即发生心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)[2]。如何减轻MIRI对改善AMI患者的预后具有重要意义。褪黑素(melatonin,MT)是一种由人体内部产生并且受到交感神经调节的典型神经内分泌激素,但来自于食物中的外源性MT经胃肠道吸收后也可对人体多个器官、系统发挥作用。近年来,MT由于其强效清除自由基的作用而被广泛应用于不同器官的缺血再灌注模型,其对MIRI动物实验模型的保护作用尤为显著。本文就近年来国内外关于MT及其对MIRI的保护作用及机制的研究进展综述如下。
1 褪黑素概述
褪黑素(MT)主要是由哺乳动物的松果体腺细胞在黑暗条件下以色氨酸为原料合成的一种吲哚类物质。但富含MT的生物却不限于哺乳动物,还包括单细胞生物、非脊椎动物甚至某些植物。MT的化学名称为N-乙酰基-5-甲氧基色胺,结构式如图1所示,分子式为C13N2H16O2,为一种小分子物质,具有非极性。由于这些特点,MT可以轻易地进入各类细胞膜及血脑屏障,被释放入血后可调节机体各系统生理活动,是一种多功能激素。MT除了可以直接发挥其生物学作用外,还能通过和特异性受体结合激活相关的信号通路间接发挥作用。MT下游受体有三类:第一类是膜受体,分为MT1和MT2,MT与它们结合可以调节腺苷酸环化酶、鸟苷酸环化酶、磷脂酶C和钙通道的活性,从而影响细胞内信号的传导和细胞内离子含量;第二类是胞质受体(MT3),MT3是一种可抑制醌的电子转移反应从而防止氧化应激的醌还原酶;第三类是核受体,即维甲酸相关孤核受体,MT可通过此类受体调控维甲酸受体超家族的转录因子而发挥相应作用。最近人们发现了MT相关孤儿受体即G蛋白偶联受体50,其虽不与MT结合,但可增强MT与MT1受体的结合。MT的生物学作用包括促进睡眠、调控生物节律、延缓衰老、抗肿瘤生长、促进正常细胞生长、抗氧化、保护神经、抗炎症损伤、调节免疫、对其他内分泌的调节等[3]。
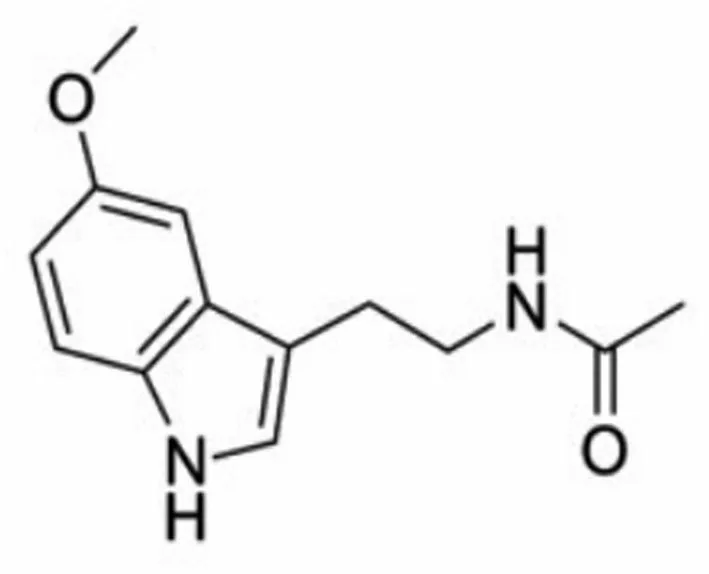
图1 MT结构式
2 褪黑素与心肌缺血再灌注损伤
研究表明,MT可以减轻MIRI,具体表现为MT可以有效保护线粒体、促进三磷酸腺苷(ATP)合成、减少细胞过氧化损伤、抑制凋亡发生、减轻炎症反应、降低心肌酶的异常表达、减轻心肌水肿、缩小心肌梗死范围、改善心脏功能和降低心肌再灌注性心律失常发生率等[4]。Shafiei等[5]报道,冠状动脉旁路移植术患者术前口服N-乙酰半胱氨酸和MT后可通过抗氧化应激减轻早期再灌注损伤。Dominguez-Rodriguez等[6]报道,ST段抬高型心肌梗死患者早期使用MT可明显缩小再灌注治疗后的心肌梗死范围。Dwaich等[7]报道,接受冠状动脉搭桥术的缺血性心脏病患者术前经MT预处理可以减轻氧化应激水平和炎症反应,改善左室功能,减轻心肌细胞凋亡,减轻MIRI,且大剂量MT(20 mg/d)较小剂量MT(10 mg/d)效果更为显著。Stroethoff等[8]通过研究发现,MT受体激动剂可通过激活线粒体钾离子通道,减少再灌注心肌细胞死亡数量,缩小心肌梗死面积,减轻MIRI。由此可见,MT可保护再灌注心肌,主要通过抗细胞凋亡、调控细胞自噬、抗氧化应激、减轻炎症反应、减轻细胞内钙超载、减轻线粒体损伤等机制来实现。
2.1 MT通过抗细胞凋亡减轻MIRI 细胞凋亡是由基因控制的细胞主动程序性死亡,尤其与凋亡相关基因B淋巴细胞瘤-2基因(Bcl-2)家族密切相关,Bcl-2/Bcl-2相关X蛋白(Bcl-2-associated x, Bax)比值的变化调控着细胞在接受到凋亡信号传导后是否发生凋亡及凋亡程度。细胞接受到凋亡诱导信号时可通过最关键的内源性途径即线粒体途径的传导,激活半胱天冬酶(cysteinyl aspartate specific protease, caspase),触发caspase级联反应导致大量的细胞凋亡。MIRI中的细胞凋亡是多因素、多途径、多位点的,不只是某条通路的简单介导,还包括caspase12参与的内质网途径和外源性途径即caspase8依赖的死亡受体途径的介导,彼此之间相互交联[9]。
恢复血供的缺血心肌细胞的凋亡相关基因表达水平会发生改变,并且再灌注过程中引发的氧化应激、炎性细胞及介质的浸润和钙超载等也会诱发心肌细胞凋亡。因此,抗凋亡或调节特异性抗相关凋亡信号通路是减轻MIRI的有效方法,MT具有明显的抗凋亡作用,不仅可通过调节线粒体通透性转换孔的开放来影响线粒体途径的凋亡信号传导进而减少细胞的凋亡,还能通过直接抑制细胞色素C的释放而抑制caspase级联反应,提高细胞的存活率[10]。
在MIRI中,MT可通过下调促凋亡因子Bax的表达水平并升高抗凋亡因子Bcl-2的表达水平来减少再灌注后的心肌细胞凋亡,促进机体心肌缺血再灌注后血流动力学的恢复[11]。Zhang等[12]利用H9C2细胞建立体外MIRI模型进行研究发现,MT可以激活核因子E2相关因子2(nuclear factor-erythroid2 related factor2,Nrf2)信号通路,而Nrf2被激活后又使其下游基因血红素氧合酶-1的表达增加,最终降低细胞凋亡率,减轻MIRI。Yu等[13]通过MT预处理雄性大鼠4周后行MIRI手术的在体实验,以及用MT处理H9C2心肌细胞后进行MI/R的体外研究发现,MT可通过受体依赖的方式激活Notch1基因及其下游靶基因Hes1的表达,增加Akt磷酸化,从而激活Akt抗细胞凋亡信号通路,通过减少心肌细胞的凋亡数量及缩小心肌梗死范围,发挥保护再灌注心肌的作用。酪氨酸激酶2/信号转导子和转录激活子3(janus kinase2/signal transducer and activator of transcription3, JAK2/STAT3)途径在大鼠死亡后心脏的供体移植实验模型中被发现,可能是MT减少心肌细胞凋亡、保护心脏免受再灌注损伤的途径之一[14];沉默信息调节因子1(silent information regulator, SIRT1)途径也在经MT预处理后接受MI/R手术的大鼠模型中被发现,是MT抗再灌注心肌细胞凋亡的相关作用机制[15]。由此可见,MT可以介导多条通路抑制细胞凋亡,减轻MIRI。
2.2 MT通过调控细胞自噬减轻MIRI 真核生物进行生长发育、物质合成和其他一些病理过程时会出现细胞器破坏和蛋白质损伤,此时机体会通过一种自身保护性机制来降解体内的这些损伤物质,为其余细胞的存活提供原料,以实现自我更新和机体的存活,维持代谢平衡和内环境稳定,这种机制被称为细胞自噬。自噬通过降解受损的细胞器以保持细胞内ATP的水平并抑制细胞凋亡的发生,对缺血损伤的心肌具有一定的保护作用。再灌注会激活自噬相关基因Beclin-1并诱导氧化应激、钙超载、内质网应激和线粒体功能障碍等一系列病理生理过程的发生,最终导致细胞自噬过度发生,引发大量细胞器和蛋白质被溶酶体清除而不利于细胞的存活,使细胞功能发生障碍甚至出现自噬性细胞死亡,导致心肌损伤加重[16]。MT可以通过调节细胞自噬来减少细胞损伤及死亡,发挥重要的细胞保护作用。徐臣年等[17]在H9C2心肌细胞缺血再灌注实验模型中发现,经MT处理的细胞自噬相关蛋白,例如Beclin-1、自噬相关基因5和微管相关蛋白1轻链3B(microtubule-associated protein 1 light chain 3B, LC3B)均下调,细胞存活率增高;阻碍Akt/mTOR信号通路时,MT的相关保护作用会相应地减弱,因此认为MT可能是通过激活Akt/mTOR信号通路,下调心肌细胞自噬水平来减轻MIRI。Chen等[18]报道,在关于MT对大鼠MIRI模型的作用和MT对体外心肌微血管内皮细胞影响的相关研究中发现,心肌再灌注时MT可通过激活AMPK/mTOR信号通路减轻细胞自噬的水平,缩小心肌梗死面积,减轻细胞损伤。由此可见,MT可以通过激活Akt/mTOR和AMPK/mTOR信号通路,减轻过度的细胞自噬水平,减少细胞死亡,从而减轻MIRI。
2.3 MT通过减轻氧化应激减轻MIRI 人体进行各项生理活动的同时伴随着许多代谢产物的生成,其中活性氧(ROS)就是一类含有氧自由基物质的总称,当细胞受到内外环境的一些有害因素刺激时,会产生大量ROS,引发氧化应激反应。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶和作为氢载体的硫氧还蛋白(thioredoxin, TRX)等一系列的抗氧化酶,以及一些由还原性物质所组成的人体内庞大的抗氧化防御体系维持着ROS的平衡。MT具有强抗氧化性,其吲哚环上的5-甲氧基化学结构可极大地增强其捕获自由基的能力,而N-乙酰基则可保护MT不被单胺氧化酶降解;MT除了可直接与自由基结合外,还可以通过提高体内抗氧化酶的活性而增强清除ROS的能力,间接减轻氧化应激反应[19]。MT作为体内的非酶抗氧化物质,其作用不容忽略。
心肌再灌注后恢复血液供应的血管内皮细胞中的黄嘌呤氧化酶被大量激活,加上心肌细胞线粒体电子传递链式反应和炎症细胞NADPH氧化酶(NADPH oxidase,NOX)的激活,会引发大量ROS生成,同时内源性抗氧化酶活性的降低,最终导致机体内ROS过多,超过机体的清除能力而发生氧化损伤。心肌细胞膜和细胞器等结构都可能被ROS氧化而发生结构破坏继而出现功能受损,产生的丙二醛等物质具有细胞毒性,会引起细胞功能和能量生成障碍,发生氧化应激损伤,扩大心肌梗死面积并恶化心功能[20]。
MT可通过减轻细胞氧化应激对MIRI发挥保护作用。Yang等[21]报道,MT能通过降低雄性大鼠MIRI模型下丘脑室旁核内SOD的表达,增强下丘脑室旁核中NOX2和NOX4的表达,进而减轻氧化应激及抑制大鼠的交感神经活动以减轻MIRI。Zhai等[22]报道,MT可以通过激活小鼠MIRI模型SIRT3/SOD2信号通路,上调谷胱甘肽过氧化物酶、醌氧化还原酶和SOD等酶的活性和Nrf2的表达水平,降低NOX2的表达和丙二醛的生成量,提高抗氧化能力,降低ROS水平,减轻MIRI的氧化应激水平。Yu等[23]报道,MT能通过激活Notch1/Hes1/Akt途径来激活急性高糖状态大鼠MIRI模型的TRX系统(TRX、TRX还原酶和NADPH),维持氧化平衡,减轻MIRI。
2.4 MT通过减轻炎症反应减轻MIRI 炎症反应是机体对各种损伤因子的刺激所产生的以保护性反应为主的防御过程。适度的炎症反应可以清除坏死的组织、修复受损伤的组织,对机体受伤组织的愈合和器官功能的恢复是必不可少的,但不受控制的或过度的炎症反应会对机体造成严重危害。
缺血缺氧时会发生心肌细胞的坏死和血管内皮的损伤,再灌注后大量生成的ROS和心肌细胞内钙超载也会加重细胞损伤;缺血再灌注过程中,中性粒细胞等炎性细胞会大量聚集到损伤部位,激活的中性粒细胞可产生大量的黏附分子,降低微血管血流灌注量,甚至出现“无复流现象”。炎性细胞可产生大量炎症介质和炎性因子,促进炎性细胞的大量浸润,引发炎性反应过度激活即发生炎症级联反应,进而加重损伤。例如肿瘤坏死因子-α(TNF-α)作为炎症反应中的一个十分重要的细胞因子会在MIRI中迅速表达,使再灌注心肌细胞的离子平衡状态发生改变,诱发再灌注性心律失常,同时通过激活内皮细胞中的黄嘌呤氧化酶产生ROS,导致血管内皮功能障碍。
MT在多种疾病实验模型中都被检测到具有抗炎特性,在MIRI相关实验模型中,MT对MIRI的保护作用与其抗炎症反应的特性密切相关。Lan等[14]报道,在大鼠MIRI模型中,MT可通过激活JAK2/STAT3信号通路,降低TNF-α和白细胞介素-6(interleukin-6,IL-6)等炎性因子的表达水平,从而减轻心肌水肿;Gul-Kahraman等[24]通过是否将松果体切除建立不同的大鼠离体心肌再灌注模型进行研究发现,MT能通过介导平衡炎症的核心因子—核转录因子κB的表达,减少再灌注后TNF-α、细胞黏附分子、IL-1β、IL-6和一氧化氮合酶等炎性因子和炎症介质的表达。Nduhirabandi等[25]通过对MT(75 ng/L)预处理大鼠或小鼠离体心脏再灌注模型进行研究发现,MT能使Toll样受体4被大量激活,进而激活TNFa/STAT3途径,减少心肌再灌注的炎性损伤。
2.5 MT通过抑制钙超载减轻MIRI 心肌细胞缺血缺氧时ATP生成显著减少,细胞膜上的钠泵活性降低,Na+泵出减少,胞内Na+浓度增加。再灌注时,氧和营养物质富集于缺血细胞,钠泵活性得以再激活并迅速激活膜上的反向钠钙交换体将集聚的Na+排出,导致胞外Ca2+大量内流,使细胞内液中的Ca2+浓度可升高至正常时的200倍,最终形成胞内钙超载[26]。Pittas等[27]报道,细胞内钙超载引起MIRI可能与以下因素相关:(1)胞质内的Ca2+进入线粒体时会消耗大量ATP,而且Ca2+会影响线粒体的生物功能,阻碍能量的生成,影响细胞舒缩功能甚至出现心力衰竭;(2)磷脂酶类和钙依赖性蛋白酶活性因胞内Ca2+的增加被激活,进而分解细胞膜及结构蛋白,导致心肌结构受损,引发不可逆性损伤;(3)ATP酶的活性受到Ca2+的干扰,ATP被大量水解释放出大量H+,加重细胞内酸碱失衡,引发再灌注性心律失常。因此,减轻细胞内钙超载对保护缺血再灌注心肌具有非比寻常的意义。
研究发现,在MIRI模型中,MT可通过激活衰老标记蛋白30,调控胞膜Ca2+泵,增强Ca2+外流,使胞内大幅升高的Ca2+浓度得以降低,从而减轻细胞损伤[28]。Zhu等[29]报道,MT能通过激活丝裂原活化蛋白激酶/细胞外调节蛋白激酶通路调节环磷酸腺苷反应元件结合蛋白的表达,从而抑制三磷酸肌醇受体和电压依赖性阴离子通道的表达,降低细胞质和线粒体钙泵的活化,逆转细胞质与线粒体中Ca2+的比值,促进胞质Ca2+和线粒体Ca2+的稳态,改善心功能,增强微血管对再灌注损伤的抵抗力,从而减轻MIRI。
2.6 MT通过减轻线粒体损伤减轻MIRI 线粒体作为生产ATP的场所,是机体能量代谢的中心,同时还能产生ROS和促凋亡因子,参与细胞的信号传导等。线粒体的形态是高度动态化的,可通过不断地分裂和融合来满足细胞不同的生理需求。就细胞的结构与功能而言,线粒体生物学及动力学的完整性是必不可少的,心肌细胞因其对能量的需求极高因此含有非常丰富的线粒体。线粒体作为关键的细胞器,在缺血再灌注等许多病理条件下会受到损伤,相反线粒体损伤也可能是引起心脏和其他组织器官损伤的主要原因之一,这可能与能量应激和大量产生ROS有关,并伴随着氧化应激、钙升高、细胞凋亡和坏死等的发生。拥有许多复杂的生物功能的线粒体在MIRI中发挥着非常重要的作用,因此保护线粒体的稳定性和功能对减轻MIRI有着重要的意义。
MT可以通过减轻线粒体损伤来减轻MIRI。Zhang等[30]报道,在小鼠MIRI模型中,MT可通过激活AMPK/OPA1信号通路,矫正MIRI时线粒体融合和分裂的异常,确保线粒体的质量和数量,为线粒体和心脏发送促存活信号。Yu等[31]报道,在1型糖尿病大鼠MIRI模型中,MT能通过调控AMPK/PGC-1α/SIRT3轴来保护线粒体功能,从而减轻MIRI。Zhou等[32]报道,在小鼠MIRI模型中,MT可以通过介导PPARγ/FUNDC1通路改善线粒体电子传递链的功能,促进ATP生成,从而抑制血小板过度活化,减轻小鼠MIRI。
3 小 结
近年来,随着对MT相关效应的深入研究发现,MT除具有传统意义上的生物节律作用外,还能有效保护机体的心血管系统。MT可通过抑制细胞凋亡、调控细胞自噬、降低细胞氧化应激水平、抗机体炎性反应、减轻细胞内钙超载和保护线粒体等减少再灌注后心肌梗死面积的进一步扩大,促进心脏功能恢复。MT是一种内源性分子,用于人体的治疗是很安全的,阐明MT对再灌注心肌的保护作用可为如何减轻MIRI提供参考。但是,目前有关MT在心肌缺血再灌注中应用的临床研究仍较局限,MT的使用时间、方法、部位和剂量问题等仍有待进一步探索。
