山黧豆LsSULTR基因的克隆与表达分析
2022-01-14徐全乐
陈 红,曾 鹏,徐全乐
(西北农林科技大学 生命科学学院,陕西杨陵 712100)
山黧豆(Lathyrussativus)具有较高的蛋白含量、广谱的抗逆性以及对环境友好等特征,对于联合国粮农组织零饥饿计划(Zero Hunger in Asia and the Pacific)的实施具有重要的作用[1]。其内源活性成分β-N-草酰-L-α,β-二氨基丙酸(β-N-oxalyl-L-α,β-diaminopropionic acid,β-ODAP)广泛存在于三七和人参等传统中药材中,具有止血、抗炎、保护神经的作用,被命名为三七素[2-3]。研究表明,β-ODAP的生物合成途径和硫代谢途径密切相关[3-6]。
植物硫酸盐转运蛋白(sulfate transporter,SULTRs)可以吸收和转运土壤硫酸盐参与植物硫代谢[7]。目前,拟南芥[8](Arabidopsisthaliana)、大豆[9](Glycinemax)、水稻[10](Oryzasativa)等多种植物的SULTR基因已经得到克隆和鉴定。通常,植物基因组含有多个SULTR基因,例如拟南芥、水稻等基因组分别含有12和11个SULTR基因,苔藓基因组含有5个SULTR基因[11-12]。植物硫酸盐转运蛋白属于ABC转运蛋白超家族(ATP-binding cassette transporter,ABC),其特征为C端具有抗σ因子拮抗(antisigma factor antagonist,STAS)结构域,N端具有硫转运(Sulfate_transp)结构域;同时,还包含跨膜结构域(transmebrane domains,TMDs)[13]。根据序列同源性、亚细胞定位、功能特异性等将SULTR划分为SULTR Ⅰ-Ⅳ等4个亚家族,包含高亲和力硫酸盐转运蛋白(high-affinitysulfatetransporters,HAST)、低亲和力硫酸盐转运蛋白(low-affinity sulfate transporters,LAST)、液泡转运蛋白、质膜及内共生体转运蛋白等[14-15]。其中,HAST广泛分布于根表皮,包含SULTR1;1、SULTR1;2、SULTR1;3,促进植物对土壤硫酸盐的吸收;LAST主要在邻近木质部和韧皮部的薄壁组织表达,负责长距离运输,包含SULTR2;1、SULTR2;2、SULTR3;5。SULTR1;3、SULTR2;1、SULTR2;2、SULTR3;5协同作用将根吸收的硫酸盐长距离运输到茎及叶片的叶肉细胞,一部分被SULTR4;1和SULTR4;2运载到液泡储存,一部分被SULTR3;1、SULTR3;2、SULTR3;3、SULTR3;4等运载到胞质参与代谢反应[7,12,16]。
本研究经序列比对分析,从山黧豆种子萌发期不同组织的转录组数据(SRP145030)中查找到13条LsSULTR基因序列。通过LsSULTR基因表达与β-ODAP含量的相关性分析,筛选了LsSULTR3;3和LsSULTR3;5进行功能预测、基因克隆和组织表达分析等,为进一步研究山黧豆LsSULTR基因在β-ODAP生物合成中的功能奠定基础。
1 材料和方法
1.1 材 料
山黧豆(Lathyrussativus)种子为本实验室保存,种植于西北农林科技大学试验田。取山黧豆不同生长时期的主根、侧根、幼叶、成熟叶、茎、花、荚,以及盛荚初期(S2)、鼓粒满期(S6)和完熟期(S8)的种子,液氮速冻后于-80 ℃保存备用。
1.2 方 法
1.2.1 本地山黧豆转录组数据库中鉴定LsSULTR从NCBI下载12条拟南芥(Arabidopsisthaliana)硫酸盐转运蛋白的编码序列(coding sequence,CDS)作为参考序列,利用BioEdit在本实验室前期所测的山黧豆种子萌发期不同组织[播种后2 d(days after sowing,DAS)种子、6DAS幼苗、25DAS叶片]的转录组分析数据库(SRP145030)中进行本地序列比对,获得山黧豆硫酸盐转运蛋白基因序列。用ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)获得转录本对应的蛋白序列,并用MEGA-X软件按最大似然法(Maximum Likelihood)构建拟南芥和山黧豆硫酸盐转运蛋白进化树,Bootstrap设置500次重复。
1.2.2 生物信息学分析利用MEGA-X软件,以最大似然法建立山黧豆(L.sativus)、拟南芥(A.thaliana)、豌豆(Pisumsativum)等的硫酸盐转运蛋白SULTR3;3和SULTR3;5的进化树。运用在线软件SMART(http://smart. embl-heidelberg.de/)分析LsSULTR3;3和LsSULTR3;5蛋白的保守结构域,利用SOPMA(https://npsa-prabi.ibcp. fr/cgi- bin/npsa_automat.pl?page=npsa_sopma.

表1 本研究所用的引物
html)预测蛋白质的二级结构组成,TMHMM(http://www. cbs.dtu.dk/services/(TMHMM/)预测蛋白质跨膜结构域,SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)和WoLFPSORT (https://wolfpsort.hgc.jp/)等方法预测蛋白亚细胞定位,SWISS-MODEL(https://swissmodel.expasy.org)预测蛋白质的三维结构。利用NetPhos3.1Server(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点,PlantCare(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html)预测启动子顺式作用元件。
1.2.3LsSULTR3;3和LsSULTR3;5基因CDS全长序列的克隆采用RNAiso Plus(TaKaRa)提取山黧豆25 DAS叶片的总RNA,经1%琼脂糖凝胶电泳检测后,采用FastKing RT Kit(With gDNase)反转录试剂盒(天根)获得cDNA序列用于LsSULTR3;3和LsSULTR3;5基因CDS全长序列的克隆。PCR扩增体系为20 μL,包含cDNA模板1 μL,2×Green Taq Mix 10 μL,上、下游引物各0.5 μL,ddH2O 8 μL;PCR程序为:95 ℃预变性2 min;95 ℃变性15 s,67 ℃退火15 s,72 ℃延伸2 min,35个循环。PCR产物送北京擎科生物科技有限公司西安分公司测序。
1.2.4 基因表达分析采用RNAiso Plus(TaKaRa)提取不同生长时期山黧豆的主根、侧根、幼叶、成熟叶、茎、花、荚、S2时期种子、S6时期种子、S8时期种子的总RNA。根据LsSULTR3;3和LsSULTR3;5序列设计基因特异性引物(表1),以poly-ubiquitine(LspUBQ)为内参基因进行半定量RT-PCR分析。
2 结果与分析
2.1 本地转录组数据中LsSULTR基因的表达分析
以拟南芥硫酸盐转运蛋白的CDS序列为参考序列,在山黧豆种子萌发期不同组织的转录组学分析数据库(SRP145030)中比对到13条山黧豆LsSULTR基因(表2)。进化树分析表明,拟南芥SULTR蛋白和本地转录组数据库中的LsSULTR基因编码蛋白分别隶属于SULTR Ⅰ-Ⅳ 4个亚家族,(图1)。
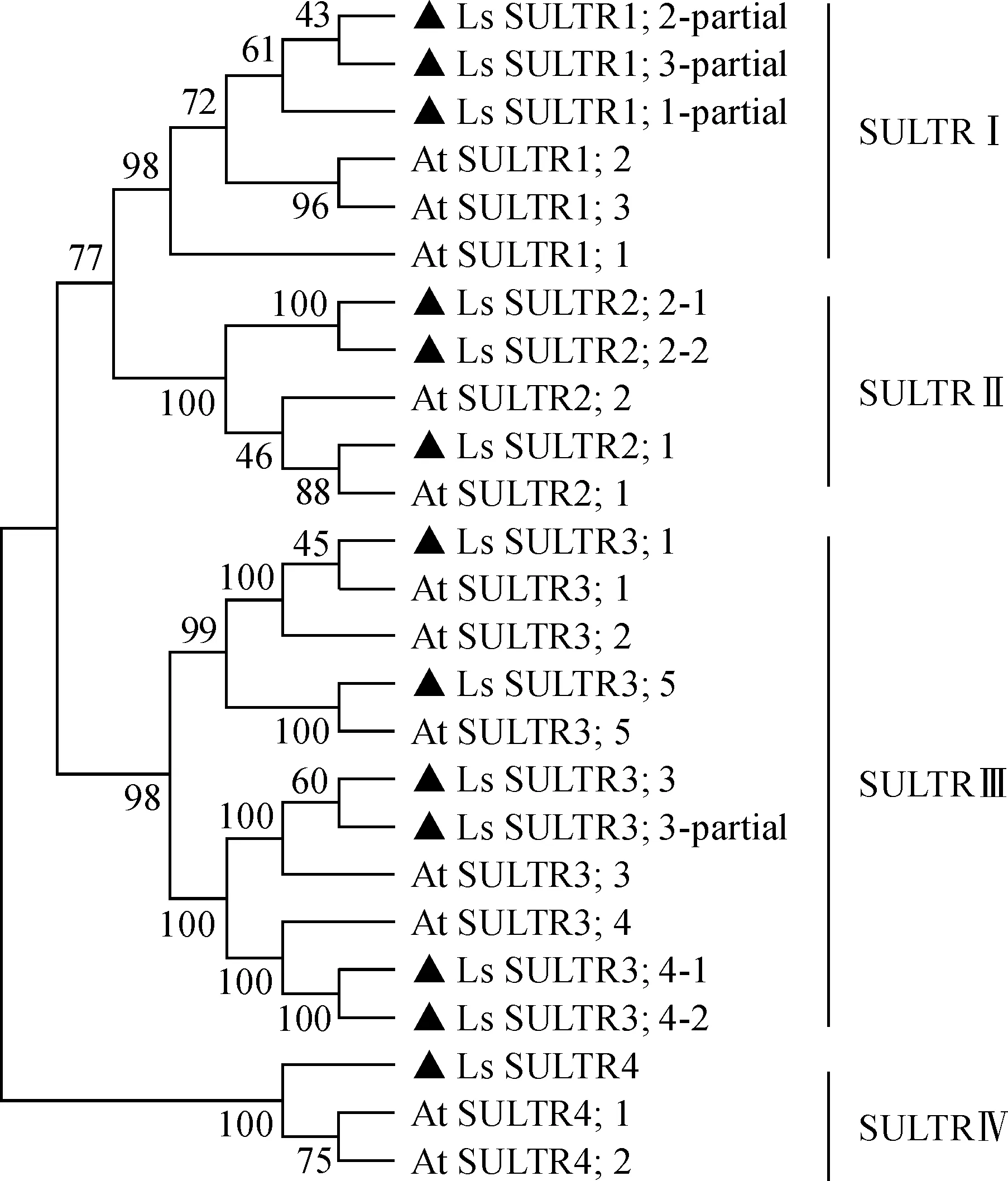
黑色三角表示山黧豆硫酸盐转运蛋白图1 山黧豆和拟南芥(AtSULTRs)硫酸盐转运蛋白的进化分析LsSULTRs were marked with black triangleFig.1 Phylogenetic tree of putative LsSULTRs and characterized AtSULTRs
在转录组样本中,LsSULTR基因的表达量呈现显著性差异。例如,当6 DAS和2 DAS比较时,LsSULTR3;5基因的表达量下调了6.067倍(P<0.05);在25 DAS和6 DAS比较时,LsSULTR2;1和LsSULTR2;2-2基因的表达量分别上调了3.277(P<0.05)和3.865倍(P<0.01)(表2)。LsSULTR2;1和LsSULTR2;2与拟南芥低亲和力转运蛋白AtSULTR2聚为一簇(图1),可能主要负责硫酸盐的运输[14];LsSULTR3;5与拟南芥 AtSULTR3;5聚为一簇(图1),可能参与硫酸盐的跨膜运输、还原或者增强SULTR2蛋白的硫酸盐运输能力[13-14]。本研究选取LsSULTR3;3和LsSULTR3;5进行后续分析。
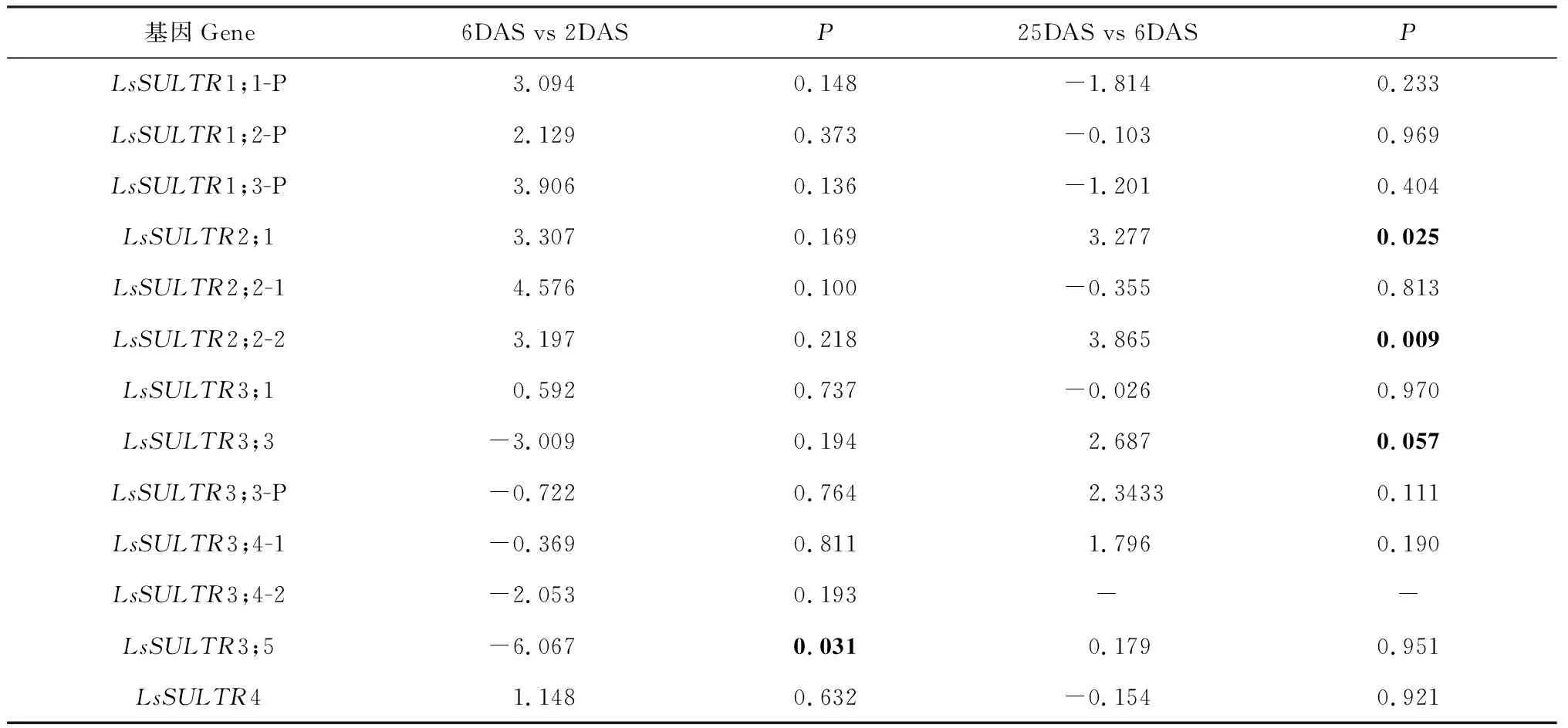
表2 山黧豆种子萌发期LsSULTRs转录组数据的差异表达分析
2.2 LsSULTR3;3和LsSULTR3;5蛋白生物信息学分析
2.2.1 蛋白理化性质分析蛋白质理化性质分析显示,LsSULTR3;3由653个氨基酸组成,分子量为71.39 kD,等电点为9.28;LsSULTR3;5蛋白由640个氨基酸组成,分子量为70.72 kD,等电点为9.01。
2.2.2 进化分析构建山黧豆、拟南芥、豌豆等物种的SULTR3;3和SULTR3;5蛋白系统发育树(图2)。结果显示,LsSULTR3;3蛋白与豌豆PsSULTR3;3(AKV94662.1)聚在同一支,LsSULTR3;5蛋白与豌豆PsSULTR3;5(AKV94664.1)聚在同一支,且相似度均达到100%。说明LsSULTR3;3和LsSULTR3;5分别隶属于SULTR3;3和SULTR3;5蛋白家族,山黧豆与豌豆硫酸盐转运蛋白的亲缘关系最近。
2.2.3 蛋白结构分析SMART分析表明,LsSULTR3;3和LsSULTR3;5具有硫酸盐转运蛋白的典型结构域。LsSULTR3;3在N端存在Sulfate_transp结构域(PF00916,80-461位氨基酸),C端存在STAS结构域(PF01740,512-630位氨基酸);LsSULTR3;5在N端存在Sulfate_transp结构域(PF00916,74-455位氨基酸),C端存在STAS结构域(PF01740,506-620位氨基酸)。
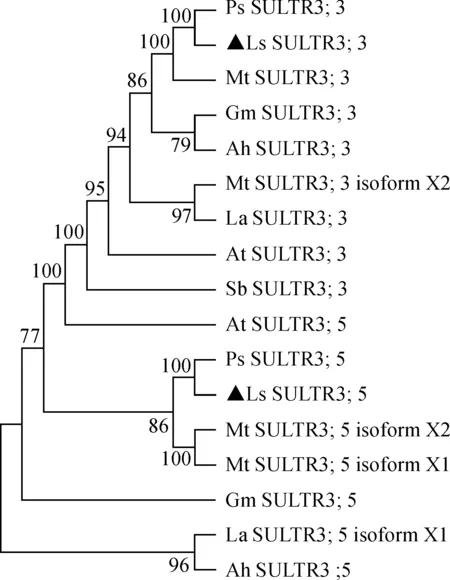
黑色三角形为LsSULTR3;3和LsSULTR3;5蛋白图2 硫酸盐转运蛋白SULTR3;3和SULTR3;5系统发育树Black triangle represents LsSULTR3;3 and LsSULTR3;5 Fig.2 Phylogeny of SULTR3;3 and SULTR3;5 proteins
采用SignalP 4.0分析表明,LsSULTR3;3和LsSULTR3;5均为分泌蛋白;采用WoLF PSORT分析表明,LsSULTR3;3定位于质膜、液泡和内质网,LsSULTR3;5定位于质膜。采用TMHMM预测蛋白质的跨膜结构域显示,LsSULTR3;3有9个跨膜结构(transmebrane domains,TMDs),跨膜区段分别为104-126、160-182、195-212、242-264、269-291、362-384、397-416、426-448和455-477位氨基酸。LsSULTR3;5有11个TMDs,跨膜区段分别为73-95、115-137、158-180、190-212、235-253、263-285、320-342、357-379、392-414、418-435、455-477位氨基酸。拓扑结构表明,LsSULTR3;3和LsSULTR3;5蛋白N端位于质膜内,C端位于质膜外(图3)。
运用在线软件SOPMA进行二级结构预测显示,在LsSULTR3;3蛋白中,β-螺旋50.23%、无规卷曲30.93%、β-转角3.98%、延伸链14.85%;在LsSULTR3;5蛋白中,α-螺旋49.06%、无规卷曲31.56%、β-转角4.22%、延伸链15.16%。说明α-螺旋和无规卷曲是LsSULTR3;3和LsSULTR3;5蛋白二级结构的主要元件。
采用SWISS-MODEL预测LsSULTR3;3 和LsSULTR3;5三维结构表明,LsSULTR3;3和LsSULTR3;5蛋白三维结构相似,均可形成同源二聚体。LsSULTR3;3和LsSULTR3;5具有两个明显的结构域,其中N端主要由α-螺旋围绕形成通道进行硫酸盐的跨膜转运,C端为STAS结构域。
2.2.4 蛋白磷酸化位点分析利用NetPhos3.1 Server预测蛋白磷酸化位点表明,LsSULTR3;3和LsSULTR3;5具有多个潜在的磷酸化位点,可被PKA、PKC、cdc2、CKII、DNAPK等多个蛋白激酶磷酸化(图4)。其中,LsSULTR3;3有101个潜在的磷酸化位点,预测得分大于0.5的有51个位点,包括32个Ser、16个Thr、3个Tyr。LsSULTR3;5有109个潜在的磷酸化位点,预测得分大于0.5的有60个位点,包括34个Ser、20个Thr、6个Tyr(图4)。
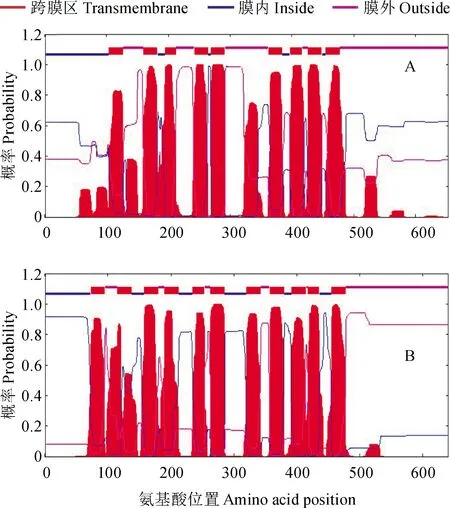
图3 LsSULTR3;3(A)和LsSULTR3;5(B)跨膜结构域预测Fig.3 Prediction of transmembrane domains of LsSULTR3;3 (A) and LsSULTR3;5(B)
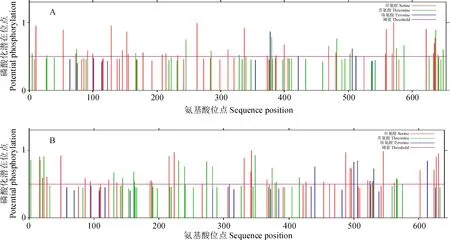
图4 LsSULTR3;3(A)和LsSULTR3;5(B)磷酸化位点预测Fig.4 Phosphorylation sites prediction of LsSULTR3;3 (A) and LsSULTR3;5 (B)

表3 LsSULTR3;3和LsSULTR3;5的启动子顺式作用元件分析
2.2.5 启动子顺式元件分析以LsSULTR3;3和LsSULTR3;5基因起始密码子(ATG)上游2 000 bp作为启动子区段,用在线软件PlantCare预测启动子顺式作用元件。结果表明,LsSULTR3;3和LsSULTR3;5启动子除了含有真核生物启动子基本元件CAAT-box、TATA-box等以外,还含有ABRE等脱落酸响应元件、干旱响应MYB结合位点MBS等干旱胁迫响应元件、GARE-motif等赤霉素响应元件、AuxRR-core等生长素响应元件及AAAC-motif等多种光响应元件等(表3)。
2.3 LsSULTR3;3和LsSULTR3;5基因克隆和组织表达分析
以山黧豆25DAS成熟叶片的cDNA为模板,以LsSULTR3;3和LsSULTR3;5基因特异引物进行PCR扩增,分别获得1 962 bp和1 923 bp的目的条带(图5)。经测序后和转录组数据比对表明,所获序列为LsSULTR3;3和LsSULTR3;5基因的CDS序列。
利用半定量RT-PCR分析LsSULTR3;3和LsSULTR3;5基因在山黧豆不同组织中的表达,结果显示,LsSULTR3;3和LsSULTR3;5的组织表达水平存在明显差异。LsSULTR3;3在主根、成熟叶、茎、花、S2时期种子和S6时期种子中表达,以在茎中的表达量较高;LsSULTR3;5在主根、侧根、花、S2时期种子中均有表达,以花中的表达量最为显著(图6)。
3 讨 论
拟南芥中的研究表明,AtSULTR3调控硫酸盐向叶绿体的转运,影响Cys和ABA的生物合成,并参与硫酸盐介导的气孔关闭[17];AtSULTR3;5在根部的维管组织中高度表达,本身不具有硫酸盐转运功能,但是能够显著促进SULTR2;1的转运效率[18]。在山黧豆中,至少有13条SULTR基因,分别编码SULTR Ⅰ-Ⅳ。其中,LsSULTR3;3和LsSULTR3;5可能与山黧豆活性物质-ODAP的生物合成密切相关。蛋白结构预测分析表明,LsSULTR3;3和LsSULTR3;5具有SULTR蛋白家族保守结构域STAS和Sulfate_transp[13]。包含胞质跨膜结构域TMDs说明LsSULTR3;3和LsSULTR3;5可能参与硫酸盐的跨膜转运,进而进行硫的同化作用,调控Cys及β-ODAP含量。
蛋白水平、翻译后修饰水平等调控是植物硫代谢、Cys及β-ODAP代谢调控的重要方式[19]。例如,硫代谢调控关键酶丝氨酸乙酰基转移酶(serine acetyltransferase,SAT)和半胱氨酸合成酶[cysteine synthase,CS;或 O-acetylserine (thiol)lyase,OAS-TL]或其家族成员β-腈基丙氨酸合成酶(β-cyanoalanine synthase,CAS)可以通过形成半胱氨酸调控复合物(cysteine regulatory complex,CRC)调控二者酶活性[20-21]。而SAT的磷酸化会降低Cys对SAT酶活性的反馈抑制程度[21-22]。对SULTR而言,AtSULTR1;2 蛋白STAS结构域和CS的结合可以增加CS酶活性[23]。在山黧豆中,LsSULTR3;3和LsSULTR3;5可能以同源二聚体方式发挥活性。磷酸化位点预测则表明,LsSULTR3;3和LsSULTR3;5具有PKA、PKC等多个蛋白激酶磷酸化作用的潜在位点,可能通过磷酸化/去磷酸化调控硫酸盐转运活力。针对拟南芥SULTR保守结构域 STAS磷酸化位点的研究也证实了该结论[24-27]。
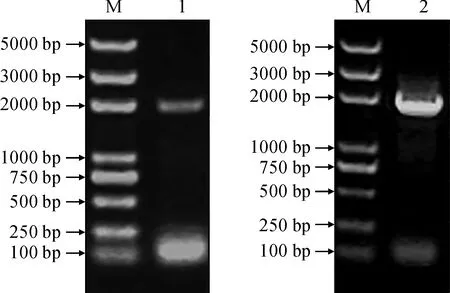
M.DNA 标准分子质量;1.LsSULTR3;3;2.LsSULTR3;5图5 LsSULTR3;3和LsSULTR3;5基因的CDS序列克隆M.DNA marker;1.LsSULTR3;3;2.LsSULTR3;5Fig.5 Cloning of coding sequences of LsSULTR3;3 and LsSULTR3;5
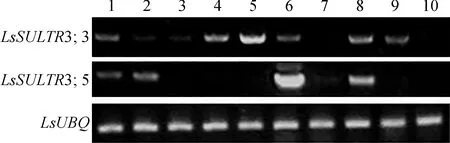
1.主根;2.侧根;3.幼叶;4.成熟叶;5.茎;6.花;7.荚;8.S2时期种子;9.S6时期种子;10.S8时期种子图6 山黧豆不同组织中LsSULTR3;3和LsSULTR3;5的相对表达分析1. Main root; 2. Lateral root; 3. Young leaf; 4. Old leaf; 5. Stem; 6. Flower; 7. Pod; 8. Seed of S2 stage; 9. Seed of S6 stage; 10. Seed of S8 stageFig.6 Expression analysis of LsSULTR3;3 and LsSULTR3;5 in different tissues of L. sativus
硫的同化途径还受到植物激素信号及转录因子等的调控。缺硫条件导致生长素、茉莉酸(jasmonic acid,JA)水平及其合成基因上调[28-29],JA处理上调硫同化通路和GSH合成相关基因表达水平[30-31],这表明了生长素信号、JA信号通路和硫同化通路的交互作用[28,32]。细胞分裂素也可以显著下调SULTR1;2表达水平[33]。LsSULTR3;3和LsSULTR3;5基因启动子含有激素响应等多个顺式作用元件,这表明山黧豆硫同化途径及β-ODAP可能受到多种激素的交互调控。此外,LsSULTR3;3和LsSULTR3;5基因启动子还具有转录因子MYB的结合位点MBS,说明转录因子MYB可能调控山黧豆硫同化途径。实际上,MYB-like 转录因子PHR1(phosphate starvation response 1)可以调节N、P、S、Fe和Zn的平衡[34];而N、P、S、Fe和Zn等均可以影响山黧豆β-ODAP含量[35]。因此,MYB可能在山黧豆β-ODAP含量调控中起到重要作用。
综上所述,山黧豆至少含有13条SULTR基因,分别编码SULTRⅠ-Ⅳ。其中,LsSULTR3;3和LsSULTR3;5编码蛋白具有SULTR蛋白家族保守结构域STAS和Sulfate_transp,其表达水平可能与山黧豆活性物质β-ODAP的生物合成密切相关。生物信息学预测显示,LsSULTR3;3和LsSULTR3;5活性受到转录因子MYB和激素响应等多个顺式作用元件的共同调节,蛋白水平互作及磷酸化等翻译后修饰也在该过程起到重要作用。上述结果为进一步研究山黧豆中硫酸盐的吸收、转运及同化、β-ODAP的生物合成途径等奠定了基础。
