酸枣果提取物在体内外对抗生素的增效作用及机制研究
2022-01-14林金水高倩倩裴永福成娟丽张向前
林金水,张 恒,高倩倩,王 凤,裴永福,成娟丽*,张向前
(1 陕西省红枣重点实验室[延安大学],陕西延安 716000;2 延安大学 生命科学学院,陕西延安 716000)
抗生素的发现揭开了人类与病原菌战争的历史,并被视为现代临床医学的支柱,然而随着病原菌对抗生素耐药性的出现,这场战争胜利的天平慢慢倾向病原菌,对人类健康构成了严重威胁[1],而2016年的联合国首脑会议承诺将共同努力遏制耐药菌的蔓延则更进一步说明了这个问题的严重性[1]。威胁人类健康的病原菌主要来自于粪肠球菌(Enterococcusfaecalis)、金黄色葡萄球菌(Staphylococcusaureus)、肺炎克雷伯菌(Klebsiellapneumoniae)、鲍曼不动杆菌(Acinetobacterbaumannii)、铜绿假单胞菌(Pseudomonasaeruginosa)、肠杆菌属(Enterobacterspp.)和大肠杆菌(Escherichiacoli)的耐药菌株,它们被合并简称为“ESKAPEE”病原体[1],具有多重耐药性、泛耐药性甚至全耐药性[2-4]。而新型抗生素来源的枯竭使目前的形势更加恶化[1,5]。这就要求我们另辟蹊径,采用新的策略来解决这个问题。药用植物和芳香植物被誉为生物活性化合物的储藏库,其提取物是解决病原菌耐药性的有效途径之一[1, 6-8]。这种植物提取物可以分为两类,一是自身具有抗耐药菌的作用,如蜀葵、山月桂、百里香和五味子等的活性提取成分对耐药菌有良好的杀菌活性[9-10];二是本身抗菌活性不明显,但具有显著增强抗生素疗效的作用,即抗菌增效作用[11-13]。例如,存在于萝芙木属植物中的吲哚类生物碱成分——利血平可通过抑制细菌细胞的Bmr外排泵来增强四环素杀菌活性[14];来源于黄连的黄连素和诺氟沙星联合使用时,可通过抑制细菌细胞的外排泵NorA而增强诺氟沙星的杀菌作用[13];当马齿苋的乙醇提取物和野青树叶子的丙酮提取物或者氯仿提取物分别与红霉素联合使用时,都能显著增强红霉素对耐药菌的杀菌能力[15-16]。此外,植物源活性提取物还可通过调节宿主的免疫能力来抵抗耐药菌的感染,它可影响伤口愈合过程的各个阶段,包括凝血、炎症、纤维增生、上皮的形成、胶原化和伤口收缩等[17-18]。例如,南非植物马拉马豆中的多酚可以抑制耐药菌的感染和促进伤口愈合[19];从谷物中提取的β-葡聚糖类具有潜在的抗感染、促进伤口愈合和免疫调节特性[20]。因此,植物提取物是抗耐药菌活性成分重要来源之一。
酸枣[ZiziphusjujubaMill. var.spinosa(Bunge) Hu ex H. F. Chow]是鼠李科枣属植物,酸枣果作为重要食品和/或传统药物具有悠久的历史。研究表明酸枣果含有大量的生物活性化合物,如抗坏血酸、三萜酸、酚酸、氨基酸、皂苷、α-生育酚、生物碱、胡萝卜素、脑苷脂、黄酮类化合物、多糖和矿物质成分[21]。虽然这些活性成分具有广泛的药理作用,如能够增强免疫功能、抗氧化、抗炎、抗衰老、抗肥胖、抗肿瘤、抗糖尿病、护肝、抗癌和胃肠道保护等作用[22-25]。然而对于酸枣果在抗菌作用方面的关注较少。多数报道红枣及其他品种的枣果具有抗菌作用。如来自伊朗的红枣果乙醇提取物对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、白色念珠菌和烟曲霉具有广谱的抗菌活性[26];来自于阿尔及利亚莲枣果的甲醇提取物对金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌显示出抗菌活性[27];以及来自于叙利亚莲枣果的石油醚提取物对枯草芽孢杆菌、化脓性链球菌和大肠杆菌具有明显的抑制作用[28]。而酸枣果方面仅有孙延芳等报道,分离自酸枣果的三萜皂苷具有广谱的抗菌作用[29]。以上的研究表明枣果中普遍含有抗菌成分,而对酸枣果抗菌功能成分的研究还有待于进一步加强。
我们先前研究显示,酸枣果的氯仿提取物具有广谱的抗菌增效作用,并从该氯仿提取物中进一步精制得到其低极性范围的活性组合物Fr.2a[28],发现Fr.2a不仅与多种抗生素联用显示出广泛的协同抗菌作用,而且呈剂量依赖性地促进微生物生物膜的形成,降低微生物的运动性和显著抑制牛奶中微生物的生长[28]。然而,由于Fr.2a的活性不及氯仿提取物,因此我们推测酸枣果氯仿提取物中其他极性范围内的物质可能也具有抗菌增效活性。本研究在Fr.2a的基础上,进一步对酸枣果氯仿提取物中其他极性范围的抗菌増效活性物质进行分离纯化,对分离到的活性物质进行组成成分鉴定、抗菌增效活性评价、抗菌增效机制研究,并探讨其在制备抗皮肤耐药菌感染药物中的应用,旨在为酸枣果药用产品的开发提供指导。
1 材料和方法
1.1 材料和试剂
1.1.1 主要材料酸枣果氯仿提取物(先前实验制备[28]);铜绿假单胞菌(PseudomonasaeruginosaATCC27853)、大肠杆菌(EscherichiacoliATCC15294)、粪肠球菌(EnterococcusfaecalisATCC29212)和白色念珠菌[MoniliaalbicanCMCC(F)98001]由延安大学附属医院提供,耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus, MRSA)由西安交通大学基础医学院提供;昆明小鼠(Km)购自西安科奥生物有限公司。
1.1.2 主要培养基(1)LB培养基:NaCl 10 g/L、酵母提取物 5 g/L、胰蛋白胨 10 g/L、琼脂粉 15 g/L,pH调至7.2,121 ℃灭菌20 min。(2)YPDA培养基:蛋白胨 20 g/L、酵母提取物 10 g/L、葡萄糖 20 g/L、腺嘌呤 0.03 g/L,pH调至6.5,115 ℃灭菌30 min。(3)高盐甘露糖培养基:NaCl 75 g/L、蛋白胨10 g/L、D-甘露糖 10 g/L、牛肉膏 1 g/L、0.25% 酚红、琼脂粉 15 g/L,pH调至7.4,121 ℃灭菌20 min。
1.1.3 主要试剂胰蛋白胨、酵母提取物、TSB培养基均购自OXOID;无水乙醇、乙酸乙酯、氯仿、甲醇、石油醚均购自天津市致远化学试剂有限公司;腺嘌呤、琼脂粉、庆大霉素(Gentamicin Gm)、妥布霉素(Tobramycin Tob)、氨苄青霉素(Ampicillin Amp)、氯霉素(Chloramphenicol Cm)、红霉素(Erythromycin Em)、夫西地酸(Fusidic acid Fa)、制霉菌素(Nystatin Ns)、酮康唑(Ketoconazole Kcz)、两性霉素B(Amphotericin B Am B)购自北京索莱宝科技有限公司;碱性磷酸酶试剂盒购自南京建成生物工程研究所;红霉素软膏购自于新和成控股集团有限公司;莫匹罗星软膏购自中美天津史克制药有限公司;夫西地酸软膏购自香港澳美制药厂有限公司。
1.2 试验方法
1.2.1 酸枣果氯仿提取物的分离纯化及组分鉴定酸枣果氯仿提取物的制备过程按先前描述的方法执行[28]。将得到的酸枣果氯仿提取物通过硅胶柱层析技术进行分离纯化,并利用GC-MS、核磁共振氢谱、红外光谱对分离到的活性组分进行组成成分分析,酸枣果氯仿提取物的分离纯化流程见图1。称取260 g 200~300目硅胶作为柱填料,用石油醚湿法装入内径为95 mm的色谱柱中,取5 g酸枣果氯仿提取物,用氯仿溶解后与95 g 100~200目的硅胶混匀,蒸干氯仿后,加石油醚湿法上样;用石油醚、石油醚∶乙酸乙酯=100∶1、石油醚∶乙酸乙酯=10∶1、石油醚∶乙酸乙酯=1∶1、石油醚∶乙酸乙酯=1∶10、石油醚∶乙酸乙酯=1∶50、石油醚∶乙酸乙酯=1∶100、石油醚∶乙酸乙酯=1∶200、乙酸乙酯、甲醇依次洗脱,分别收集各部分洗脱相各200 mL。依次分别命名为Fr.1A、Fr.1B、Fr.1C、Fr.1D、Fr.1E、Fr.1F、Fr.1G、Fr.1H、Fr.1I、Fr.1J,旋转蒸发浓缩后,45 ℃真空干燥洗脱液,低温下保存。各组分抑菌试验结果显示抗菌増效活性成分仅存在于Fr.1G和Fr.1H。因此将 Fr.1G和Fr.1H合并且命名为Fr.A并进一步对Fr.A进行分离纯化。称取90 g 200~300目硅胶作为柱填料,用石油醚湿法装入内径为47 mm的色谱柱中,将样品Fr.A用乙酸乙酯充分溶解后与20 g 100~200目的硅胶混匀,蒸干乙酸乙酯后,加石油醚湿法上样;用石油醚,石油醚∶乙酸乙酯=100∶1、石油醚∶乙酸乙酯=10∶1、石油醚∶乙酸乙酯=1∶1、石油醚∶乙酸乙酯=1∶10、石油醚∶乙酸乙酯=1∶50、石油醚∶乙酸乙酯=1∶100、石油醚∶乙酸乙酯=1∶200、乙酸乙酯、甲醇依次洗脱,分别收集各洗脱相各100 mL。依次分别命名Fr.2A、Fr.2B、Fr.2C、Fr.2D、Fr.2E、Fr.2F、Fr.2G、Fr.2H、Fr.2I、Fr.2J,旋转蒸发浓缩后,45 ℃真空干燥洗脱液,并在低温保存。各组分抑菌试验结果显示抗菌増效活性成分仅存在于Fr.2D和Fr.2E中,故将Fr.2D和Fr.2E合并命名为Fr.B。由于继续对Fr.B进行分离纯化后得到的分离组分均无活性,因此无法对Fr.B继续进行柱色谱分离,故确定Fr.B组分为抗菌增效活性精制物。将Fr.B送上海圭谱化工科技有限公司进行GC-MS、核磁共振氢谱和红外光谱分析检测。
1.2.2 酸枣果氯仿提取物分离过程中各组分的活性评价方法将过夜培养的供试菌株稀释至1×106CFU/mL;经过柱层析分离后得到的分离组分,使用无水乙醇溶解并分别配制成浓度为2 560、1 280、640、400、320、200、160、100、80、50、40、20、1、0.55和0.25 mg/mL的母液。以最大溶解度配制庆大霉素(Gm)、妥布霉素(Tob)、氨苄青霉素(Amp)、氯霉素(Cm)、红霉素(Em)、夫西地酸(Fa)、制霉菌素(Ns)、酮康唑(Kcz)和两性霉素B(Am B)的母液,其中Em、Cm、Kcz用无水乙醇配制,Fa、Am B用DMSO配制,其他抗生素用无菌水配制,使用培养基将配置好的各种抗生素分别均稀释至浓度为4 096 μg/mL的母液,过滤除菌后备用。使用一次性无菌96孔板进行药敏实验。对于单独药敏实验,先向96孔板中每个孔加入100 μL LB或YPDA培养基,在第一个孔内加入100 μL浓度为4 096 μg/mL的抗生素,混匀后再从中吸出100 μL到第二个孔内,依次类推,使抗生素终浓度依次稀释2倍,再向每孔中加入100 μL 浓度为1×106CFU/mL的菌液(由于各分离组分的水溶性较差,单独药敏实验时先向96孔板中每孔加入100 μL LB或YPDA培养基,再向每孔中加入100 μL 浓度为1×106CFU/mL菌液,然后直接向每孔中加入10 μL各分离组分的不同浓度母液)。对于联合药敏实验,在单独药敏实验的基础之上再在每孔中加入10 μL处理好的组分。设立阳性对照为100 μL菌液加100 μL培养基,阴性对照为200 μL培养基(实验中加入的无水乙醇不影响微生物的生长及抗生素对微生物的抑制作用)。将96孔板放置于37 ℃培养箱中培养24 h,观察结果。用“-”表示阴性,孔清亮,用“+”表示阳性,孔混浊。MIC为能够抑制微生物生长、繁殖的最低药物浓度,即用肉眼观察,无微生物生长的药物最低浓度孔。FIC[28]是指在2种或多种药物同时使用的情况下,各种药物的联合用药时的最小抑菌浓度(MIC)与单独用药时的MIC的比值之和。FIC≤0.5认为药物之间具有协同作用;FIC在0.5~4.0之间则认为药物之间无相关作用;FIC>4.0则认为药物之间具有拮抗作用。
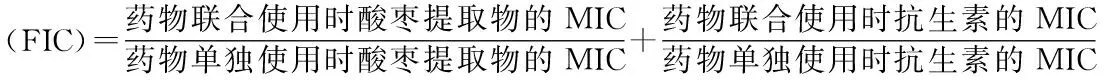
1.2.3 时间-杀伤曲线测定时间-杀伤曲线实验改进自先前描述的方法[30]。挑取单菌落于新鲜液体培养基中(MRSA用LB液体培养基培养,白色念珠菌用YPDA液体培养基培养),37 ℃、200 r/min过夜培养。按1∶100的比例转接入新的液体培养基中,培养至OD600为0.6,使用新鲜液体培养基稀释菌液,使其菌液最终浓度为2.0×105CFU/mL,分别加入抗生素溶液,使得抗生素终浓度为Tob =64 μg/mL、Amp=256 μg/mL、Em=256 μg/mL、Cm=8 μg/mL、Gm=64 μg/mL、Fa=0.125 μg/mL、Kcz=4 μg/mL和Am B=1 μg/mL(此浓度为相应抗生素对MRSA或白色念珠菌的MIC)或者加入含有相同浓度的抗生素与终浓度5 mg/mL的Fr.B混合溶液,37 ℃、200 r/min摇床中培养。每隔1 h取样100 μL,依次十倍稀释涂布于LB或YPDA平板上,进行菌落计数,实验设3个生物学重复。绘制时间-杀伤曲线曲线:y轴为微生物菌数CFU/mL,x轴为间隔1 h的时间。
1.2.4 Fr.B对MRSA菌株细胞壁通透性的影响细胞壁通透性实验改进自先前描述的方法[31]。挑取MRSA单菌落置新鲜LB液体培养基中,37 ℃、200 r/min培养过夜。将MRSA菌液按1∶100的比例转接入新的LB液体培养基中,待培养至OD600=0.6时分别设置加入终浓度为5 mg/mL Fr.B、1%红霉素(Em)和5 mg/mL Fr.B+1% Em等3种处理,加入无水乙醇作为空白对照组。每组实验设3个平行重复。37 ℃、120 r/min摇床中培养,每隔2 h取样,4 500 r/min离心10 min,取上清,即为待测液。按南京建成生物工程研究所的碱性磷酸酶试剂盒操作步骤进行碱性磷酸酶酶活测定。
1.2.5 Fr.B对MRSA菌株培养液中电导率和核酸大分子含量的影响电导率和核酸大分子含量的测定实验改进自先前描述的方法[32-33]。挑取MRSA单菌落于新鲜LB液体培养基中,37 ℃、200 r/min培养过夜。将MRSA按1∶100的比例转接入新鲜的LB液体培养基中,当培养至OD600为0.8时,4 500 r/min离心10 min收集细胞。将收集的细胞用PBS缓冲液洗涤2次,最终用PBS悬浮并使菌液的浓度为1.0×107CFU/mL,设置加入终浓度为5 mg/mL Fr.B、1% 红霉素(Em)和5 mg/mL Fr.B+1% Em等3种处理,以无水乙醇为空白对照组。37 ℃、120 r/min培养,每隔2 h取样,4 000 r/min离心10 min,取上清,即为待测液。用5%葡萄糖将上清液稀释20倍后,测定其电导率,实验重复3次,取平均值。用酶标仪于260 nm下测定上清液中核酸大分子的吸光值,重复3次,取平均值。
1.2.6 红霉素+Fr.B最佳配比的筛选将终浓度1%、0.1%、0.01%、0.05%、0.04%、0.03%、0.02%与0.01% 的红霉素和终浓度5 mg/mL的Fr.B单独或者联合使用,对MRSA菌株进行时间-杀伤曲线的测定,从中筛选出Fr.B与红霉素最合适的配比。
1.2.7 软膏的制备及软膏体内活性检测红霉素软膏购自于新和成控股集团有限公司,主要成分为1%红霉素及辅料(凡士林和液体石蜡)。软膏制备:(1)药物联用软膏的制备:称取21 g凡士林、8 g液体石蜡,水浴加热约至60 ℃,使基质完全熔化,并搅拌均匀。称取1 g红霉素溶于1 mL的无水乙醇中,称取0.5 g Fr.B溶于1 mL的无水乙醇中,各准备2份,备用。在50 ℃时,向基质中分别加入配制好的Fr.B溶液或Fr.B+红霉素溶液,使其红霉素浓度为1%,Fr.B浓度为0.5%,顺时针搅拌至均匀,同时将混合体系温度降至室温。以基质作为空白对照,基质中加入Fr.B溶液的命名为Fr.B软膏,基质中加入红霉素+Fr.B混合物溶液的命名为“抗霸”软膏。将配制好的软膏分装。(2)单一药物软膏的制备及混用:称取0.5 g Fr.B溶于1 mL的无水乙醇中,备用。称取21 g凡士林、8 g液体石蜡,水浴加热约至60 ℃,使基质完全熔化、并搅拌均匀。在50 ℃时,向基质中加入配制好的Fr.B溶液,使得Fr.B浓度为1%,顺时针搅拌至均匀,同时将混合体系温度降至室温,分装,得到1%的Fr.B软膏。称取21 g凡士林、8 g液体石蜡,水浴加热约至60 ℃,使基质完全熔化、并搅拌均匀。将市场销售的1% 红霉素软膏与基质1∶9混合,待基质降温凝固,配制成0.1% 红霉素软膏,分装。使用时将上述不同软膏按1∶1比例混合,配制成基质+1% 红霉素软膏(含终浓度为0.5% 的Em)、基质+0.1% 红霉素软膏(含终浓度为0.05% 的Em)、 Fr.B软膏+1% 红霉素软膏(含终浓度为0.5% 的Fr.B+0.5%的Em)、Fr.B软膏+0.1% 红霉素软膏(含终浓度为0.5% 的Fr.B+0.05%的Em)。
软膏的体内活性检测:体内动物实验研究获得延安大学实验动物科技中心批准,所有动物实验程序均按照中国国家卫生研究院实验室动物护理原则的指南进行。
1) 伤口感染模型建立 用昆明小鼠(Km)作为实验动物,选取体重为25~27 g的小鼠,针对药物联用软膏的处理分为8组,分别为无伤口组、伤口无感染组、伤口感染组(空白对照组)、红霉素软膏组(含终浓度为1% 的Em)、抗霸软膏组(含终浓度为0.5% 的Fr.B+1%的Em)、Fr.B软膏组(含终浓度为0.5%的Fr.B)、夫西地酸软膏组(含终浓度为2%的Fa)、莫匹罗星软膏组(含终浓度为2%的Mu)(每个实验每组6只小鼠);针对单一药物软膏混用的处理分为7组,分别为基质组(空白对照)、红霉素软膏组(含终浓度为1% 的Em)、基质+1% 红霉素软膏(含终浓度为0.5% 的Em)、基质+0.1% 红霉素软膏(含终浓度为0.05% 的Em)、Fr.B软膏组(含终浓度为0.5%的Fr.B)、Fr.B软膏+1% 红霉素软膏(含终浓度为0.5% 的Fr.B+0.5%的Em)、Fr.B软膏组+0.1%红霉素软膏(含终浓度为0.5% 的Fr.B+0.05%的Em)(每个实验每组6只小鼠),饲养2周,让小鼠适应环境。制备MRSA菌悬液:将培养至OD600=0.6时MRSA菌液,4 000 r/min离心10 min收集细胞,在PBS中洗涤2次后用PBS重新悬浮细胞并稀释至1.0×106CFU/mL个细胞,备用。小鼠感染模型建立:使用乙醚轻微麻醉小鼠,皮下注射5%的水合氯醛(250 μL/20 g),待小鼠完全昏迷后,对小鼠背部进行剃毛,再使用6 %的硫化钠彻底脱毛。使用镊子夹取少量皮肤,用剪刀剪出伤口(10 mm×10 mm)。接着皮下注射0.8 mL的葡萄糖,以维持小鼠生命体征。最后将制备好的MRSA细胞悬浮液淋洒至小鼠伤口处,接触感染2 h,建立感染模型,对小鼠伤口进行拍照记录。
2) 动物局部治疗 细菌接触小鼠伤口感染2 h后,感染模型建立成功。接下来对小鼠进行初步治疗,除无伤口组,伤口无感染组不给予任何治疗外,给其他每组小鼠伤口涂抹0.1 g相应的软膏,每天涂抹2次相应药物至小鼠伤口处,连续涂抹5 d,并每天观察记录小鼠生命体征。
3) 指标测定 小鼠体重监测:每天观察并对小鼠进行称重,用于评价建立的小鼠模型。伤口组织菌落计数:小鼠连续给药4 d后,对部分小鼠安乐死,用无菌剪刀剪取伤口处皮肤组织,称重,将其悬浮在400 μL PBS中并搞碎成匀浆,采用连续十倍稀释法稀释匀浆液,涂布至高盐甘露糖培养基(金黄色葡萄球菌的选择性培养基)上,37 ℃培养箱培养48 h,菌落计数。评估伤口愈合情况:监测小鼠伤口愈合情况,分别在第0、2、6、10天拍摄小鼠伤口的照片,并用ImageJ软件测量小鼠伤口面积的大小。第0天的伤口面积被认为是100%,每只小鼠的伤口面积被测量、记录并计算伤口面积占第0天伤口面积的百分比。
1.3 统计分析
所有实验至少设3个生物学平行并且独立重复2次,所有数据均表示为平均值“±”标准偏差。用Student’s t-test(双尾不配对)对进行显著性分析。用GraphPad Prism version 5.00 软件(GraphPad software Inc.; San Diego,CA,USA)进行统计学分析并作图。P值<0.05代表差异显著。
2 结果与分析
2.1 以抗菌增效活性为导向的酸枣果氯仿提取物的分离纯化及组成成分分析
在Fr.2a的基础上,本研究采取硅胶柱层析技术对氯仿提取物进一步分离纯化。按照图1方法依次洗脱得到了Fr.1A、Fr.1B、Fr.1C、Fr.1D、Fr.1E、Fr.1F、Fr.1G、Fr.1H、Fr.1I与Fr.1J等10个洗脱液,分别对它们进行抗菌增效活性评价。结果表明,其中仅有5 mg/mL的Fr.1G、Fr.1H可使Amp对铜绿假单胞菌的MIC由1 024 μg/mL下降至2 μg/mL,而其他组分均不能增强Amp的抑菌作用。由于单独使用时,Fr.1G、Fr.1H对铜绿假单胞菌的MIC均为128 mg/mL,Amp对铜绿假单胞菌的MIC大于1 024 μg/mL,两者的FIC=5/128+2/1024=0.04<0.5,从而得出Fr.1G、Fr.1H分别与Amp联合使用时均能增强Amp对铜绿假单胞菌的抑制作用,于是将有活性的Fr.1G和Fr.1H合并,并命名为Fr.A。
对Fr.A进行硅胶柱层析分离纯化,按照图1洗脱顺序依次洗脱,分别得到组分Fr.2A、Fr.2B、Fr.2C、Fr.2D、Fr.2E、Fr.2F、Fr.2G、Fr.2H、Fr.2I与Fr.2J,对这些组分依次进行体外抗菌增效活性评价。结果表明,仅有Fr.2D、Fr.2E组分能显著增强Amp对铜绿假单胞菌的抑制作用,10 mg/mL的Fr.2D可使Amp对铜绿假单胞菌的MIC由1 024 μg/mL下降至4 μg/mL。由于单独使用时,Fr.2D对铜绿假单胞菌的MIC为64 mg/mL,而Amp对铜绿假单胞菌的MIC大于1024 μg/mL,由此可得到FIC=10/64+4/1024=0.16<0.5;10 mg/mL的Fr.2E可使Amp对铜绿假单胞菌的MIC由1 024 μg/mL下降至1 μg/mL;由于单独使用时,Fr.2E对铜绿假单胞菌的MIC为64 mg/mL,而Amp对铜绿假单胞菌的MIC大于1 024 μg/mL,由此可得到FIC=10/64+1/1024=0.16<0.5。上述结果表明,Fr.2D和Fr.2E均具有较好的抗菌增效活性,因此将Fr.2D和Fr.2E合并,并命名为Fr.B。由于继续对Fr.B进行分离纯化后得到的分离组分均无活性,因此无法对Fr.B继续进行柱层析分离,故确定Fr.B组分为抗菌增效活性精制物,其产率高达44.86%,同时这也暗示Fr.B的抗菌增效活性可能是多种成分协同起作用的结果。
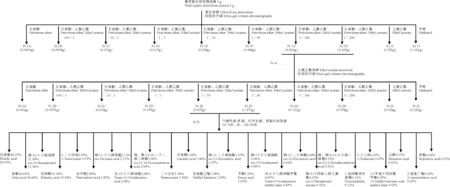
图1 酸枣果氯仿提取物分离纯化流程图Fig.1 Flow chart of separation and purification of chloroform extracts from sour jujube fruit
为了确定Fr.B中包括哪些化学成分,本研究对Fr.B进行GC-MS组分成分分析。经过GC-MS分析可知(图1)Fr.B中主要含有30.07% 反油酸、24.68% 油酸、11.54% 顺-10-十六碳烯醇、10.54% 棕榈酸、3.97% 1-二十四烯、2.89% 岩芹酸、2.12% 顺-11-十八碳烯酸、2.08% 反-13-十八碳烯酸、2.06% 顺, 顺-13, 16二十二碳二烯酸、1.96% 二十五烷、1.44% 亚油酸、1.08% 亚油酸甲酯、1.07% 顺-11-二十碳烯酸、1.05% 芥酸、0.98% 顺-13-十八碳烯醛、0.85% 反-9-十八碳烯酸甲酯、0.64% 顺-11二十烯酸、0.32% 顺-9-十四碳烯-1-醇乙酸酯、0.32% 顺, 顺-9, 12-十六碳二烯酸、0.12% 1-棕榈酸单甘油酯、0.07% 1-十三烯、0.05% 13-甲基十四烷酸甲酯、0.05% 己酸、0.03% 2-氨基丁酸和0.02% 庚酸等化学成分。
为了验证GC-MS分析的结果,对Fr.B进行红外光谱分析(图2,A)和核磁共振氢谱分析(图2,B)。图2,A显示,3 453 cm-1为羟基吸收振动吸收峰,2 923、2 853 cm-1为饱和亚甲基、甲基吸收峰,1 743 cm-1为酯基-COO-吸收峰。1 376、1 456 cm-1为CH(面内)弯曲振动吸收峰,1 688 cm-1为羰基伸缩振动吸收峰,1 158 cm-1为和羧基相连的-CR不对称伸缩振动吸收峰。红外光谱分析的结果说明Fr.B主要由脂肪酸类化合物组成,这与GC-MS分析的结果一致。图2,B显示,化学位移0.5~2.8 ppm为典型的脂肪链甲基亚甲基上的氢,3.8 ppm为甲酯甲氧基上的氢,4.0~4.2 ppm为和氧相连的碳上的氢,包括和羟基相连的亚甲基和次甲基上的氢,5.3 ppm为碳碳双键上的氢,7.1 ppm为氘代试剂的峰,表明Fr.B主要由脂肪酸类化合物组成,这与GC-MS分析的结果一致。红外光谱和核磁共振氢谱分析结果证明,GC-MS分析鉴定出的Fr.B的化学组成成分的结果是可靠的。
2.2 Fr.B的广谱抗菌增效活性及其作用机制分析
前面的研究表明Fr.B能增强Amp对铜绿假单胞菌的抑制作用。为验证Fr.B是否也能增强其他抗生素对细菌、真菌的抗菌作用。本研究将Fr.B与其他抗生素联合使用对多种供试细菌或真菌的体外抗菌增效活性进行评价,结果如表1和表2所示。10 mg/mL Fr.B与庆大霉素(Gm)、妥布霉素(Tob)、氨苄青霉素(Amp)和红霉素(Em)等4种抗生素分别联合使用时,对铜绿假单胞菌和粪肠球菌的FIC均小于0.5,显示出明显的协同抗菌作用(Fr.B对铜绿假单胞菌和粪肠球菌的MIC均为64 mg/mL);对于大肠杆菌(Fr.B对大肠杆菌的MIC为64 mg/mL),10 mg/mL Fr.B与Tob和Em分别联用时显示出协同抗菌作用(FIC均小于0.5);对于耐甲氧西林金黄色葡萄球菌(MRSA)(Fr.B对MRSA的MIC为16 mg/mL),5 mg/mL Fr.B与Gm、Tob、Amp、Em、夫西地酸(Fa)和氯霉素(Cm)分别联用时显示出协同抗菌作用(FIC均小于0.5);对于白色念珠菌(Fr.B对白色念珠菌的MIC为64 mg/mL),5 mg/mL Fr.B与酮康唑(Kcz)和两性霉素B(Am B)分别联用时显示出协同抗菌作用(FIC均小于0.5)。这些结果表明Fr.B显示出广谱抗菌增效活性。
通过联合抑菌试验发现,5 mg/mL的Fr.B能够显著增强多种抗生素对MRSA和白色念珠菌的抑制作用(表1和表2)。为了进一步探究Fr.B的抗菌增效活性,我们通过时间-杀伤曲线来进一步分析Fr.B与抗生素联用对MRSA菌株和白色念珠菌的协同杀菌活性。Fr.B分别与Tob、Fa、Cm、Em、Amp和Gm等抗生素联用时均能显著增强它们对MRSA菌株的杀菌作用,其中对Tob、Fa、Cm、Em和Amp的増效作用尤为明显(图3,A);同样, Fr.B分别与Kcz和Am B联合使用时也均能显著增强它们对白色念珠菌的杀菌活性(图3,B),这与前面联合抑菌试验的结果相一致。这些结果表明Fr.B能协同抗生素增强其对MRSA菌株与白色念珠菌的杀菌作用。
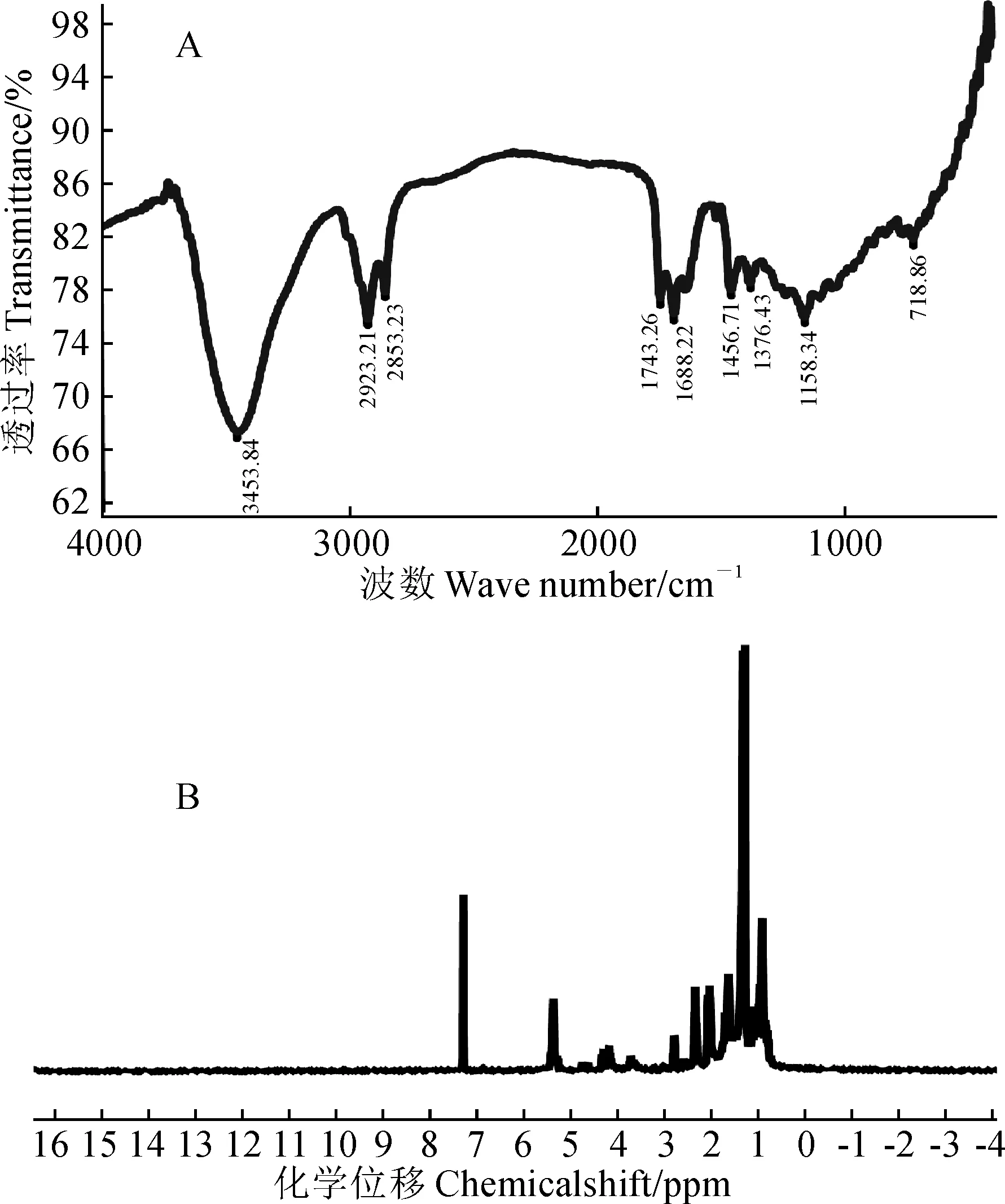
A. Fr.B的红外光谱图;B. Fr.B的核磁共振氢谱图图2 Fr.B的组成成分分析A. Infrared spectrogram of Fr.B; B. Hydrogen NMR spectrogram of Fr.BFig.2 Composition analysis of Fr.B
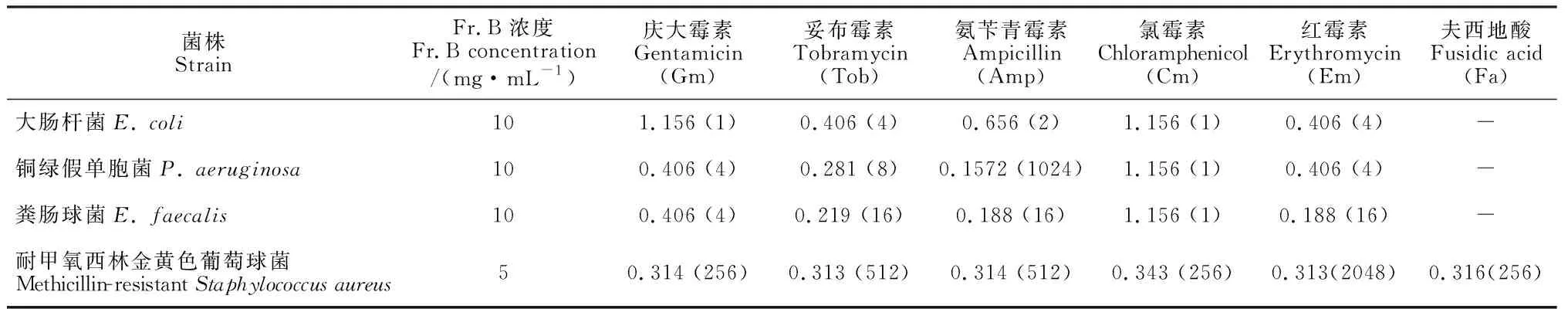
表1 Fr.B与抗生素联合使用时对细菌的联合抑菌指数(FIC)*

表2 Fr.B与抗生素联合使用时对真菌的联合抑菌指数(FIC)*
接着,本研究进一步探究了Fr.B增强抗生素疗效的机制。由于已有研究报道脂肪酸可以引起微生物细胞通透性的变化[34],而我们先前GC-MS的结果显示,Fr.B主要由脂肪酸类化合物组成,因此我们推测Fr.B可能是通过影响细胞的通透性从而起抗菌增效作用。为验证这一假设,本研究检测了Fr.B对MRSA菌株细胞通透性的影响。
碱性磷酸酶(AKP)正常情况下存在于细胞壁和细胞膜之间,当细胞壁通透性增大时,会通过细胞壁流出到培养液中,因此培养液中AKP的活性可以反映细胞壁的通透性。我们通过在细菌培养过程中分别加入不同试剂,以无水乙醇为空白对照,测定不同时间段培养液中AKP的活性,来判断Fr.B对MRSA菌株细胞壁通透性的影响。结果如图4,A所示,与对照组和Em组相比,Fr.B组和Fr.B+Em组中AKP的活性随着时间的延长而逐步增强,并且与Fr.B组相比,Fr.B+Em组AKP活性得到进一步的提高。表明Fr.B可以增强MRSA菌株细胞壁的通透性。
培养液中电导率的大小可以反映细胞膜通透性的变化,而培养液中核酸等大分子物质含量可以反映细胞膜的破损情况。培养液电导率越大,说明细胞膜的通透性越好。培养液中核酸等大分子物质含量越高,说明细胞膜受损越严重。通过向培养液中分别加入不同试剂,以无水乙醇为空白对照,测定培养液中电导率和核酸分子含量。实验结果如图4,B所示,与对照组和Em组相比,Fr.B组和Fr.B+Em组中的电导率显著升高,并且Fr.B+Em的电导率高于Fr.B组,表明Fr.B可以增强细胞膜的通透性。此外,我们还测定了培养液中的核酸含量,结果如图4,C所示,相比对照组和Em组,当加入Fr.B或Fr.B+Em时,培养液中核酸分子含量显著增大。上述结果暗示Fr.B的抗菌增效作用主要是通过破坏细胞膜和细胞壁的完整性,从而增强细胞的通透性来实现的。
2.3 Fr.B与红霉素联用对小鼠伤口感染模型的治疗作用
2.3.1 Fr.B与红霉素联用制成的软膏对小鼠伤口感染模型的治疗作用许多植物源抗菌活性物质在伤口感染中均具有良好的抗菌及促进伤口愈合的作用[17-18]。而上述的试验已经证明了Fr.B具有广谱的抗菌増效作用,因此本研究进一步探究Fr.B与Em联用在伤口感染中是否也具有增强抗菌及促进伤口愈合的作用。首先,本研究以MRSA为供试菌株,通过时间-杀伤曲线试验对Fr.B与Em联用时的有效配比进行了筛选。结果如图5,A所示,5 mg/mL Fr.B、对照组以及单独使用不同浓度的Em组,均对MRSA菌株的生长并未产生影响,说明MRSA菌株对它们完全耐药,而当Fr.B分别与1%、0.1%、0.05%、0.04%、0.03% 的Em联用时,均能显著增强Em对MRSA菌株的杀菌作用,可是更低浓度的Em与Fr.B联用后的抑菌效果却明显减弱。因此,从逆转MRSA耐药性的角度考虑,选定浓度在0.03%以上的红霉素和5 mg/mL的Fr.B联用时均可达到理想的联合杀菌效果。
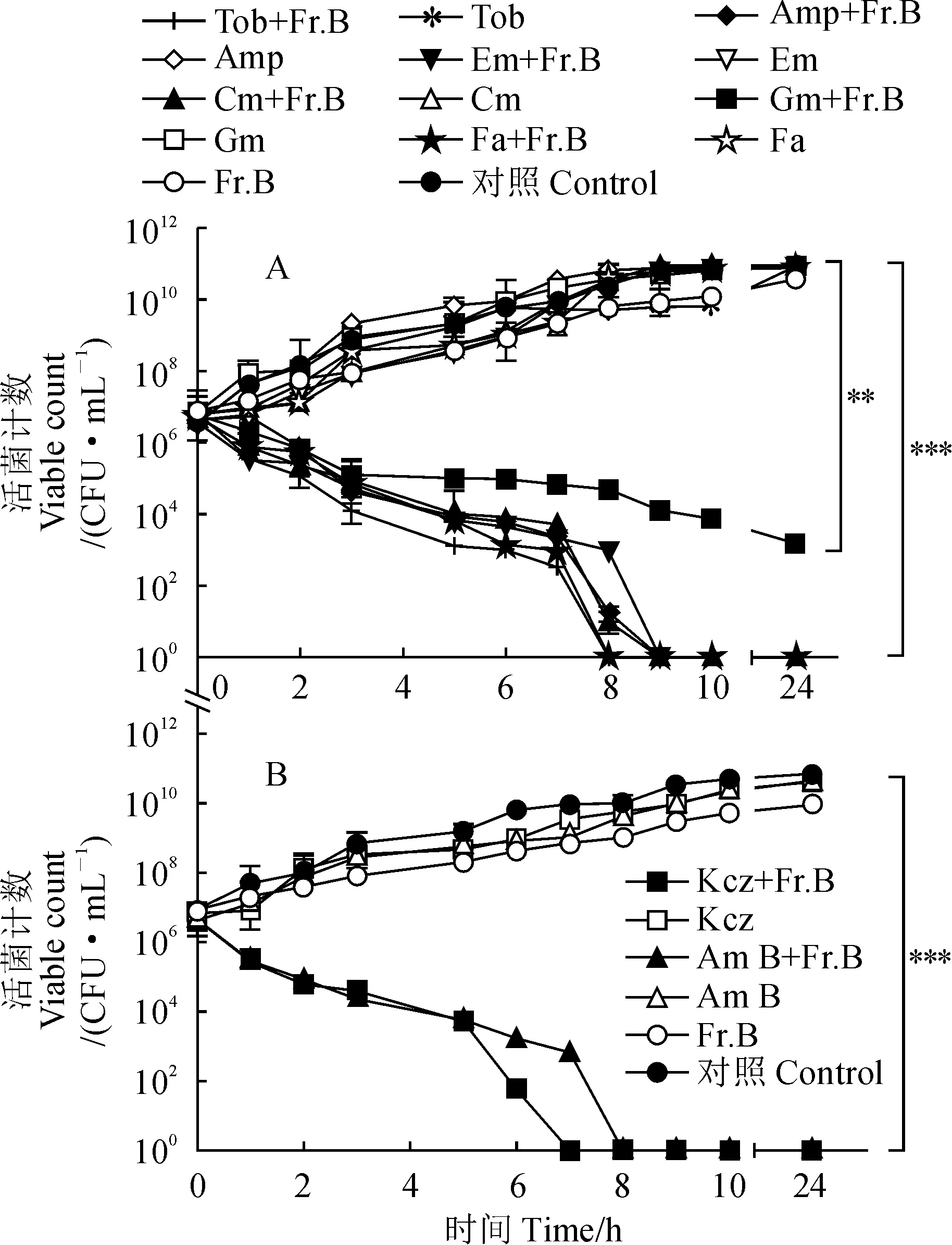
A. Fr.B与6种抗生素联合使用对MRSA生长的影响(Tob.妥布霉素;Amp.氨苄青霉素;Em.红霉素;Cm.氯霉素;Gm.庆大霉素;Fa.夫西地酸); B. Fr.B与2种抗生素联合使用对白色念珠菌生长的影响(Kcz.酮康唑;Am B.两性霉素B;**.P<0.01;***. P<0.001)图3 Fr.B与抗生素联用对MRSA和白色念珠菌生长的影响A. Effect of Fr.B combined with six antibiotics on the growth of MRSA (Tob. Tobramycin; Amp. Ampicillin; Em. Erythromycin; Cm. Chloramphenicol; Gm. Gentamicin; Fa. Fusidic acid); B. Effect of Fr.B combined with two antibiotics on the growth of Candida albicans(Kcz. Ketoconazole; Am B. Amphotericin B, **. P<0.01; ***. P<0.001)Fig.3 Effect of Fr.B combined with antibiotics on the growth of MRSA and Candida albicans
其次,我们以昆明(Km)小鼠为实验动物,以MRSA为感染菌株,建立了小鼠伤口感染模型,通过监测小鼠体重的变化,来判断小鼠伤口感染模型是否建立成功。结果如图5,B所示,伤口感染组小鼠的平均体重显著低于伤口无感染组小鼠的平均体重,表明小鼠伤口感染模型建立成功,保证了后续实验的可靠性。
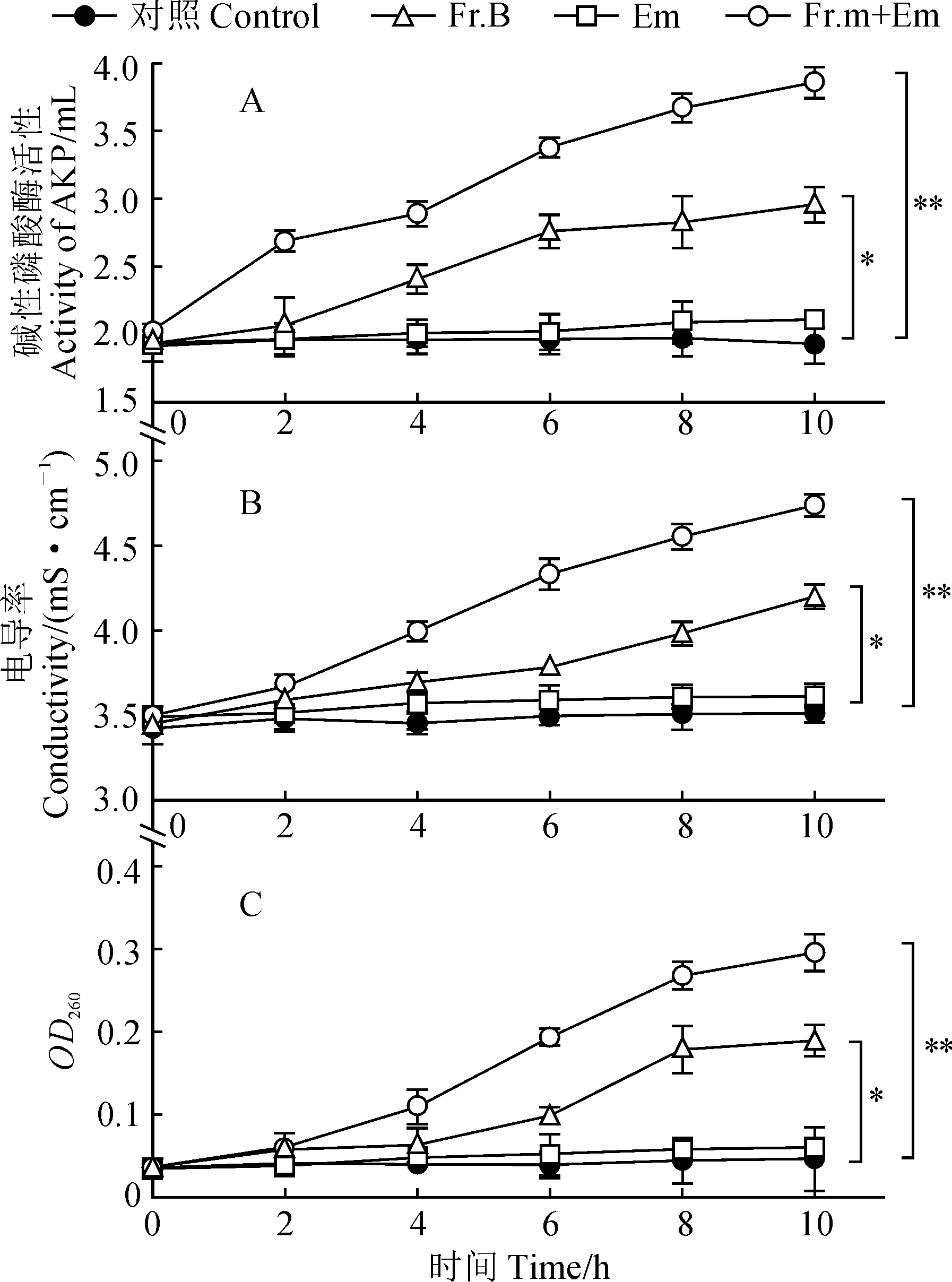
A. Fr.B对MRSA细胞壁通透性的影响;B. Fr.B对MRSA细胞膜通透性的影响;C. Fr.B对MRSA细胞膜完整性的影响。Em.红霉素,*,P<0.05,**,P<0.01图4 Fr.B对MRSA细胞通透性的影响A. Effect of Fr.B on cell wall permeability of MRSA; B. Effect of Fr.B on cell membrane permeability of MRSA; C. Effect of Fr.B on cell membrane integrity of MRSA. Em. Erythromycin, *. P<0.05; **. P<0.01Fig.4 Effect of Fr.B on the cell permeability of MRSA
接着,本研究利用该小鼠伤口感染模型来评估Fr.B与Em联用制成的软膏(命名为抗霸软膏)对MRSA伤口感染的治疗效果。结果如图5,C和5,D所示,小鼠伤口在处理的第2天时,对照组相比于其他组,伤口有明显肿胀的现象,其伤口大小减少至(87.78±26.16)%,同时红霉素软膏组与夫西地酸软膏组伤口也观察到轻微的肿胀现象,使用红霉素软膏的伤口大小减少到(71.59±13.96)%;而夫西地酸软膏对伤口愈合能力相对较好,第2天伤口大小已经降低到(35.56±12.72)%,抗霸软膏组和莫匹罗星软膏组也均能够达到与夫西地酸软膏类似的效果,其伤口大小也分别降低至(36.51±11.90)%和(37.81±12.52)%,不同的是抗霸软膏组和莫匹罗星软膏组的伤口并未发现肿胀现象。另外,虽然Fr.B软膏组伤口大小变化不大,仅减少至(72.11±14.11)%,但是其伤口表面并未发现肿胀的迹象,因此我们推测Fr.B具有消炎作用。小鼠伤口在处理的第6天时,相比空白对照组,红霉素软膏组伤口肿胀得到了轻微的缓解,但伤口大小并未发生明显的变化。而使用夫西地酸软膏治疗的小鼠伤口大小在第6天减少至(17.86±3.30)%,伤口肿胀也得到了缓解。与此同时,抗霸软膏组和莫匹罗星软膏组伤口大小也发生明显的变化,分别减少至(11.90±5.56)%和(14.84±0.96)%。Fr.B软膏组的伤口虽未发生肿胀,但伤口大小仅降低至(58.16±12.87)%。在小鼠治疗的第10天,抗霸软膏组的伤口已经完全愈合,而其他组还存在大小各不相同的伤口,其中空白对照组的伤口依然还存在轻微的肿胀,其伤口大小仍为(32.04±5.93)%,红霉素软膏组的伤口大小为(27.01±7.56)%,夫西地酸软膏组和莫匹罗星软膏组的伤口也均趋于愈合,仅剩(9.20±3.79)%和(1.05±0.48)%。因此,这两种软膏对伤口的愈合能力强于红霉素软膏但弱于抗霸软膏。这些结果表明,抗霸软膏对MRSA伤口感染的治疗效果要显著优于红霉素软膏,与夫西地酸软膏和莫匹罗星软膏相比也有一定的优势。
最后,我们在处理第4天时对小鼠创面进行MRSA的菌落计数。结果如图5,E所示,空白对照组小鼠每克伤口组织的菌落数为4.38×106个;红霉素软膏组伤口显示出肿胀,其每克伤口组织的菌落数相比空白对照组降低幅度不大,为2.60×105个;Fr.B软膏对MRSA菌株本身没有杀菌作用,因为其处理后的每克伤口组织菌落数(1.78×106个)与空白对照组相似;而夫西地酸软膏对伤口中MRSA菌株的杀菌效果与莫匹罗星软膏类似,表现为夫西地酸软膏组和莫匹罗星软膏组每克伤口组织的菌落数分别为1.35×104和1.04×104个,均优于空白对照组。与夫西地酸软膏和莫匹罗星软膏相比,抗霸软膏组则显示出更优秀的对伤口中MRSA菌株的杀菌效果,其处理后的每克伤口组织菌落数仅为4.08×103个,显著低于其他处理组。上述结果表明,Fr.B与红霉素联用能显著增强红霉素对MRSA菌株的抗菌作用,使之获得比夫西地酸和莫匹罗星更好的疗效。
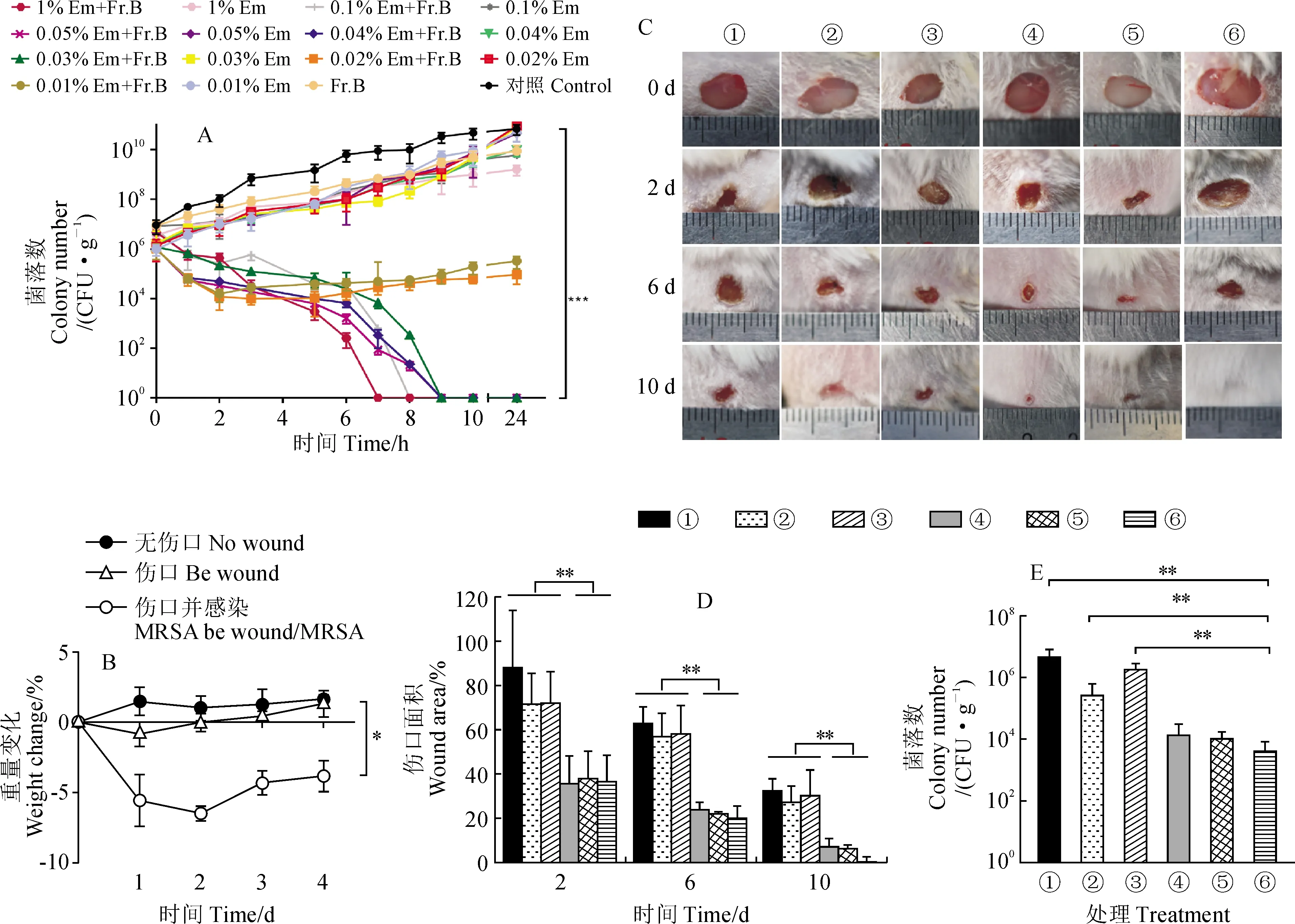
A. Fr.B和红霉素的有效配比筛选;B. 小鼠伤口感染模型的建立;C. 不同时间间隔的小鼠伤口愈合情况(① 空白对照;② 红霉素;③ Fr.B;④ 夫西地酸;⑤ 莫匹罗星;⑥ 抗霸);D. 不同时间点小鼠伤口愈合情况的定量分析结果;E. 不同处理下小鼠创面菌落计数。Em.红霉素,*.P<0.05,**.P<0.01,***.P<0.001图5 Fr.B与红霉素联用制成的软膏对小鼠伤口感染模型的治疗作用A. Screening of effective ratio of Fr.B and erythromycin; B. Establishment of wound infection model in mice; C. Wound healing of mice at different time intervals [① Control; ② Erythromycin; ③ Fr.B; ④ Fusidic acid; ⑤ Mupirocin; ⑥ Kangba (Ointment made from Fr.B and erythromycin)]; D. Quantitative analysis results of wound healing in mice at different time points; E. The count of bacterial colonies on the wound surface of mice under different treatments. Em. Erythromycin, *. P<0.05, **. P<0.01, ***. P<0.001Fig.5 The rapeutic effect of ointment made from Fr. B and erythromycin on mouse wound infection model
2.3.2 Fr.B软膏与红霉素软膏混用对小鼠伤口感染模型的治疗作用前面研究表明Fr.B与红霉素联用制成的抗霸软膏对小鼠伤口感染模型的治疗效果非常显著,为了探究分别单独制备的Fr.B软膏和红霉素软膏在混用时是否也具有显著的治疗效果,本研究利用同样的小鼠伤口感染模型来评估不同软膏混用时对MRSA伤口感染的治疗效果。结果如图6,A和6,B所示,小鼠伤口在处理的第2天时,基质组伤口面积减少至(93.75±10.64)%,基质+1%红霉素软膏与基质+0.1%红霉素软膏的伤口面积分别减少到(84.82±10.10)%和(88.68±8.24)%,而1%红霉素软膏组的伤口面积减少到(66.59±16.10)%;与1%红霉素软膏组类似,含有Fr.B的3个处理组伤口愈合情况也比较好,结果显示Fr.B软膏组伤口面积降低到(68.50±5.10)%,Fr.B软膏+1%红霉素软膏组和Fr.B软膏+0.1%红霉素软膏组的伤口面积分别减少到(65.29±9.94)%和(66.64±8.87)%。由此可知,Fr.B具有一定的促伤口愈合作用,这与上述的研究结果一致。随着继续不同软膏的混用治疗,在处理的第6天可以观察到,基质组伤口面积减少到(58.40%±7.13)%,1%红霉素软膏组、基质+1%红霉素软膏组和基质+0.1%红霉素软膏组的伤口面积的变化相差不大,分别减少到(49.95±15.97)%、(43.11±4.62)%、(48.66±4.72)%,与它们相比,含有Fr.B的3个处理组伤口愈合情况较好,结果显示Fr.B软膏组、Fr.B软膏+1%红霉素软膏组与Fr.B软膏+0.1%红霉素软膏组的伤口面积分别减少到(35.12±3.42)%、(26.20±7.88)%和(30.32±3.77)%,其中Fr.B软膏+1%红霉素软膏组的疗效最优。在处理的第10天,基质组、1%红霉素软膏组、基质+1%红霉素软膏组、基质+0.1%红霉素软膏组和Fr.B软膏组的伤口面积分别减少到(33.69±2.87)%、(28.41±13.54)%、(20.04±3.15)%、(29.35±1.35)%和(20.50±1.25)%,与它们相比,Fr.B软膏+1%红霉素软膏组和Fr.B软膏+0.1%红霉素软膏组的伤口愈合情况更好,伤口面积分别减少到(5.42±4.49)%和(11.43±1.61)%,其中Fr.B软膏+1%红霉素软膏组的疗效依然最优。综上所述,含有Fr.B的治疗效果比含对照基质组的治疗效果好,Fr.B软膏+1%红霉素软膏比其他含有Fr.B软膏组的治疗效果好,Fr.B软膏+红霉素软膏比单独红霉素软膏的治疗效果好。由此说明即使浓度减半,Fr.B软膏和红霉素软膏的混用也比市场销售的红霉素软膏有更好的治疗效果。
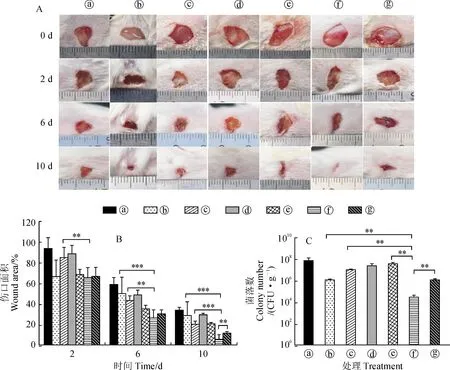
A. 不同时间间隔的小鼠伤口愈合情况(ⓐ 基质;ⓑ 1%红霉素;ⓒ基质+1%红霉素;ⓓ基质+0.1%红霉素;ⓔFr.B;ⓕFr.B+1%红霉素;ⓖFr.B+0.1%红霉素);B. 不同时间点小鼠伤口愈合情况的定量分析结果;C. 不同处理下小鼠创面菌落计数。Em.红霉素,**.P<0.01,***.P<0.001图6 Fr.B软膏与红霉素软膏混用对小鼠伤口感染模型的治疗作用A. Wound healing of mice at different time intervals (ⓐ Base material; ⓑ 1% Erythromycin; ⓒBase material + 1% Erythromycin; ⓓ Base material + 0.1% Erythromycin; ⓔ Fr.B; ⓕ Fr.B + 1% Erythromycin; ⓖ Fr.B + 0.1% Erythromycin); B. Quantitative analysis results of wound healing in mice at different time points; C. The count of bacterial colonies on the wound surface of mice under different treatments. Em. Erythromycin, **. P<0.01, ***. P<0.001Fig.6 The rapeutic effect of Fr.B ointment combined with erythromycin ointment on mice wound infection model
最后,我们同样在处理第4天时对小鼠创面进行MRSA的菌落计数。结果如图6,C所示,基质组、Fr.B软膏组、基质+0.1%红霉素软膏组和基质+1%红霉素软膏组的小鼠每克伤口菌落数分别为7.46×107、3.82×107、2.45×107和1.04×107个,均多于1%红霉素软膏组每克伤口组织的菌落数1.15×106个和Fr.B软膏+0.1%红霉素软膏组每克伤口组织的菌落数1.19×106个,而Fr.B软膏与1%红霉素软膏的混用对小鼠伤口的治疗效果最佳,其每克伤口组织的菌落数仅为2.80×104个。由此表明即使浓度减半,Fr.B也能够显著增强红霉素对MRSA菌株的杀菌能力且其联合治疗的效果显著优于原浓度的红霉素。综上,说明单独制备的Fr.B软膏与市场销售的红霉素软膏按一定比例混合使用时也能获得良好的治疗效果且其疗效显著优于市场销售的红霉素软膏。
3 结论与讨论
本研究在Fr.2a[28]的基础上,利用硅胶柱层析结合活性追踪对酸枣果氯仿提取物中其他极性范围的抗菌増效活性成分进行了分离纯化。将得到具有抗菌增效活性的精制物命名为Fr.B,经GC-MS、红外光谱和核磁共振氢谱分析发现Fr.B主要包含反油酸、油酸、顺-10-十六碳烯醇、棕榈酸等25种脂肪酸类化合物。通过Fr.B与抗生素联合使用对供试菌株的体外抗菌增效活性分析发现,Fr.B能不同程度地显著增强多种抗生素对铜绿假单胞菌、大肠杆菌、粪肠球菌、耐甲氧西林金黄色葡萄球菌(MRSA)和白色念珠菌的抗菌效果,其中对MRSA和白色念珠菌的抗菌增效作用尤为明显,表明Fr.B具有广谱的抗菌增效活性,能有效逆转耐药菌的耐药性。而Fr.B的这种抗菌増效活性主要通过增强耐药菌的细胞通透性来实现。通过小鼠伤口感染模型的体内实验结果显示Fr.B与红霉素联用能显著增强红霉素对MRSA菌株的抗菌作用,以逆转MRSA菌株对红霉素的耐药性,从而促进MRSA感染伤口的快速愈合。
已有很多研究显示游离脂肪酸具有杀菌活性[35-38]。例如,月桂酸对痤疮丙酸杆菌具有抗菌活性[39];月桂酸和亚油酸对李斯特菌也具有很强的杀菌活性[40];癸酸对食源性感染有关的阴性菌,如对空肠弯曲杆菌和大肠杆菌具有很强的杀菌活性[34]。游离脂肪酸除了本身具有杀菌作用外,还具有抗菌増效作用。例如,Kitahara等发现浓度为5 μg/mL的月桂酸能增强庆大霉素或亚胺培南对3种临床MRSA菌株的抗菌作用[41];Chan等研究显示亚油酸和油酸可以分别协同红霉素增强对MRSA的抗菌活性[16]。这些结果与本研究发现由脂肪酸类化合物组成的Fr.B具有广谱抗菌增效活性的结果相一致。目前已知的游离脂肪酸的抗菌机制主要包括以下三个方面[34]:(1)增加膜的通透性和细胞的裂解;(2)破坏电子传递链和解偶联氧化磷酸化;(3)抑制膜结合酶活性和养分吸收。本研究发现由脂肪酸类化合物组成的Fr.B主要通过增强细胞的通透性,从而可能因此增强抗生素对耐药菌的抗菌作用,这与前人提出的游离脂肪酸的抗菌机制相符合。Fr.B除了具有广谱的抗菌增效活性外,本研究在小鼠伤口感染模型的体内实验中发现Fr.B还具有消炎和促进伤口愈合的作用,这也与其他研究报道脂肪酸具有调节伤口炎症反应,并促进伤口愈合的结果[42-43]相一致。Cardoso等发现脂肪酸可通过抑制伤口处一氧化氮的产生而加速小鼠伤口愈合[42]。同样,在大鼠伤口愈合的炎症期,脂肪酸可以诱导血管内皮生长因子α(VEGF-α)和白细胞介素-1β(IL-1β)的产生以及刺激炎症2 α/β (CINC-2α/β)中细胞因子诱导的中性粒细胞趋化因子的产生,从而起促炎作用而加速伤口的愈合过程[43]。综上,作为植物天然提取物的Fr.B,因其能够有效逆转耐药菌的耐药性,而显著增强抗生素在治疗耐药菌引起的伤口感染中的疗效,所以其具有被开发成治疗皮肤耐药菌感染的辅助性药物的潜力。
致谢:特别感谢西安交通大学基础医学院的刘成程副教授为本研究提供了耐甲氧西林金黄色葡萄球菌(MRSA)菌株。
