AMH 联合FSH 在腹腔镜下卵巢囊肿剥除术对卵巢储备功能影响的评价作用
2022-01-12方丹妹蔡婉虹庄如华许秀霞
方丹妹,蔡婉虹,庄如华,许秀霞
(汕头市中心医院妇产科,汕头 515000)
随着腹腔镜技术的日益成熟及推广,腹腔镜下卵巢肿物剔除术已成为卵巢良性肿物的首选治疗方法[1]。与传统的开腹手术对比,其具有住院时间短、恢复快及腹腔粘连少等优势。腹腔镜下良性卵巢肿物剔除术中,保留卵巢组织至关重要,直接影响患者术后的卵巢储备,继而影响其生活质量及生育能力[2]。当前卵巢储备功能的评估仍然是一个被广泛研究的热点问题。抗苗勒管激素(AMH)作为一种新兴的预测卵巢储备功能的指标,相比目前常用的指标如基础促卵泡激素(FSH),雌二醇(E2),黄体生成素(LH)等更加方便与准确,且其在月经周期中相对稳定,已引起人们越来越多的重视[3]。为了探讨AMH 在不同手术方式上对卵巢储备功能影响的评价作用,本文选取到我院因卵巢良性肿物行剔除术的80 例患者作为研究对象。现将研究结果报告如下。
1 资料与方法
1.1 一般资料 选取20119 年10 月~2020 年12 月到我院因卵巢良性肿物行剔除术的80 例患者作为研究对象。纳入标准:年龄20~40 岁;月经正常;无激素服用史,无内外科合并症;卵巢囊肿直径5~10cm,均为单侧;本研究经过患者及家属知情同意;医院伦理委员会批准。排除标准:卵巢恶性肿瘤;卵巢子宫内膜异位囊肿。采取随机分组的方法,将患者分为腹腔镜组和开腹组,各40 例。腹腔镜组年龄20~38 岁,平均(29.26±2.47)岁,开腹组年龄21~37 岁,平均(29.71±2.39)岁。选取正常育龄妇女20 例为正常对照组,入选标准:月经正常;无内分泌疾病、卵巢囊肿病史、妇科手术史;无激素服用史,无内外科合并症。
1.2 研究方法 (1)手术方法:腹腔镜组采用腹腔镜卵巢囊肿剔除术,行气管插管全麻,取头低脚高仰卧位。取脐上缘切口,建立气腹,置入检查镜,镜下探查腹腔及盆腔情况后,于腹壁左右两侧作第二、第三、第四穿刺点,置入手术器械,行卵巢囊肿剔除,采用2-0 抗菌薇乔可吸收线连续缝合卵巢创面止血,重建卵巢结构,缝合时疏密合理,止血彻底,不留死腔。手术全程无在卵巢上使用电热能量器械,尽量避免损伤正常卵巢组织。开腹组行气管插管全麻,取平仰卧位,于下腹正中作纵切口,常规探查腹腔及盆腔,剥除卵巢囊肿,采用2-0 抗菌薇乔可吸收线连续缝合卵巢创面止血,重建卵巢结构,缝合时疏密合理,止血彻底,不留死腔。手术全程无在卵巢上使用电热能量器械,尽量避免损伤正常卵巢组织。(2)激素指标:所有患者在手术前及手术后(1、3、6 个月)的月经周期的第2~4 天抽取静脉血3mL,3000r/min 离心,获得血清后,采用电化学发光法检测AMH、FSH、LH、E2,采用美国贝克曼全自动免疫分析仪DXI800 及其配套试剂盒检测;(3)阴道超声指标:所有患者在手术前及手术后的月经周期的第2~4 天行阴道彩色多普勒超声检查,设备为美国GE LOGIQ E9 超声诊断仪,检测窦卵泡数(AFC,卵巢内直径2~9 mm 的卵泡个数)、卵巢血流阻力指数(RI)、卵巢搏动指数(PI)。根据卵泡个数确定患者卵巢功能的高低,卵巢储备功能下降为卵泡数量<5 个;正常卵巢卵泡数量5~15 个。
1.3 统计学分析 采用SPSS 23.0 统计学软件对研究结果进行分析并处理,计数资料采用χ2检验,两组之间比较用独立样本T 检验,各组比较采用重复测量数据方差分析,并进行Pearson 相关性分析。诊断效能用灵敏度、特异度、准确度、约登指数评估,联合诊断的方式为并联,各种指标中任意1 项指标阳性即为阳性(并联试验)。检验水准α=0.05,当P<0.05 表示有统计学差异。
2 结果
2.1 各组术前激素水平及阴道超声指标的比较 术前,三组间血清AMH、E2,FSH,LH 水平及AFC、RI、PI差异无统计学意义(P>0.05)。见表1。
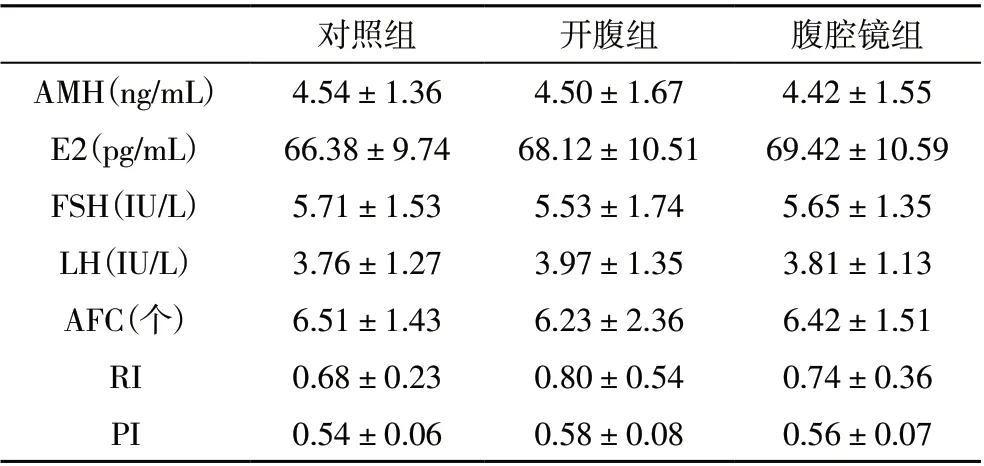
表1 各组术前激素水平及阴道超声指标的比较
2.2 各组术后激素水平及阴道超声指标的比较 术后1、3、6 个月,腹腔镜组和开腹组的血清E2、LH、RI、PI与对照组比较无统计学差异(P>0.05),血清AMH、AFC均显著低于对照组,FSH 显著高于对照组(P<0.05);术后1、3、6 个月,腹腔镜组血清AMH、AFC 均高于开腹组,FSH 均显著低于开腹组(P<0.05)。见表2。
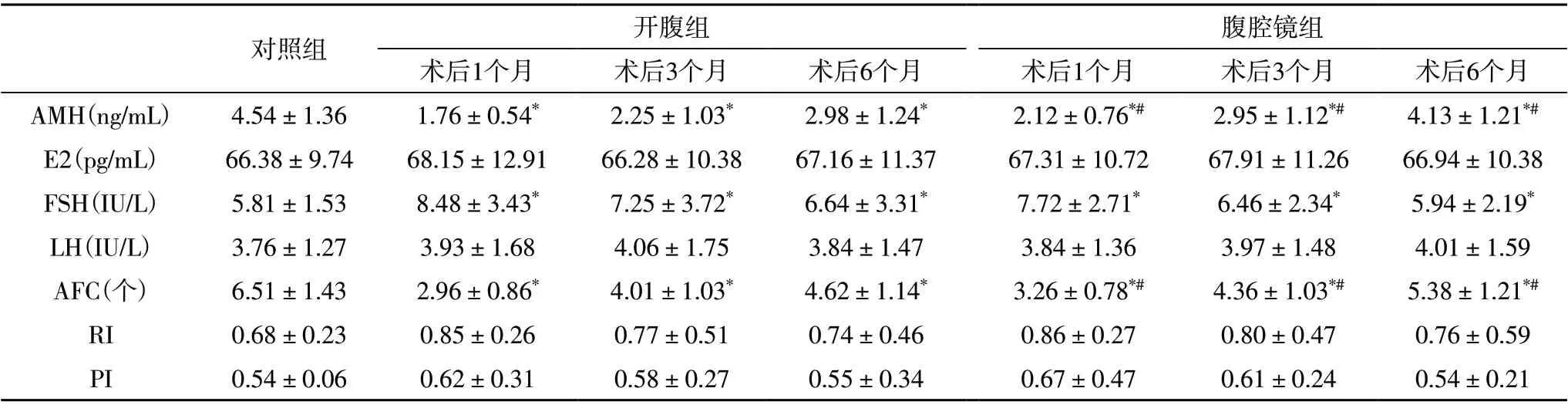
表2 各组术后激素水平及阴道超声指标的比较
2.3 80 例患者血清AMH、FSH 与AFC 的相关性分析经过Pearson 相关性分析,血清AMH 与AFC 呈正相关,与FSH 呈负相关(P<0.05)。结果见表3。
2.4 AMH 联合FSH 对腹腔镜组患者卵巢储备功能下降的预测价值 血清AMH 的敏感度、特异度及准确度分别为85.2%、80.8%和83.8%;血清FSH 的敏感度、特异度及准确度分别为77.8%、73.1%和76.3%,AMH+FSH 联合检测敏感度、特异度及准确度均显著高于单项指标检测结果(P<0.05)。结果见表4。
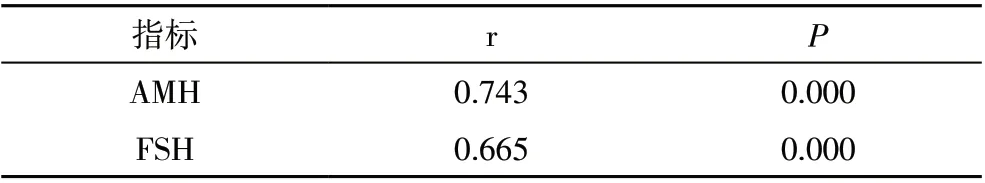
表4 80例患者血清AMH、FSH与AFC的相关性分析
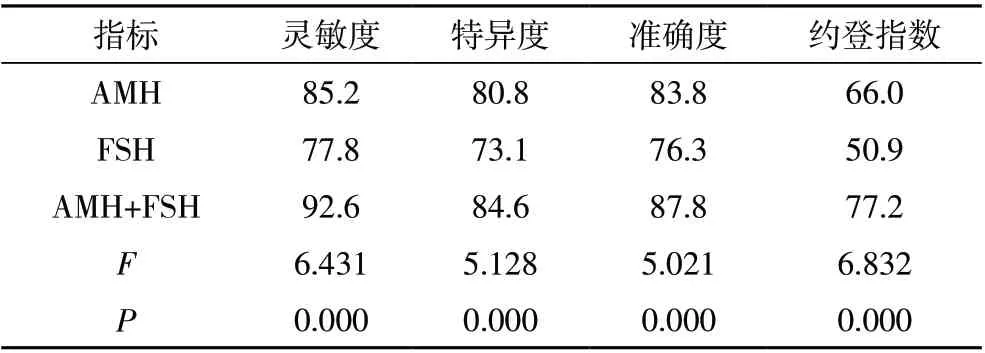
表4 AMH联合FSH对腹腔镜组患者卵巢储备功能下降的预测价值
3 讨论
卵巢储备包括卵巢内卵泡数和卵子质量两方面,卵巢可募集的卵泡数减少及卵子质量下 降,可导致卵巢储备下降[4]。文献报道,许多反映卵巢储备指标,如FSH 及抑制素B 评价卵巢储备价值有限;标记卵巢储备的超声指标,如卵巢体积、血流、AFC 在腹腔镜卵巢囊肿剔除术中难以评估确切数量的AFC 和卵巢体积,血清AMH 检测在性别发育异常、妇科肿瘤及生殖领域作用广泛[5-6]。生育期女性AMH 主要由次级卵泡、窦前和窦状卵泡颗粒细胞产生,卵泡发育到4~6mm 后分泌AMH,到窦前及小窦卵泡期达到高峰,随着卵泡发育其表达水平逐渐降低,AMH 水平与卵巢卵泡数目具有相关性[7-8]。AMH 在正常周期女性血中波动很小,不受周期影响。随着年龄增长,循环血液中AMH 慢慢降低,绝经后甚至检测不到。近年AMH 成为优于年龄、FSH、抑制素B 等反映卵巢储备的良好指标[9]。AMH在卵泡发育过程中主要具有以下几个方面作用:(1)抑制卵泡中颗粒细胞的生长;(2)降低生长卵泡对 FSH 的敏感性,抑制由 FSH 促进的卵泡发育过程和优势卵泡的选择;(3)阻止始基卵泡由静息状态进入生长卵泡池;(4)抑制颗粒细胞中 P450 芳香化酶活性,进而抑制颗粒细胞合成并分泌雌激素[10-11]。AMH 的存在使卵泡池中的储备卵泡不至于被迅速耗尽,是保存女性生育能力的一个重要的负反馈机制,AMH 的稳定性和准确性让它或许能够作为最可靠的反应生长指标,因此AMH 可作为在卵巢肿物术后对卵巢储备功能评价的一个有效指标[12]。
本研究结果表明,术后1、3、6 个月,腹腔镜组和开腹组的血清E2、LH、RI、PI 与对照组比较无统计学差异,血清AMH、AFC 均显著低于对照组,FSH 显著高于对照组;术后1、3、6 个月,腹腔镜组血清AMH、AFC 均高于开腹组,FSH 均显著低于开腹组。提示两种手术对患者的卵巢储备功能均有一定损伤,但腹腔镜术式对患者的损伤程度更小,且在相同的时间内,患者卵巢功能恢复得更好。本研究经过Pearson 相关性分析,血清AMH 与AFC 呈正相关,与FSH 呈负相关。说明AMH能有效评价患者的卵巢储备功能。
另外,本研究还表明,血清AMH 的敏感度、特异度及准确度分别为85.2%、80.8%和83.8%;血清FSH的敏感度、特异度及准确度分别为77.8%、73.1%和76.3%,AMH+FSH 联合检测敏感度、特异度及准确度(92.6%、84.6%、87.8%)均显著高于单项指标检测结果。提示AMH 联合FSH 评价卵巢储备功能的临床价值更高,因为AMH 主要由次级卵泡、窦前和窦状卵泡颗粒细胞产生,与卵巢卵泡数目有关。而FSH 可以促进卵泡成熟,调控生长发育过程,因此两者均可用于评价卵巢储备能力。
综上,腹腔镜下卵巢囊肿剥除术对卵巢储备功能有一定损伤,AMH 联合FSH 能有效对术后卵巢储备功能进行评价。
