内镜黏膜下剥离术与内镜下黏膜切除术治疗食管早癌的临床效果对比
2022-01-12詹士宝程继明曹正龙
詹士宝,程继明,曹正龙
(天长市中医院内二科,天长 239300)
食管癌为消化系统常见恶性肿瘤,食管癌患者的预后与其诊断时的分期紧密相关,食管早癌(early esophageal cancer,EEC)的预后一般较好,经适当治疗后的5 年生存率可达90%[1-3]。随着内镜技术的发展和普及,临床上EEC 检出率明显提高。在EEC 的临床治疗中,内镜下微创切除逐渐获得了广泛的应用,相较传统开放式手术,其创伤小,术后恢复快,患者生活质量明显提高[4]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)与内镜下黏膜切除术(endoscopic mucosal resection,EMR)是目前临床上治疗EEC 的主要内镜微创术式[5-6]。目前基于瘤体大小无差异情况下的两种术式的比较研究相对较少。本研究回顾性分析了本院2018 年10 月~2020 年6 月收治的64 例行ESD或EMR 手术治疗的EEC 患者,对比观察两种术式的临床效果及安全性,旨在为临床制定个体化的的治疗方案提供理论依据。
1 资料与方法
1.1 一般资料 选取2018 年10 月~2020 年6 月本院行ESD 或EMR 术治疗的64 例EEC 患者为研究对象。纳入标准:(1)术前胃镜检查及活检病理提示食管早癌,术后病理明确为食管高级别上皮内瘤变或粘膜内癌;(2)年龄18~75 岁;(3)无上腹部手术史、放化疗史;(4)行ESD 或EMR 术式;(5)肿瘤直径大于2cm。排除标准:(1)合并其他恶性肿瘤者;(2)合并严重心、肝、肾、脑等重要脏器功能障碍或不全者;(3)中转开腹手术者;(4)临床资料及随访资料不完整者。入选的64例EEC 患者中,根据手术方式不同分为ESD 组38 例和EMR 组26 例。两组患者的一般资料比较无统计学差异(P>0.05),具有可比性,具体见表1。
表1 两组患者一般资料比较
1.2 手术方法 ESD 组:行内镜黏膜下剥离术,手术采取气管插管全身麻醉方式,患者取左侧卧位。在放大内镜+窄带成像术(narrow band Imaging,NBI)或卢戈氏碘染色下,首先于病灶周围5mm 位置使做环形标记,于标记点外侧多点黏膜下注射甘油果糖及玻璃酸钠注射液使病灶呈抬举征;于标记点外侧5mm 处环形切开黏膜至黏膜下层,沿黏膜下层逐步剥离。术中电凝钳预处理较粗的血管,以防严重出血发生;病变完整切除后,电凝处理创面裸露血管。术后禁食24h,常规抑酸、护膜、补液等治疗。
EMR 组:行内镜下黏膜切除术,麻醉方式及手术体位同ESD 组。在放大内镜+NBI 或卢戈氏碘染色下,于病灶周围做环形标记区分目标病灶与正常黏膜边界。于内镜头端安装透明帽与套圈器,将透明帽对准病灶并使用负压吸引将病变黏膜吸入透明帽内,收紧套圈器并对病变黏膜予以电切除,并分次完整切除病灶;对出血创面行电凝止血处理。术后禁食24h,常规抑酸、护膜、补液等治疗。
1.3 观察指标 ①围手术期指标:包括手术时间、住院时间、整块切除率和治愈性切除率;②手术并发症:包括出血、穿孔等并发症发生情况;③预后情况:术后1、3、6 和12 个月行内镜随访,随访以电话及门诊方式进行,记录术后随访1 年期内预后情况,主要观察终点为无病生存期(disease free survival,DFS),定义为手术后至胃癌复发的时间。
1.4 统计学方法 使用SPSS 20.0 软件进行数据统计,以mean±SD 表示计量资料,使用t 检验比较;计数资料以例数(%)表示,采取χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者围术期指标比较 两组患者均顺利完成手术。ESD 组手术时间长于EMR 组(P<0.05),整块切除率和治愈性切除率均高于EMR 组(P<0.05);两组住院时间比较无统计学差异(P>0.05)。见表2。
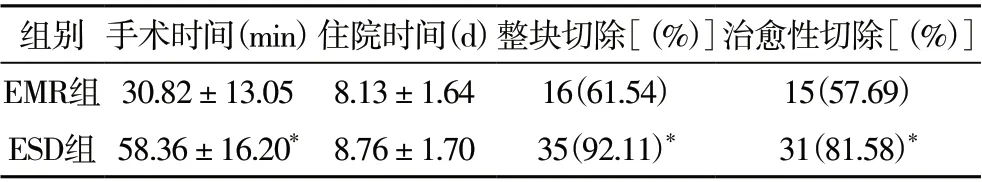
表2 两组患者围术期指标比较
2.2 两组患者手术并发症比较 ESD 组手术并发症表现为出血5 例,其中术中出血2 例,术后延迟性出血3 例,术中穿孔2 例;EMR 组手术并发症表现为出血2 例,其中术中出血1 例,术后延迟性出血1 例;两组出血、穿孔及总并发症发生率比较均无统计学差异(P>0.05),见表3。

表3 两组手术并发症比较[n(%)]
2.3 两组患者术后复发情况比较 随访期内,ESD 组1例复发,复发率2.63%;EMR 组1 例复发,复发率3.85%,两组患者术后1 年内复发率比较无统计学差异(P>0.05)。
3 讨论
内镜微创治疗已逐渐成为EEC 主要的治疗方式。目前比较明确的是内镜下治疗相比传统根治性手术在减少手术创伤、最大限度保留器官功能以及促进术后恢复方面具有显著优势[7]。既往认为,ESD 相比EMR优势在于能处理相对较大的病灶,能完全切除直径大于2cm,甚至能完成直径10cm 左右病灶的切除,而其缺点在于治疗创面大,引起出血、穿孔的风险增加[8-9]。本回顾性研究中,在肿瘤直径、位置,患者体质量指数以及人口学资料等可比的情况下比较分析了ESD 和EMR 术式在直径2cm 以上EEC 切除中的应用效果。
本研究中,ESD 组手术时间长于EMR 组。通常而言,相比EMR 术式,ESD 术式操作更为复杂,其对病灶的侵入深度、大小形态及部位较EMR 复杂,故而耗时更长;此外,由于ESD 术中出血、穿孔发生率较EMR 术中高,术中穿孔的修补和止血操作均会延长手术时间。ESD 手术难度相对更高,学习曲线稍长,有报道[10]指出有50~100 例内镜微创手术经验的医师行EMR 手术的时间显著短于ESD 术式,本研究结果与此一致,而且随着术者操作熟练程度的增加以及新的手术器械的出现,手术时间也将越来越短。
病灶的整块完整切除,是EEC 内镜下切除的关键,只有整块完整切除,才能达到组织学意义上的根治。国外研究显示,ESD 治疗EEC 的整块切除率和治愈性切除率分别为89.7%~96.7%、75.0%~95.0%[11-12],本研究的整块切除率及治愈性切除率分别为93.10%和82.14%,与国外研究结果相近。以往报道显示,ESD 和EMR 在切除率方面存在显著差异,研究指出ESD 术式在治疗直径小于1cm,1~2cm 以及2cm 以上EEC 中的切除率均高于EMR 术式,且这种差异随着肿瘤直径增加愈加明显[13]。本研究中,ESD 组整块切除率和治愈性切除率均高于EMR 组,与以往报道的结果相符合。报道[14]显示,EMR 术式的整块切除率受病灶范围、部位以及术者经验影响较大,且对瘢痕病灶的整块切除率低,而ESD 对瘢痕样变的病灶整块切除率依然较高。本研究中,ESD 组的1 年复发率低于EMR 组,但并无统计学差异。以往研究显示,EEC 的复发与肿瘤的不完全切除率有相关,ESD 可切除的病变范围、深度要大,对病灶切除要彻底,但由于本研究的随访时间较短,ESD 术式是否有助于降低远期复发率有待进一步观察。
EEC 内镜微创治疗的并发症主要有出血、穿孔等。本研究中ESD 组出血、穿孔发生率高于EMR 组,但均无统计学差异,与以往对EEC 荟萃分析中ESD 术中出血率、穿孔率显著高于EMR 术式的结果不一致[15],笔者分析这可能与本研究中的样本量较小导致统计效能低有关。一般情况下,ESD 术中出血只要处理及时,均可在内镜下成功止血;精细的内镜操作及对较大血管的预处理是防止术中大出血发生的有效方法。此外,在完整剥离病灶后仔细检查创面,并对裸露的血管残端及存在出血风险的血管进行处理,术后应用质子泵抑制剂有助于减少术后延迟性出血的发生。本研究中所有的出血病例均在内镜下成功止血,未有严重情况发生。穿孔是ESD 常见且最严重的并发症,但在EMR术式中较少见,这可能与ESD 技术难度更大,切除范围及深度广不无关系。本组术中穿孔的2 例患者均在内镜下使用金属夹封闭穿孔,行保守治疗后好转。研究认为黏膜下注射时采用透明质酸钠注射液或玻璃酸钠注射液以充分抬举病灶可减少穿孔风险。
综上所述,ESD 和EMR 均为治疗直径大于2cm EEC 的有效方法,ESD 手术时间相对较长,易发生出血、穿孔等并发症,但整块切除率和治愈性切除率高。本研究不足在于总体随访时间有限,两种术式治疗EEC 的远期疗效有待进一步更长时间的随访观察。
