提铜萃余液中锌的回收
2022-01-10张建元王晓歌王洪凯孙宏志
张建元 ,章 宁 ,王晓歌 ,王洪凯 ,孙宏志
(1.辽宁新都黄金有限责任公司,辽宁 朝阳 122000;2.东北大学 冶金学院,辽宁 沈阳 110819)
锌是国民生产中的一种重要金属,广泛应用于镀锌、锌合金、电池制造等领域[1]。随着我国经济不断发展,锌的需求不断上涨,锌原料消耗巨大,锌矿资源越采越少,金属锌面临着原料供应短缺的局面[2]。因此,锌资源回收再利用成为人们日渐关注的焦点。目前世界上的锌70%来自于开采的锌矿石,而30%源于回收锌[3]。
国内外处理含锌铁废水方法较多,主要有沉淀法、吸附法、离子交换法、萃取法等[4-7]。陈明[8]采用电位调控-硫化沉淀法对含100 mg·L-1Zn2+的矿山酸性废水进行深度处理。结果表明,矿山酸性废水中的Zn2+的去除率达到96.85%以上。焦永侠[9]介绍了活性炭、石灰乳和铁屑法处理镀锌废水的基本原理、工艺流程和各项试验参数,处理后的废水中锌含量达到国家排放标准,废水可回收利用。杨永斌等[10]采用溶剂萃取法回收锌,通过调整相比(O/A 比)和萃取剂浓度可实现锌的有效萃取,萃取率可达到99%以上。
针对辽宁某黄金冶炼厂金精矿焙烧酸浸预处理提铜后得到的萃余液,本文采用“预中和-硫化”工艺,以ZnS 精矿的形式回收萃余液中的锌元素,考察pH 值、硫化剂的用量、时间、温度等因素对锌回收过程的影响。同时采用“预中和-分段硫化”和“铁-砷氧化共沉法”工艺对萃余液进行深度净化处理,降低了生产成本,提高了ZnS 精矿的品位。
1 试验
1.1 试验原料
表1 为萃余液成分表。由表可以看出,萃余液的主要元素为Zn、Fe,还含有部分Cu 和As,锌铁比接近1∶1,锌砷比接近14∶1。萃余液pH 为1.0。

表1 萃余液成分
1.2 试验方法
以IKA RW20 数显型搅拌器为反应器,将一定量的萃余液倒入反应槽中,加入一定量的硫化钠水溶液,向其缓慢滴加NaOH 溶液或Ca(OH)2乳浊液,调节pH 值,搅拌一段时间,待其反应完全,过滤,得到滤液和滤饼,将滤饼放入干燥箱烘干,得到硫化沉淀固体产物,并测定滤液中Zn2+、Fe2+的浓度及硫化沉淀产物中Zn 含量。
1.3 分析方法
采用日本理学公司ZSX100e 型X 射线荧光光谱仪对试验产物进行定性分析;采用荷兰帕纳科公司生产的PW3040/60 型X 射线衍射仪对试验产物进行物相分析;采用日立公司Z-2300 型火焰原子吸收光谱仪测定Zn 和Fe 的含量。
2 结果与讨论
2.1 萃余液中硫化沉锌热力学分析
金属硫化物在含S2-水溶液中的溶解度与溶液中S2-浓度及pH 值有关。图1 为水溶液中Zn2+浓度及Fe2+浓度随pH 值的变化曲线,曲线(a)所包围的区域为ZnS(s)稳定区,曲线(b)所包围的区域为FeS(s)稳定区。当pH 值在0.0~13.0 时,ZnS(s)的稳定区覆盖了FeS(s)的稳定区,因此,当溶液中S2-浓度小于Zn2+浓度时,在此pH 值范围内只会产生ZnS 沉淀,不会生成FeS 沉淀[11],这表明硫化沉淀法分离Zn2+、Fe2+是可行的。

图1 pH 值对Zn2+、Fe2+浓度的影响
图2 是Zn-Fe-S-H2O 系电位-pH 图(cZn2+=6 g·L-1,cFe2+=6 g·L-1)。由图可知,当pH 值小于3.8 时,Zn 元素存在的主要形式为Zn2+、ZnS;当pH值大于3.8 时,进入ZnFe2O4的稳定区,达不到锌铁分离的目的。故硫化pH 值应控制在3.8 以下。

图2 Zn-Fe-S-H2O 系电位-pH 图
2.2 pH 值对硫化沉锌过程的影响
取400 mL 模拟萃余液(cZn2+=4 g·L-1、cFe2+=4 g·L-1、pH=1.0)于搅拌槽,调整搅拌器转速为400 r·min-1,在室温下按照硫化钠过量系数1.5 向其中加入Na2S·9H2O,用一定浓度的氢氧化钠溶液和浓硫酸调节不同的pH 值为0.0、1.0、2.0、3.0、4.0,搅拌30 min,检测其溶液中Zn2+、Fe2+浓度的变化情况,结果如图3 所示。由图可知,Zn2+的浓度随着pH 值的升高先降低后升高,Fe2+的浓度稳定不变;当pH=3.0 时,Zn2+的浓度最低,为0.11 g·L-1,此时对应的锌回收率为97.25%。当溶液的pH 值较低时,生成的ZnS 沉淀部分返溶回溶液中,如式(1),最终导致溶液中Zn2+的浓度升高。因此,选择pH=3.0 作为硫化沉锌的硫化pH 值。


图3 pH 值对Zn2+、Fe2+浓度的影响
2.3 硫化钠用量对硫化沉锌过程的影响
取400 mL 模拟萃余液于搅拌槽,调整搅拌器转速为400 r·min-1,在室温下按照不同过量系数1.0、1.2、1.3、1.4、1.5 向其中加入Na2S·9H2O,调节pH=3.0,搅拌30 min,检测Zn2+、Fe2+离子浓度的变化情况,结果如图4 所示。由图可知,随着Na2S 过量系数的增大,Zn2+的浓度逐渐降低,Fe2+的浓度稳定不变。当Na2S 过量系数从1.2 增大到1.3 时,Zn2+浓度下降较快,当Na2S 过量系数继续增大至1.3,Zn2+浓度稳定在0.20 g·L-1,此时锌的回收率为95.00%。继续增加过量系数至1.4 时,溶液中Zn2+浓度降低不明显,而当过量系数增至1.5 时,溶液中Zn2+浓度继续降低。考虑到过量的Na2S 会增加回收成本并为后续处理带来影响,故选择Na2S 过量系数1.3 进行后续试验。
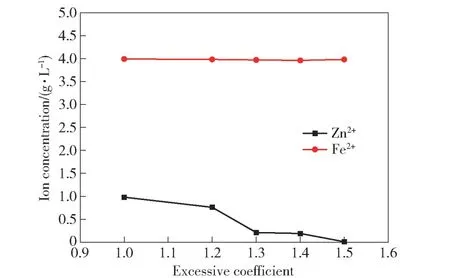
图4 硫化钠过量系数对Zn2+、Fe2+浓度的影响
2.4 沉淀时间对硫化沉锌过程的影响
取400 mL 模拟萃余液于搅拌槽,调整搅拌器转速为400 r·min-1,在室温下按照过量系数1.3 向其中加入Na2S·9H2O,调节pH=3.0,搅拌30、60、90、120 min,比较Zn2+、Fe2+离子浓度的变化情况,结果如图5 所示。由图可知,沉淀时间从30 min 延长到120 min 时,萃余液中残留Zn2+浓度稳定在0.19 g·L-1左右,对应的锌回收率为95.25%左右,说明该硫化过程化学反应速率较快,故选择硫化时间30 min 进行后续试验。
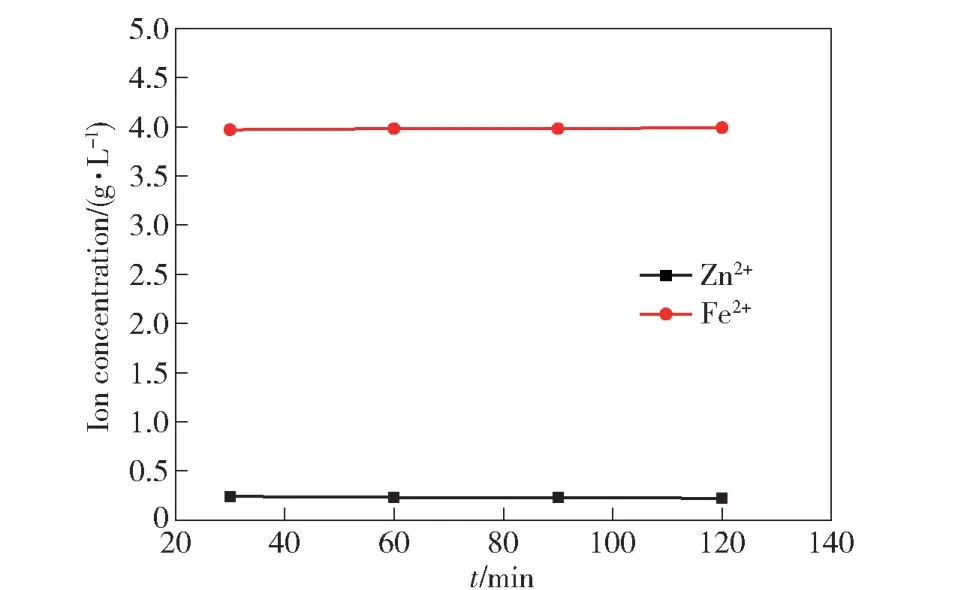
图5 沉淀时间对Zn2+、Fe2+浓度的影响
2.5 反应温度对硫化沉锌过程的影响
取400 mL 模拟萃余液于搅拌槽,调整搅拌器转速为400 r·min-1,在室温25 ℃、30 ℃、35 ℃、40 ℃、50 ℃下按照过量系数1.3 向其中加入Na2S·9H2O,调节pH=3.0,搅拌30 min,比较Zn2+、Fe2+离子浓度的变化情况,结果如图6 所示。由图可知,随着反应温度升高,溶液中残留Zn2+浓度几乎不变,稳定在0.20 g·L-1,对应的锌回收率为95.00%。故该硫化沉淀反应的进行无需升温,在室温下即可进行。
2.6 真实萃余液硫化沉淀试验
在室温、Na2S 过量系数1.3、硫化pH=3.0、硫化时间30 min 的条件下,对真实萃余液进行硫化沉淀试验,结果如表2 所示,该结果与模拟萃余液结果基本吻合,锌回收率为97.06%,品位为52.54%,获得了品位较高的锌精矿。

表2 真实萃余液硫化沉锌结果
2.7 预中和工艺对硫化沉锌的影响
为降低生产成本,在硫化沉锌前,采用氧化钙预中和工艺粗调pH 值,再用少量氢氧化钠精准调节到最佳pH 值。图7 为加入不同质量氧化钙粉末对溶液pH 值的影响。由图可知,随着CaO 加入量的升高,溶液的pH 值逐渐增大。当CaO 加入量超过10 g·L-1后,溶液开始变得浑浊,这是由于pH 值增大,溶液中部分Fe2+转化成了Fe3+,Fe3+水解为Fe(OH)3胶体,而且在过滤时,胶体会严重影响过滤速度;此外,过滤后的滤液中Zn2+浓度减少到5.82 g·L-1,表明机械夹杂较为严重,直接影响锌的回收率。且CaO 加入量为10 g·L-1时,溶液pH 已接近前面实验结果选定的pH=3 的最佳值,再增加浓度已无必要。因此选择CaO 加入量为10 g·L-1进行后续试验。

图7 CaO 加入量对萃余液pH 值影响
表3 为添加10 g·L-1CaO 预调pH 值后,加入过量系数1.3 的硫化钠,用NaOH 溶液微调pH=3.0,硫化时间30 min 条件下萃余液沉锌试验结果。对硫化沉淀产物进行XRD 物相分析和XRF 定量分析,如图8 和表4 所示,所得产物的主要物相是ZnS。硫化沉淀产物中除Zn、S 元素外,Fe、Cu、Pb 等杂质元素含量较低,而杂质砷元素含量较高。

表3 预中和工艺下萃余液硫化沉锌试验结果

图8 硫化沉淀产物XRD 图谱

表4 硫化沉淀产物元素含量表(mass%)
2.8 砷的去除
在CaO 加入量为10 g·L-1时,搅拌30 min 后,对过滤后滤液曝气10、20、30、60 min,检测再次过滤后滤液中砷的残余浓度,结果如图9 所示。由图可知,随着曝气时间的延长,萃余液中的亚砷酸根氧化为砷酸根,并以砷酸铁的形式沉淀而出,溶液中砷浓度逐渐降低,当曝气时间达到30 min 时,溶液中残留的砷离子浓度仅为3.20 mg·L-1,继续延长曝气时间,溶液中残留的砷离子浓度基本稳定;同时,Zn2+的损失率逐渐升高,这是由于生成了大量的Fe(OH)3胶体,Zn2+机械夹杂较为严重,使Zn2+大量损失。因此,选择曝气时间30 min。
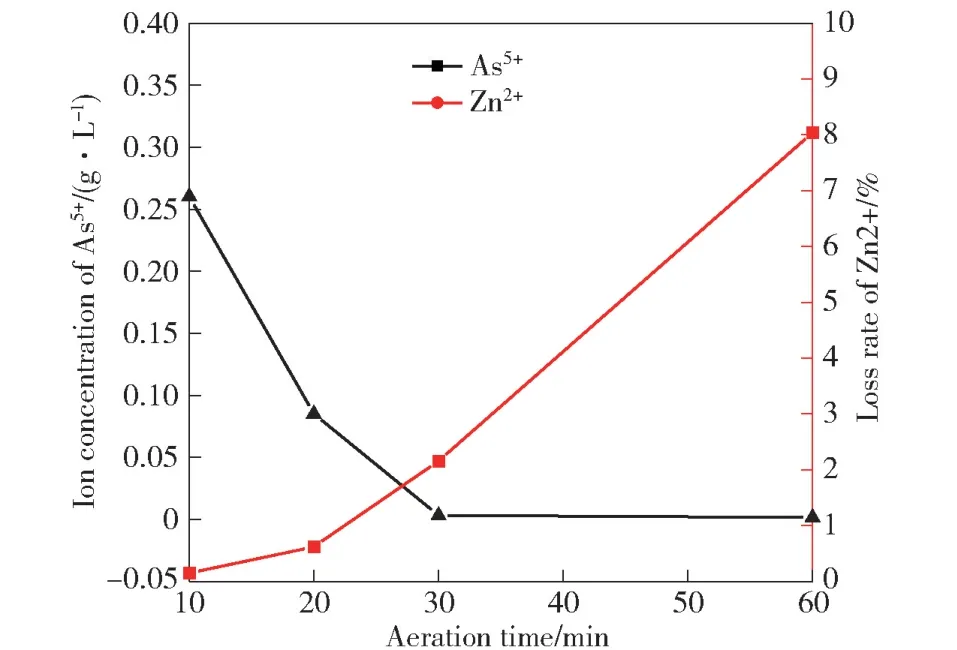
图9 曝气时间对Zn2+损失率、As5+浓度的影响
2.9 Cu2+杂质的去除
在除砷步骤后,向其滤液中预加入一定比例的Na2S,以CuS 的形式去除溶液中的Cu2+,再将剩余部分的Na2S 加入滤液以获得ZnS 沉淀,结果如图10 所示。随着预投量的增大,Zn 的回收率逐渐降低,Zn 的品位先上升后稳定,这主要因为硫化钠预投量超过溶液中的Cu2+沉淀所需的量时,过量的硫化钠水溶液会和Zn2+生成ZnS 沉淀,过滤时会和CuS 一起进入滤饼中,降低了Zn2+的回收率;而由于砷、铜生成了沉淀并被除去,硫化锌精矿的品位得到进一步提高,预投量继续增加,对锌品位无影响。因此,硫化钠按照(0.1 +1.2)倍的加入方法,锌的回收率为95.72%,对硫化沉淀产物进行XRF 定量分析,结果如下表5 所示,杂质As、Cu 得到了有效的去除,Zn 的品位提升到54.08%。

图10 Na2S 预投量对Zn 回收率和Zn 品位的影响

表5 硫化沉淀产物成分(mass%)
3 结论
(1)本文采用硫化沉淀法回收萃余液中的锌,探究pH 值、硫化钠用量、沉淀时间、沉淀温度对锌回收率的影响,获得的优化工艺条件为:在室温下、硫化钠的过量系数1.3、硫化pH=3.0、硫化时间30 min,此时Zn 的回收率为97.06%,硫化沉淀产物中Zn 的品位为52.54%。
(2)采用“预中和-硫化”方法回收萃余液中的锌,Zn 的回收率为96.56%,硫化沉淀产物中Zn 的品位为52.32%。该工艺对硫化沉锌过程影响较小。
(3)萃余液预中和后的滤液,曝气30 min,可以将溶液中砷离子的浓度从0.47 g·L-1降低到3.20 mg·L-1。在除砷后的滤液中,按照0.1 过量系数的预投量加入硫化钠,随后过滤,硫化沉锌时加入剩余的1.2 过量系数的硫化钠,可使Cu2+等杂质沉淀除去。经过净化除杂后再硫化,Zn 的回收率为95.72%,硫化沉淀产物中Zn 的品位为54.08%。
