CS@Fe3O4结合微波或远红外解冻对真鲷品质特性的影响
2022-01-10李钰金代雨菲蔡路昀李秀霞
李钰金,代雨菲,蔡路昀,王 晶,李秀霞
(1 中国海洋大学食品科学与工程学院 山东青岛 266003 2 浙江大学宁波研究院 浙江宁波 315100 3 浙江大学生物系统工程与食品科学学院 杭州 310058 4 渤海大学食品科学与工程学院 辽宁锦州 121013)
真鲷俗称“红加吉”,为近海暖温性鱼类。真鲷鱼体侧扁,有红色、黑色之分。在我国四大海域及日本、朝鲜及东南亚沿海皆有分布。该鱼种口感好,市场价值高,生长速度快,抗逆性强,是具商业价值的重要鱼种之一。真鲷鱼肉富含蛋白质以及多种维生素、钙、磷、铁及尼克酸等营养成分,其味道鲜美,肉质嫩滑,营养丰富[1-3]。在鱼类贮藏和加工过程中,其食味特性、营养价值都会随着时间延长发生变化,同时也伴随着汁液流失、脂肪氧化和组织结构破坏等现象,均会造成腐败变质的发生。作为鱼肉的主要功能成分之一,蛋白质在内源酶和微生物联合作用下发生降解、变性等是导致鱼肉品质下降的主要原因。蛋白质可以分为肌原纤维蛋白、肌浆蛋白和肌基质蛋白3 类[4]。蛋白质的完整性与鱼体肌肉组织的各种功能特性密切相关,其中肌原纤维蛋白含量最高,其结构和性质直接影响肌肉品质。解冻过程与冻结过程是相逆的,影响着冷冻肉品品质和食用价值,同时在解冻处理过程中也会影响肌肉组织的理化特性。在解冻过程中,鱼体中冰晶融化导致汁液损失,微生物恢复活性,加速脂肪和蛋白氧化[5]。近年来,研发提高冷冻食品品质和产品效益的新型解冻方式一直是食品科学领域的一大热点,解冻方式在肌原纤维蛋白方面已经引起研究者们的广泛关注,本文探究4 种解冻方式对真鲷品质特性、蛋白构象及氧化、水分状态变化和组织结构的影响以及变化趋势,通过取用真鲷背部肌肉测定其汁液流失率、质构、热稳定性、微观结构及水分分布等指标,并提取真鲷背部肌肉肌原纤维蛋白,测定其粒径、紫外吸收光谱、内源荧光光谱、流变特性等指标,从而评价不同解冻方式对真鲷理化性质和蛋白质功能特性的影响,为寻找更适合的解冻方式提供理论参考。
1 材料与方法
1.1 材料与试剂
真鲷,采购于锦州当地的水产市场;壳聚糖磁性纳米,购于西安瑞禧生物科技有限公司;其余试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
AF-10 制冰机,斯科茨曼制冰机系统有限公司;970CRT 荧光分光光度计,上海精密科学仪器有限公司;PQ001 低场核磁共振分析仪,上海纽迈电子科技有限公司;LabRAM HR Evolution 拉曼光谱仪,HORIBA 公司;Biofuge stratos 台式高速冷冻离心机,美国Thermo 公司;DHR-1 流变仪,美国TA 公司;Free Zone2.5 真空冷冻干燥机,美国Labconco 公司;UV-2550 型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;S-4800 场发射扫描电子显微镜,日本日立公司;Milli-Q 超纯水系统,美国Millipore 公司;DSC-Q2000 差示扫描量热仪,美国TA 公司;CX-1 层析柜,上海嘉鹏科技有限公司;NN-DF382M 微波炉,上海松下微波炉有限公司;RC-4HA 温度记录仪,江苏精创电气股份有限公司。
1.3 样品处理
将新鲜真鲷(平均体重800 g±50 g)去头、皮和内脏等副产物后,取其背部肌肉总质量约为(150±30)g,用去离子水清洗干净后均分为5 份鱼块(8 cm×3.5 cm×3 cm)并用保鲜膜包裹,每片质量约30 g。一份作为新鲜样品,其余鱼块放在-20 ℃冰箱冷冻24 h 为解冻试验做准备。4 个处理组分别为:微波解冻(MT);远红外解冻(FT);CS@Fe3O4微波解冻(CMT);CS@Fe3O4远红外解冻(CFT)。对照组为新鲜样品(FS)。
1.4 解冻方法
1.4.1 微波解冻(MT) 本试验采用的微波参数为功率300 W,2 450 MHz,将鱼块放在微波炉中进行解冻。用温度记录仪进行检测,当样品中心温度达到0 ℃时为解冻终点。
1.4.2 远红外解冻 (FT) 将两个红外管 (4~14 μm,12 mm×300 mm,300 W) 安装在层析柜的两侧,层析柜温度设定为10 ℃,将鱼块放进层析柜中。解冻过程和解冻终点同1.4.1 节。
1.4.3 CS@Fe3O4微波解冻 (CMT) 配制质量浓度为0.1 mg/mL 的CS@Fe3O4溶液,将包裹保鲜膜的冷冻鱼块放入溶液中,确保鱼块完全浸没后放入微波炉中解冻。解冻终点同1.4.1 节。
1.4.4 CS@Fe3O4远红外解冻 (CFT) 将包裹保鲜膜的冷冻鱼块放入配制好的CS@Fe3O4溶液中,完全浸没溶液后放入装有红外管的层析柜中解冻。解冻终点同1.4.1 节。
1.5 肌原纤维蛋白的提取
肌原纤维蛋白的提取根据文献[6]的方法,并稍作修改,将4 组解冻后鱼肉用绞肉机搅碎成肉糜,每个处理组称取10 g 放于离心管中,加入4倍体积的磷酸盐缓冲溶液 (20 mmol/L Na2HPO4,pH=7.2)提取液,用均质机以4 000 r/min,均质30 s,共3 次,之后经5 000 g、4 ℃离心15 min,去除上清液,沉淀再加入4 倍上述磷酸盐缓冲溶液重复步骤(均质、离心)3 次。最后取沉淀用4 倍体积的漂洗液(20 mmol/L,0.6 mol/L NaCl,pH=6.7)均质、离心(同上述条件),上清液即为肌原纤维蛋白溶液,存放在4 ℃冰箱中,24 h 内使用。
1.6 理化特性的测定
1.6.1 汁液流失率 将鱼块在-20 ℃下冻结24 h后称重(M1),通过不同的解冻方式后,当鱼块中心温度到达0 ℃时解冻终止,将保鲜膜中的汁液倒掉,再用吸水纸将样品擦干后称重(M2)。解冻汁液流失率按照下式计算[7]:

式中:F——解冻汁液流失率,%;M1——解冻前样品质量,g;M2——解冻后样品质量,g。
1.6.2 质构 参考汪兰等[8]方法稍作修改,将解冻后的样品切成2 cm×2 cm×2 cm 的方块,测量时将样品放置在探头底座中心点,使用TA.XT Plus 物性分析仪进行质构测定。探头型号为P/50 探头,参数设定:测前速度为2.0 mm/s,测试速度为3.0 mm/s,测后速度为3.0 mm/s,压缩程度30%,压缩时间间隔5 s,压缩次数2 次。每组样品做8 个平行,测定指标包括弹性、咀嚼度和硬度。
1.7 动态流变的测定
动态流变的测定参考崔旭海等[9]的方法稍作修改。用绞肉机将鱼肉绞碎取适量均匀涂于流变仪的测试平台上,为防止水分挥发用石蜡密封。测试参数为:采用温度扫描模式,平衡样品2 min,振荡频率为1 Hz,应变0.1%,平行板间距为1 mm,升温扫描范围为20~90 ℃,升温速率为2.0 ℃/min,研究鱼肉的储能模量(弹性模量)G′和损耗模量(黏性模量)G"随温度变化的规律,每个样品做3 个平行。
1.8 热稳定性的测定
参考Cai 等[10]方法稍作修改,采用差示扫描量热仪进行测定。准确称取5~7 mg 待测样品于氧化铝坩埚中,加盖用压片机密封后,以空坩埚作对照,使用DSC 仪器进行测定。参数设定:在20 ℃恒温保持1 min,升温速度为2 ℃/min,从20 ℃加热至90 ℃结束测定。
1.9 肌原纤维蛋白构象与聚集程度的测定
1.9.1 拉曼光谱分析 将样品涂抹在载玻片中央由拉曼光谱仪测定,调节好焦距后直接进行测定,参数设定[11]:激光波长532 nm,功率120 mW,曝光时间60 s,拉曼位移波数范围为400~3 600 cm-1,每个样品取3 个点进行扫描。
1.9.2 紫外光谱分析 将样品的肌原纤维蛋白用磷酸盐缓冲溶液(20 mmol/L,0.6 mol/L NaCl,pH=6.7) 稀释至2 mg/mL,空白对照为磷酸盐缓冲溶液。常温下采用紫外分光光度计,检测波长区间范围为200~400 nm,波长间隔1 nm,扫描紫外吸收光谱。
1.9.3 内源荧光光谱扫描分析 参考Cao 等[12]的方法并稍作修改,将样品的肌原纤维蛋白用磷酸盐缓冲溶液(20 mmol/L,0.6 mol/L NaCl,pH=6.7)稀释至0.5 mg/mL。利用荧光分光光度计对其进行光谱扫描,参数设定:激发波长295 nm,发射光谱范围为310~500 nm,灵敏度为3,扫描速度为高速,激发狭缝为10 nm,发射狭缝为10 nm,每组样品扫描3 次。
1.9.4 粒径分析 使用90 Plus 纳米粒度分析仪测定蛋白质的粒径分布,将样品的肌原纤维蛋白用磷酸盐缓冲溶液 (20 mmol/L,0.6 mol/L NaCl,pH=6.7)稀释至3 mg/mL。置于比色皿中放入测量池,测定温度25 ℃,平衡时间1 min,散射角90°,波长659 nm。每组处理测定重复3 次。
1.10 水分分布状态的测定
水分分布状态分析条件及参数设定参照Li等[13]稍作修改。将解冻后的样品切成10 mm×10 mm×15 mm 的立方体并擦干表面水分放入核磁管中,采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列采集样品T2弛豫时间的信号。具体参数设定如下:测试温度为32 ℃,共振频率SFI=22 MHz,90°脉冲时间P90=14 μs,180°脉冲时间P180=28,主频SW=100 kHz,D3=80,重复时间TR=3 500 ms,模拟增益RG1=30,模拟增益RG2=3,累加次数NS=4,回波间τ=150 μs,回波个数Echocnt=8 000。每组样品做3 个平行。结果由MultiExp Inv Analysis 软件进行反演处理。
1.11 SEM 的测定
微观结构的测定参照王嵬等[14]的方法并略作修改。将鱼肉样品切成薄片(3 mm×3 mm×2 mm),并用体积分数为2.5%的戊二醛溶液固定24 h,除去固定液,再用磷酸盐缓冲液(0.2 mol/L,pH 7.2)漂洗15 min,漂洗3 次,接着用去离子水同样漂洗3 次,然后依次采用50%,70%,80%,90%的乙醇溶液梯度洗脱15 min,最后用100%乙醇脱水3次,每次15 min。接着在真空冷冻干燥机中干燥24 h。每组样品做3 个平行。真空冷冻干燥后将样品黏在样品台上,用离子溅射镀膜仪进行离子溅射镀金,然后利用扫描电镜进行扫描观察,样品放大5 000 倍拍照,电压3 kV。
1.12 数据分析
数据处理采用SPSS 软件进行相关性数据分析,试验数据是3 次重复试验的平均值,使用Excel 2010、Origin 9.1 软件作图。结果均以平均值±标准偏差表示。
2 结果与分析
2.1 理化指标的分析
2.1.1 汁液流失率分析 经过冷冻后鱼体水分生成的冰晶会破坏肌原细胞,造成机械损伤。同时经过解冻过程会加速蛋白质的变性和降解,造成汁液流失。汁液流失率是衡量肌肉持水力的常用指标之一。汁液流失不仅会导致水溶性蛋白和肌浆蛋白的流失,还会影响肉质的嫩度和组织状态[15]。一般情况下,汁液流失率越低,肌肉品质越好。不同解冻方式真鲷的汁液流失率如图1所示。由图1可知,4 种不同的解冻方式中,FT 和CFT 汁液流失率最高(1.80%和1.67%),这可能是因为解冻温度较高及解冻时间较长破坏组织结构,加速水溶性物质的流失,导致持水性下降。CMT 汁液流失率最低(1.40%),且显著(P<0.05)低于其它3 组,更有效缓解了鱼体汁液的流失。
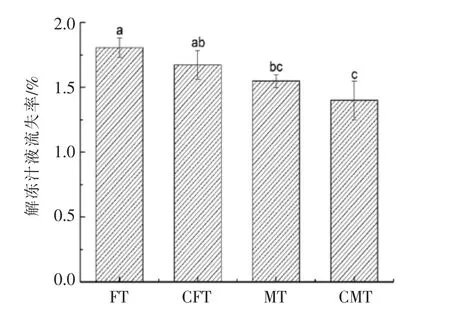
图1 不同解冻方式对真鲷汁液流失率的影响Fig.1 Effect of different thawing methods on thawing loss rate in red sea bream
2.1.2 质构分析 不同解冻方式对质构特性影响从表1可知,整体而言,测定的指标变化趋势稍有不同。FT 和MT 的硬度值均显著高于其它样品(P<0.05)。可能是由于CS@Fe3O4溶液的均匀作用使样品软化,部分FT 和MT 样品由于加热不均匀没有融化,并且肌肉肌原纤维密度增大。由此可得出CFT 和CMT 能有效且均匀地保持真鲷的硬度。贮藏24 h 后,整体硬度都呈下降趋势,且都显著低于新鲜样品(P<0.05)。咀嚼度是摸拟咀嚼和吞咽状态所需的能量,与硬度指标相同。与新鲜样品相比各解冻组咀嚼度及硬度均呈下降趋势,FT 和MT 样品的咀嚼度高于CFT 和CMT,CFT 和CMT显著低于新鲜样品(P<0.05)。这种变化主要原因可能是由于随着温度升高,肌肉组织中内源酶活性增强,导致肌原纤维蛋白水解严重。同时解冻后24 h 所有处理组的硬度和咀嚼度无明显差异,且显著低于新鲜样品(P<0.05)。弹性表示施加外力后,恢复其形变的程度。4 组方式对应的弹性无显著差异(P>0.05),其中MT 样品的弹性值最低,新鲜样品的弹性值明显高于其它4 组,CFT 和CMT的弹性值下降较缓慢与新鲜样品接近。贮藏24 h后,FT 样品的弹性值下降幅度最大且显著低于新鲜样品(P<0.05)。黏聚性是模拟表示样品内部的一种黏合力也是一种内聚力。与新鲜样品相比,各处理组的黏聚性均有所下降,其中MT 和CMT 的黏聚性高于FT 和CFT 组,而FT 黏聚性显著低于其它处理组(P<0.05)。这可能由于肌肉因温度增高受损而使细胞间结合力不断下降,组织变得疏松。从黏聚性和回复性来看,所有处理组变化较缓慢,其中FT 黏聚性显著低于新鲜样品(P<0.05),MT 组回复性显著低于新鲜样品(P<0.05)。综合来看,FT 组解冻效果最差,CMT 解冻效果最好,持水性较好,肌原纤维间结合紧密,具有较高的鲜度。
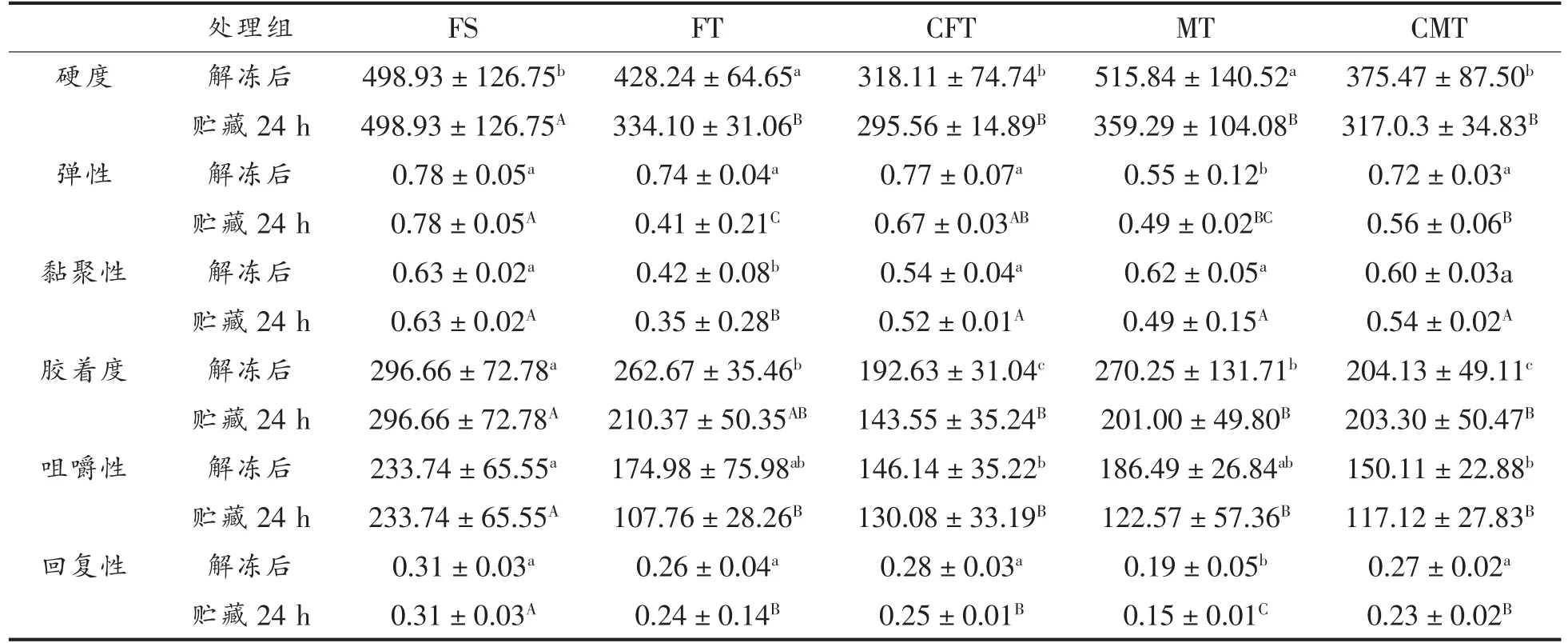
表1 不同解冻方式对真鲷质构的影响Table 1 Effect of different thawing methods on texture in red sea bream
2.2 动态流变分析
不同解冻方式处理的真鲷动态学流变特性见图2,储能模量(G′)表示结构中由弹性变形量变化而引起的能量变化,损耗模量(G")表示加热过程中黏性的变化,反映肌原纤维蛋白结构的折叠和聚集。其中,图2a 表示储能模量(G′)随温度变化的曲线图;图2b 表示损耗模量(G")随温度变化的曲线图。由图所示,所有处理组G′和G"曲线变化趋势一致,损耗模量从20 ℃开始下降,直至45~55 ℃左右结束下降。接着损耗模量继续升高直至约65~75 ℃结束升高,然后迅速下降直至90 ℃。G′在45 ℃左右达到了最低值且开始上升,是因为超过了变性温度,蛋白发生了沉淀和聚集再次形成空间网络结构。在45~55 ℃左右G′增加主要是由于肌球蛋白部分展开,蛋白质间发生相互作用,是凝胶网络结构形成的初始阶段。在70 ℃的变化是由于肌球蛋白和肌浆蛋白变性所致。温度在70~80 ℃时,肌动蛋白开始发生变性。说明肌动蛋白在凝胶网络结构的形成中起着至关重要的作用[16-17]。温度在上升到90 ℃时,FS 样品的G′是所有样品中最高的,其次是CMT,而MT 和FT 在解冻后样品中弹性较低。与新鲜样品相比解冻处理后的样品均有一定程度的蛋白质破坏。贮藏24 h 之后的4 组样品G′均下降,其中CMT 保持其弹性特征最好。而G"随温度的变化趋势与G′基本一致,FS 样品高于其它样品,其次是CMT、CFT、MT 和FT,贮藏后的样品均表现出较差的黏弹性,CMT表现出与FS 相似的相对理想黏性性能。在整个温度变化中G' 始终高于G",说明弹性成分高于黏性成分。经过CMT 处理后的肌原纤维蛋白能够形成相对较理想、较稳定的网络结构。
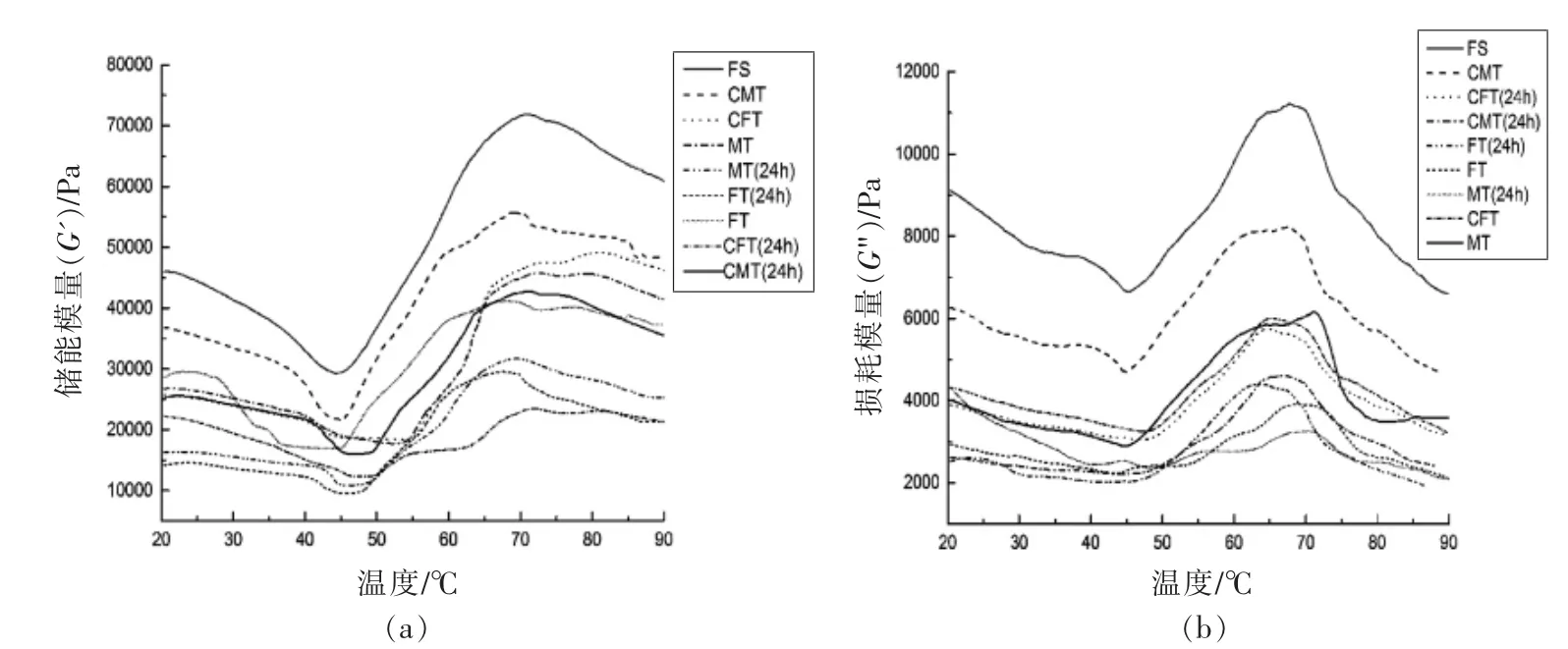
图2 不同解冻方式对真鲷弹性模量G′(a)和黏性模量G″(b)的影响Fig.2 Effect of different thawing treatments on the G′and G″ of red sea bream
2.3 DSC 分析
利用DSC 测定不同解冻方式对真鲷在加热过程中的热变性中点温度以及变性所需的焓变值(表2)。图3是肌原纤维蛋白加热过程中的DSC扫描曲线,从图可以看出在肌原纤维蛋白加热过程中有3 个吸收峰,分别代表的是肌球蛋白头部、肌球蛋白尾部和肌浆蛋白、肌动蛋白引起的热流变化。蛋白质的热稳定性是由吸热峰的相变温度和焓变值体现的,而焓变值(ΔH)是由峰面积积分得到的,表示蛋白质变性所需要吸收的热量。热力学转变温度越高,焓变值越高,蛋白质稳定性越高越不容易变性[18-19]。由表所示,所有样品的峰1 和峰3 值的焓变值大于峰2 的焓变值,说明肌球蛋白头部和肌动蛋白变性程度要大于肌球蛋白尾部和肌浆蛋白。CFT 和CMT 组的Tm和ΔH 均高于FT 和MT 处理组,其中CMT 组显著高于其它3 种处理组(P<0.05)。解冻后贮藏24 h 后,4 组处理的Tm和ΔH 值都呈现下降的趋势,其中在肌球蛋白头部、肌球蛋白尾部和肌浆蛋白的Tm值均显著低于新鲜样品(P<0.05),在肌球蛋白尾部和肌浆蛋白、肌动蛋白的ΔH 值显著低于新鲜样品(P<0.05)。MT 和FT 样品的蛋白质变性可能是由于样品温度过高、解冻时间长、蛋白质氧化或蛋白质与水的结合较弱等原因造成的。局部过热达到变性点或剧烈振荡使氢键松动可能导致部分肌球蛋白移位不稳定。结果表明,CFT 和CMT 处理后其肌原纤维蛋白溶液结构较稳定。
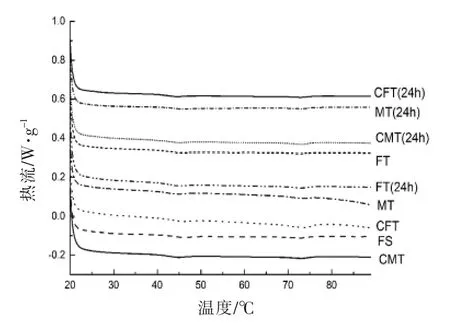
图3 不同解冻方式对真鲷DSC 扫描曲线的变化Fig.3 Effect of different thawing treatments on the DSC scanning curve of red sea bream
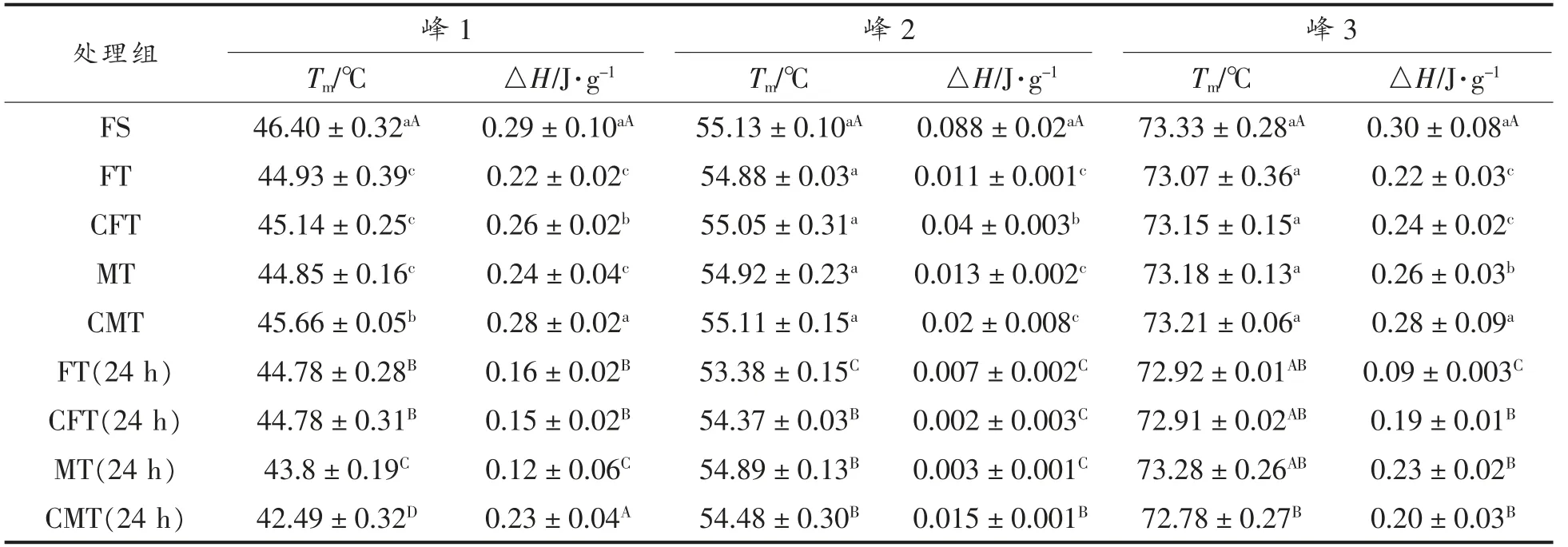
表2 不同解冻方式对真鲷热变性中点温度和热焓值的变化Table 2 Tmax and △H values obtained by different thawing treatments for red sea bream
2.4 肌原纤维蛋白构象与聚集程度的分析
2.4.1 拉曼光谱分析 酰胺I 带(1 670~1 700 cm-1)主要源于肽键C=O 伸缩振动、C-N 伸缩振动及N-H 的面内弯曲振动,通常用来评价蛋白质的主链构象以及对各蛋白质二级结构进行定量分析。利用二阶求导和去卷积对酰胺Ⅰ带进行分峰处理,再结合曲线拟合的方法,得到单个峰位信息,对比不同二级结构对应峰的峰面积,计算出不同样品蛋白二级结构的含量。酰胺I 带拉曼光谱峰的蛋白质二级结构主要由1 650~1 660 cm-1(α-螺旋)、1 660~1 665 cm-1(无规则卷曲)、1 665~1 680 cm-1(β-折叠)和1 680 cm-1附近(β-转角)等构成[20-21],其中α-螺旋代表的是蛋白质结构的有序性,无规则卷曲代表蛋白质的无序和松散结构。图5是蛋白质二级结构百分比图,各处理组表现出不同的α-螺旋、β-折叠、β-转角和无规则卷曲的含量。FS 的α-螺旋、β-折叠、β-转角和无规则卷曲的含量分别是35.69%,37.58%,3.07%和23.66%。MT,CMT,FT 和CFT 组α-螺旋含量相对于新鲜样品分别降低1.83%,1.21%,2.01%和1.22%,无规则卷曲相对增加了0.98%,0.68%,0.58%和0.72%。同时,贮藏24 h 之后的4 组样品α-螺旋含量相对于新鲜样品分别降低3.78%,3.65%,3.9%和4.64%,无规则卷曲相对增加了1.58%,2.68%,4.64%和2.12%。α-螺旋都有较大程度的减少,无规则卷曲也有较大程度的增加。因此可以得出CFT 和CMT 的α-螺旋降低较少,无规则卷曲增加较少,有利于蛋白凝胶网络结构的形成,不同程度的提高蛋白质结构的稳定性,且与蛋白热稳定性的结果相一致。
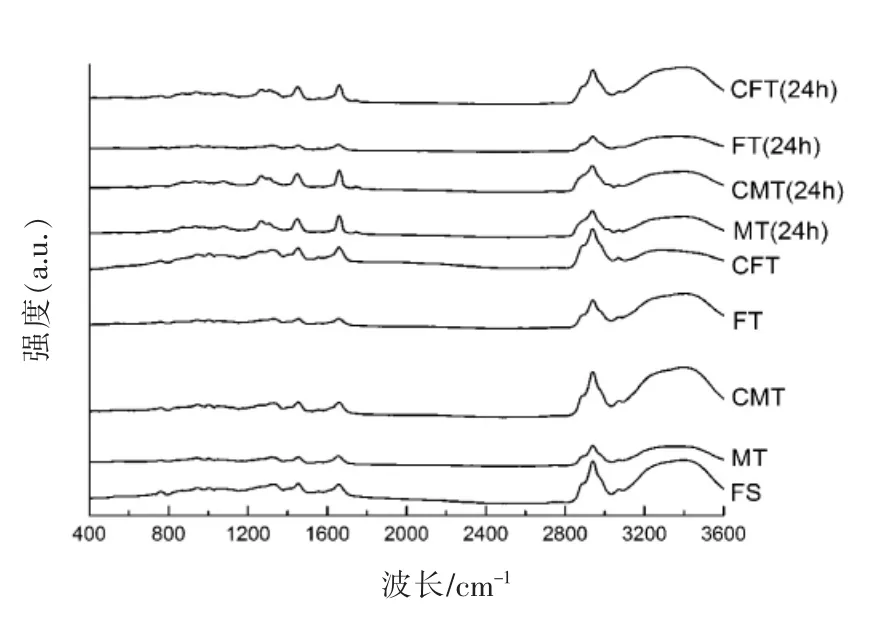
图4 不同解冻处理对真鲷拉曼光谱的变化Fig.4 Effect of different thawing treatments on the Raman spectra of red sea bream

图5 酰胺Ⅰ区蛋白质二级结构含量(%)Fig.5 Secondary structure content of myofibrillar protein from amide Ⅰregion
2.4.2 内源荧光光谱扫描分析 内源荧光光谱扫描可以反映出蛋白质三级构象的变化。通常在波长为295 nm 的条件下,以色氨酸残基被激发后其氧化程度及其微环境的变化来表征蛋白质三级构象的变化[22]。样品的肌原纤维蛋白内源荧光光谱图如图6所示。由图中的表格可看出,与新鲜样品相比,解冻后4 组的鱼肉肌原纤维蛋白的最大荧光峰位发生了红移现象(向长波方向移动),这表明色氨酸残基的微环境转移,蛋白结构发生变化,但样品间差异无统计学意义(P≥0.05),说明解冻处理对蛋白质三级结构的影响与FS 相比均不显著。4 组解冻处理组之间的荧光强度无显著性差异(P≥0.05),且与鲜样相比也无统计学意义(P≥0.05),且CFT 和CMT 的荧光强度与新鲜样品较相近。在贮藏24 h 后,4 组都显示非常低的荧光强度且显著低于新鲜样品(P<0.05),这意味着蛋白分子展开使活性基团暴露致使分子间作用力增强,色氨酸残基出现荧光猝灭现象荧光强度下降。结果表明,CFT 和CMT 组与FT 和MT 组相比能降低真鲷肉蛋白质的变性程度。
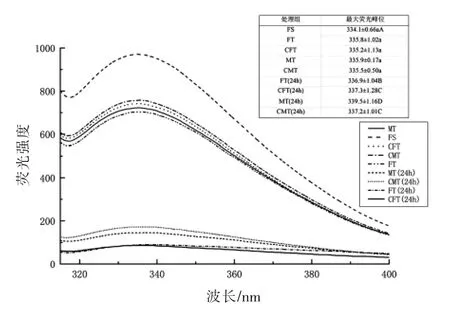
图6 不同解冻方式对真鲷肌原纤维蛋白内源荧光光谱图Fig.6 Intrinsic fluorescence spectra of myofibrillar protein from red sea bream by different thawing methods
2.4.3 紫外光谱分析 紫外吸收二阶导图谱可以用来反映氨基酸残基微环境的变化和蛋白质三级构象的变化。一般来说,环境极性增大吸收峰向短波长方向移动,称为蓝移,环境极性减少吸收峰向长波方向移动,称为红移[23]。通过计算两个峰顶与峰谷距离的比值r=a/b 来判断酪氨酸残基所处的微环境变化进而反映蛋白质三级结构的变化[24]。由图7所知,光谱上有两个正吸收峰(287 nm 和296 nm) 和两个负吸收峰 (282 nm 和293 nm)。与FS 相比,处理组在296 nm 处的峰有明显的红移,说明经过冷冻和解冻之后蛋白分子展开,蛋白变性开始,此结果与内源荧光光谱相一致。从图中的表格可以看出,CFT 和CMT 的r 值与FS无显著性差异更为接近,MT 和FT 的r 值小于FS,说明蛋白质中可能存在一定的聚集。在贮藏24 h 后,4 组处理组r 值均显著低于FS,说明蛋白质氧化程度高,聚集程度大。由内源荧光光谱和紫外吸收光谱均表明,MT 和FT 处理对色氨酸和酪氨酸的微环境影响较大,CFT 和CMT 处理组可减缓蛋白质氧化,蛋白三级构象较稳定。
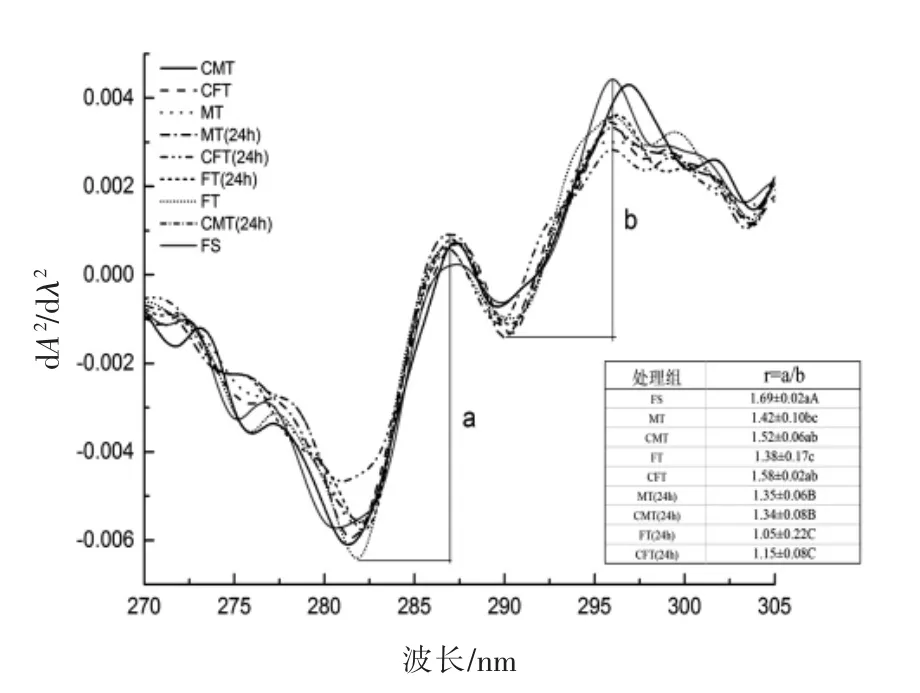
图7 不同解冻方式对真鲷肌原纤维蛋白紫外光谱图Fig.7 UV second derivative spectra of myofibrillar protein from red sea bream by different thawing methods
2.4.4 粒径分析 蛋白质的粒径能够直观的表现出蛋白质的结构和聚集程度,影响着蛋白质的功能特性。也可以通过粒径峰值来评价粒径强度分布。粒径峰值越高,分布越小,粒径越均匀[25]。由图8a 所示,FS、CST 和CFT 的粒径分布峰值均高于其它样品,且均较其它样品更薄,且有效粒径值均较小,其中FS 和CFT 有效粒径显著低于其它处理组(P<0.05),说明CFT 和CMT 处理可抑制蛋白聚集,稳定性较好。由图8b 结果表明,经过贮藏24 h 后的样品,CST 和CFT 的粒径分布峰值保持较高但4 组的有效粒径值呈增加的趋势,且显著高于鲜样(P<0.05),出现了严重聚集现象,降低了系统的稳定性。
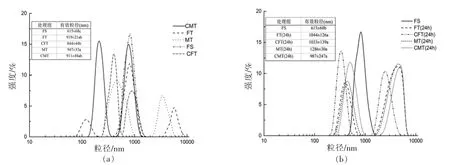
图8 不同解冻方式对真鲷肌原纤维蛋白粒径变化Fig.8 Particle diameter of myofibrillar protein in red sea bream treated by different thawing methods
2.5 水分分布状态分析
通过低场核磁共振技术分析真鲷肌肉中水分的分布和迁移情况。弛豫时间(T2)间接用来表征水分的自由度,T2时间越短表明水分H 质子自由度越小,其受到的束缚越大,反之,水分H 质子受到的束缚越小,表明水分越自由,对应的T2弛豫时间就越长。相同弛豫时间里对应的弛豫峰面积可以表示对应水量的多少[26]。在T2图谱上,可以看出T2在0~1 000 ms 内出现4 个特征峰,分别表示强结合水(T2b),弱结合水(T21),不易流动水(T22)和自由水 (T23),对应的4 个峰的峰面积分别记为P2b,P21,P22和P23。
本试验就不易流动水和自由水的峰比例进行分析,由表3可知,MT、CMT、FT 和CFT 的P22和P23分别为89.11%,89.75%,87.80%,88.38%和5.69%,5.27%,7.10%,7.08%。可以明显看出,经过冷冻和解冻后,与新鲜样品相比解冻后样品的不易流动水的峰面积占比逐渐降低,自由流动水的峰面积占比逐渐升高。其中FT 最低且显著低于其它3 组,MT、CFT 和CMT 与鲜样最为接近。这是因为在解冻过程中,通过冰晶的作用导致水与蛋白质分子之间的作用力降低,不易流动水向自由水转化,导致汁液流失率增高,持水性低。同理,贮藏24 h 后,P22降低且P23升高,CMT 样品中不易流动水占比降低缓慢,说明不易流动水含量相对较高,持水性较好。
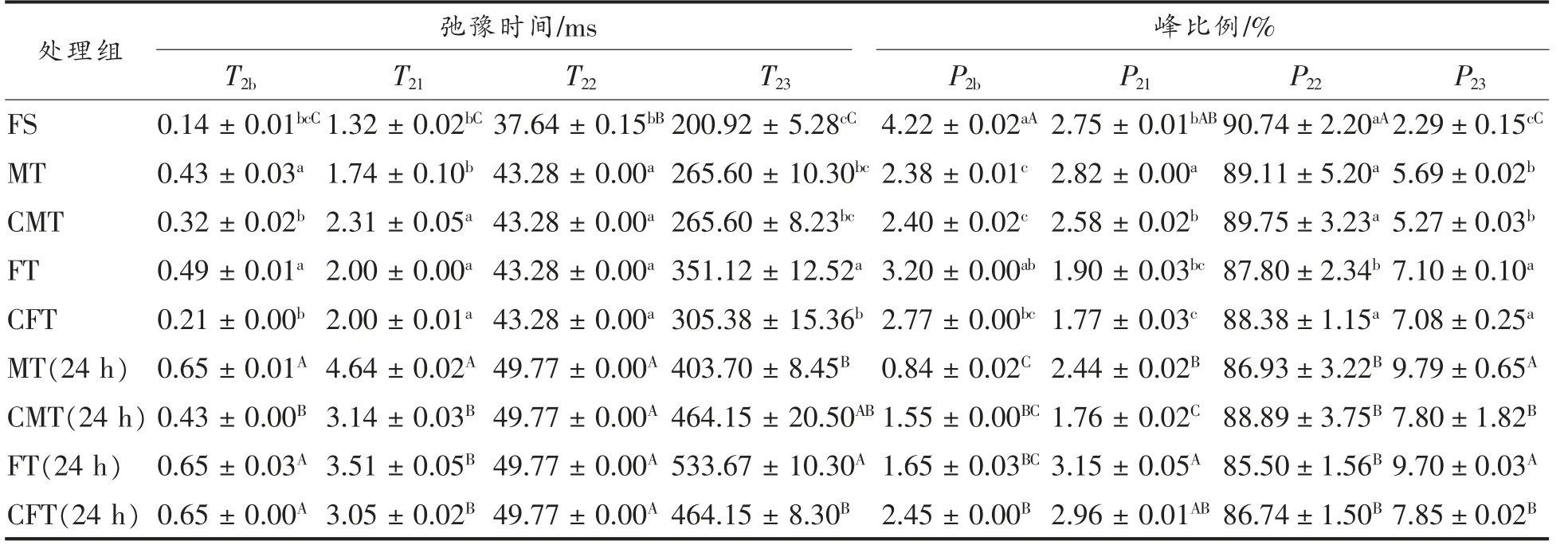
表3 不同解冻处理对真鲷弛豫时间和峰比例的影响Table 3 Effect of different thawing treatments on the T2 transverse relaxation time and peak scales of red sea bream
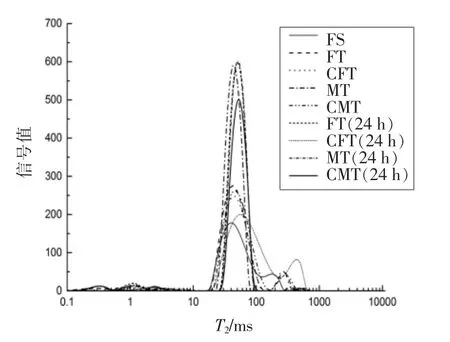
图9 不同解冻方式对真鲷水分迁移的影响Fig.9 Effect of different thawing treatments on moisture migration in red sea bream
2.6 SEM 分析
不同解冻方法对真鲷微观结构的影响如图10所示。新鲜的真鲷样品肌纤维排列整齐且间隙紧密、一致,肌内膜和肌束膜结构完整。经冷冻解冻后,肌肉组织在电镜下呈现不同程度的劣变,FT和MT 组的肌原纤维在电镜下呈现出明显的收缩,直挺的肌纤维结构出现沟渠和松散,肌肉组织肌纤维排列发生明显分层。CFT 和CMT 解冻后,鱼肉组织肌束间隙稍有增大,肌纤维有断裂现象,但其结构排列与对照组最为接近。在冷藏24 h后,各组肌肉的组织结构发生了更大程度的劣变,出现脱节和纤维断裂现象,肌肉的肌节可能会发生聚合或收缩,加速了间隙的增大[27-28]。肌纤维结构出现更明显的断裂和分层,说明蛋白质发生氧化和变性现象同时导致汁液流失严重,肌肉组织的完整性遭到严重破坏,使肌肉失去完整的微观结构。

图10 不同解冻方式对真鲷微观结构的影响Fig.10 Effect of different thawing treatments on the microstructure of red sea bream
3 结论
本文主要研究了4 种不同解冻方式对真鲷处理后,其肌肉理化性质、肌原纤维蛋白氧化程度和构象以及水分分布的影响。得出如下结论:首先,在肌肉理化特性的分析中,CMT 处理的汁液流失率最低,持水性较好,并且能有效保持鱼肉硬度、弹性以及黏聚性。其次,在蛋白质构象分析中,通过动态流变得出CMT 表现出与FS 相似的相对理想黏性性能,能够形成相对较理想、稳定的网络结构。DSC 分析中得出CFT 和CMT 处理后其肌原纤维蛋白溶液结构较稳定,拉曼光谱结果显示CFT和CMT 的ɑ-螺旋降低较少,无规则卷曲增加较少,不同程度的提高蛋白质结构的稳定性。内源荧光光谱和紫外吸收光谱结果相一致,CFT 和CMT处理组与FT 和MT 处理组相比可减缓蛋白质氧化,蛋白三级构象较稳定。同时利用粒径对蛋白聚集和氧化程度进行分析,CFT 组有效粒径较小,系统稳定性较强。最后,在微观结构及水分分布迁移分析后得出,CFT 和CMT 与新鲜样品最为接近,结构较为紧密有序,肌纤维断裂现象不明显。CMT组遭受冰晶的破坏程度较低,持水性较强。
