异蛋白复合凝聚研究进展
2022-01-10张延镇彭舒悦郭前婉方亚鹏
张延镇,彭舒悦,王 琪,郭前婉,赵 萌*,方亚鹏
(1 湖北工业大学 湖北省食品胶体国际科技合作基地 武汉 430068 2 上海交通大学农业与生物学院 上海 200240)
复合凝聚,又称结合型相分离,是基于两种带相反电荷的聚电解质在同一溶剂中,因静电吸引发生去溶剂化,而形成的两相体系,即富含聚电解质的凝聚相和与之对应的贫瘠相,两相在平衡状态下均含有两种聚电解质,只是凝聚相浓度高于贫瘠相[1]。参与凝聚过程的物质可以是胶体、表面活性剂或聚合物[2-4]。其中,蛋白-多糖体系是食品中典型的复合凝聚体系,广泛存在于自然界和食品中[5],目前已应用于食品质构的设计与控制[6-7]、功能因子递送[1,8]、蛋白或多糖纯化[9-10]、可食性膜制备[11]等方面。
与传统的蛋白/多糖复合凝聚体系不同,两种荷电蛋白间的复合凝聚可显示独特的凝胶、乳化、配体结合等功能特性[12],使其在生物活性分子荷载、食品精细结构设计等领域具有独特的优势。本文综述了异蛋白复合凝聚的特点、典型体系、影响因素及其在食品中的应用,并展望异蛋白复合凝聚的发展方向和食品中的应用。
1 异蛋白复合凝聚概述
1.1 异蛋白复合凝聚的定义及特点
异蛋白复合凝聚发生于两种带相反电荷的蛋白间。调节体系pH 值至两种蛋白等电点之间,使两种蛋白分别带正电和负电,即可诱导异蛋白间发生复合凝聚。此外,蛋白表面电荷分布具有非均一性,带相同电荷的异蛋白间有时也可发生复合凝聚。根据蛋白等电点(pI),将蛋白划分为酸性蛋白、碱性蛋白两类,其中pI 大于7 的蛋白质为碱性蛋白,反之为酸性蛋白[13]。一般来说,异蛋白复合凝聚研究大都选择一种酸性蛋白和一种碱性蛋白,这是为了在较大的pH 值范围发生稳定的复合凝聚,有利于研究复合凝聚发生机制和复合物特性,同时可展开相关应用研究。
通过调控pH 值、离子浓度、蛋白浓度、混合比例等条件,可使异蛋白发生复合凝聚,形成凝聚体或凝聚微球。与蛋白/多糖体系相比,异蛋白复合凝聚体系有以下特点:1) 只有在较窄的pH 值、离子浓度、蛋白浓度、混合比例等条件下才能观察到复合凝聚物;2)对pH 值、离子浓度变化极其敏感,驱动力除静电相互作用外,还有偶极吸引和疏水相互作用[14];3)异蛋白复合凝聚自组装遵循电荷和尺寸补偿原理[15]。目前,由于蛋白结构和种类的复杂性,异蛋白复合凝聚还没有普适的作用模型和作用力分析。需要说明的是:本文仅对等电点相差较大的酸性、碱性蛋白进行归纳总结,其等电点相距较近的蛋白间的复合凝聚不在本文讨论范围。
1.2 典型异蛋白复合凝聚体系
异蛋白复合凝聚研究一般涉及两种蛋白:酸性蛋白和碱性蛋白。食品中常见的酸性蛋白主要有:α-乳白蛋白、β-乳球蛋白、酪蛋白、卵白蛋白、卵转铁蛋白等。而碱性蛋白种类相对较少,主要有乳铁蛋白(LF)、溶菌酶(LYS)和A 型明胶(GEA)。本文归纳总结了以乳铁蛋白、溶菌酶和A 型明胶3 种碱性蛋白为基础的异蛋白复合凝聚体系。
1.2.1 乳铁蛋白 乳铁蛋白是一种哑铃状铁结合的糖蛋白,由41%的α-螺旋和24%的β-折叠组成,由17 个二硫键稳定其三级结构,其分子质量约为83 ku,pI 值为8.68.9;脱铁后LF 柔韧性变好,更易于热变形和酶促降解[16]。如表1所示,LF可与β-乳球蛋白(BLG)、酪蛋白(CN)等形成异蛋白复合凝聚物。此外,牛奶中的LF 和骨桥蛋白间存在相互作用,可协同提高机体免疫[17-18]。
1.2.2 溶菌酶 溶菌酶是一种球状蛋白,可水解细菌细胞壁多糖,具有抑菌功效。结构中包含129个氨基酸,由39%的α-螺旋和11%的β-折叠组成,分子质量为14.3 ku,pI 值为10.7[19]。如表1所示,LYS 和α-乳白蛋白(α-LA)之间的复合凝聚是文献报道最多的体系。现有研究探讨了LYS-α-LA 复合凝聚对pH 值、离子浓度、蛋白质浓度、温度和蛋白质柔韧性的依赖性及其凝聚机制[14,36-43]。此外,也报道了LYS 与BLG、牛血清蛋白(BSA)、卵白蛋白(OVA)等蛋白间的复合凝聚[15,33,35-36,44-59]。
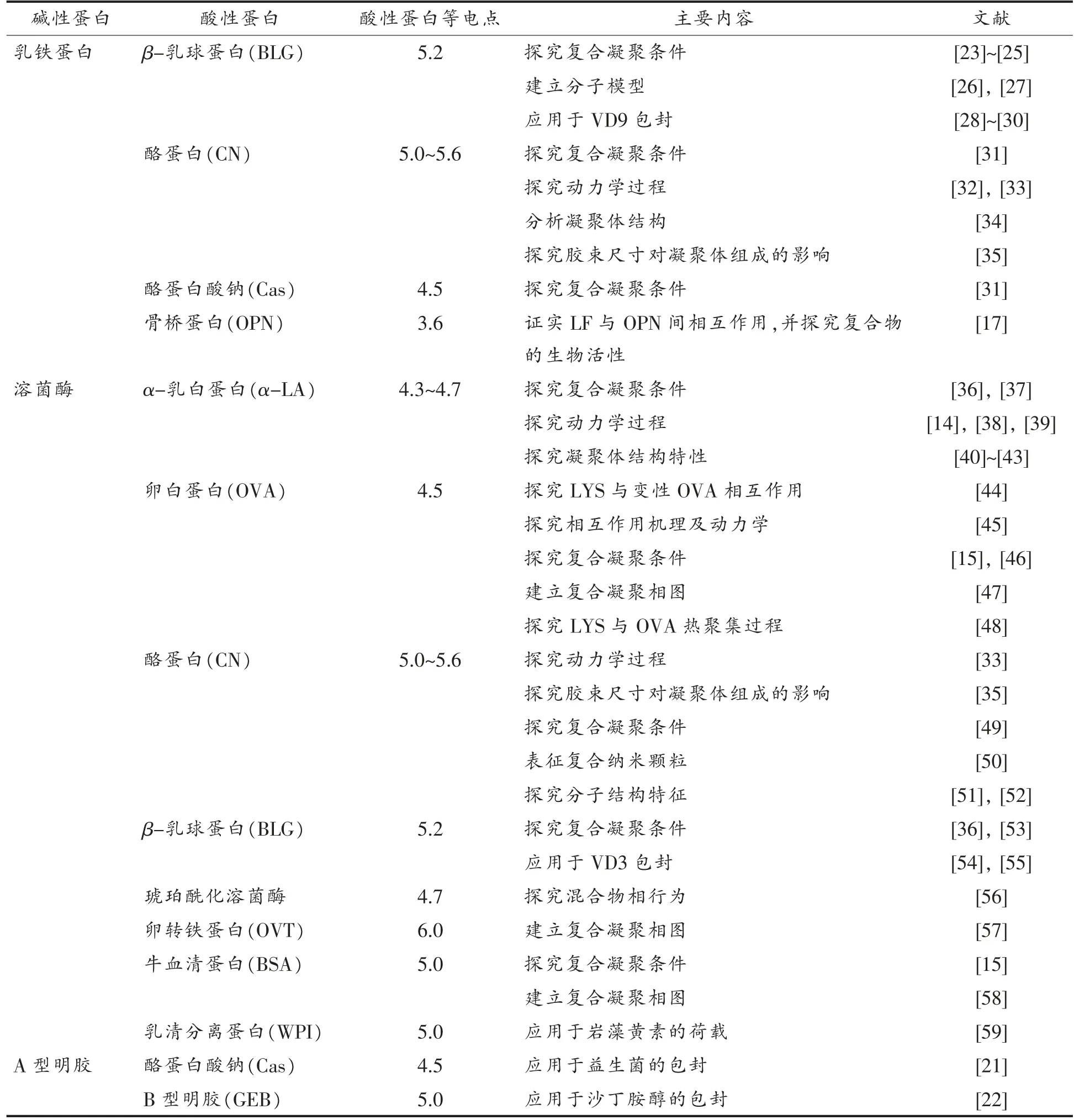
表1 典型异蛋白复合凝聚体系Table 1 Typical coacervated heteroprotein systems
1.2.3 A 型明胶 明胶是胶原蛋白水解物,可分为A 型明胶(GEA)和B 型明胶(GEB)两类,其分子质量自15~250 ku(千道尔顿)不等,随水解程度的不同而变化[20]。GEA通过酸水解胶原蛋白处理得到,pI 值为8~9,也是一种典型的碱性蛋白。目前,关于GEA参与的复合凝聚体系相对较少。Zhao 等[21]利用GEA-Cas 复合凝聚微球成功包埋益生菌,有效提升了益生菌在贮藏、消化及加热过程中的存活率。Tiwari 等[22]将GEA-GEB复合凝聚体应用于沙丁胺醇(Salbutamol)的包封。
2 影响异蛋白复合凝聚的因素
蛋白质是两性电解质,两种物质带相反电荷时即发生静电相互作用。pH 值、离子浓度、温度、混合比及蛋白浓度等因素影响其复合凝聚过程。
2.1 pH 值
异蛋白复合凝聚主要驱动力来源于静电相互作用,通过调节pH 值可对蛋白侧链基团的解离度进行调控,从而改变蛋白所带荷电性与电荷量。pH 值对异蛋白复合凝聚过程至关重要。目前,有文献报道了pH 值对LF-BLG、LYS-BSA、LYSOVT、GEA-Cas 等异蛋白复合凝聚体系的影响。
对于LF-BLG 体系,BLG 在其等电点附近会自聚集,从而干扰或掩盖LF-BLG 复合凝聚。Yan等[23]研究发现,LF-BLG 复合物在pH 5.7~6.2 范围形成,最佳pH 值为6.0;在pH 值低于6.0 时,BLG 自聚集与LF-BLG 复合物竞争,形成较大的无定型聚集体,导致溶液中游离的BLG 降低,LFBLG 凝聚体消失。Anema 等[24]利用浊度滴定法证实LF-BLG 可在5.3<pH<7.3 时发生复合凝聚。Tavares 等[25]研究发现,LF-BLG 在5.50<pH<6.00时形成复合凝聚微球,而在5.00<pH<5.25 时形成不规则复合凝聚体。上述研究中,LF-BLG 的复合凝聚pH 值范围有一定差异,这是由于选取的蛋白浓度和BLG 样品来源不同所致。
LYS-BSA 复合凝聚体系深受pH 值影响,以BSA∶LYS=1∶2 为例,其复合凝聚过程可分为4 个区域:当2.0<pH<4.0 时,体系呈净正电荷,蛋白质分子间相互排斥,浊度不变;当4.0<pH<7.5 时,可溶性复合物形成且以低密度存在于体系中,浊度呈现缓慢增加趋势;当7.5<pH<11.0 时,浊度显著增加,标志着不溶性复合物的形成;当11.0<pH<12.0 时,在静电排斥力的作用下复合物解离,浊度降低[58]。类似地,LYS-OVT 复合凝聚过程也被划分为4 个区域[57]。Zhao 等[21]固 定GEA∶Cas=1∶1,在pH 5.0 时体系形成复合凝聚物沉淀;pH 5.5 时形成液态复合凝聚微球;pH=6.0 和pH=6.5 时形成可溶性复合物。以上研究表明,pH 值除影响蛋白电荷量外,还决定复合凝聚物的稳定范围及最佳形成条件。
2.2 离子浓度
离子浓度(I)对高分子间的作用力具有较强的调节作用,该作用力主要由短程吸引、远程排斥协同支配。高离子浓度条件下,短程吸引及远程排斥均被减弱或屏蔽;低离子浓度条件下,远程排斥被屏蔽而短程吸引不受影响,有利于复合物的形成[60]。
不同的异蛋白复合凝聚物对离子浓度的响应不同。LF-BLG 体系的临界解离离子浓度为20~100 mmol/L[23-24]。LYS-BSA、LYS-OVA 复合凝聚物对离子浓度更为敏感,临界解离离子浓度为10~20 mmol/L[15,58];LYS-CN 复合凝聚物能够抵抗相对较高的离子强度(80~100 mmol/L),其中,LYS-β-CN 复合物在离子浓度高于500 mmol/L 时被明显抑制[33,35,49]。
提高蛋白浓度可适度改善复合凝聚体系对离子浓度的敏感性。LF-β-CN 体系在总蛋白质量分数为0.1%时复合物在I>25 mmol/L 时解离,溶液变澄清[32];当总蛋白质量分数为1%时,LF-β-CN复合物在I=400 mmol/L 时依然存在[31]。另外,当总蛋白质量浓度分别为1 g/L 和10 g/L 时,相同物质的量的LYS-琥珀酰化LYS 复合凝聚物的临界解离离子浓度分别为20 mmol/L 和800 mmol/L[56]。
离子类型对复合凝聚物的影响存在差异。Nigen 等[41]对LYS-α-LA 体系研究时发现:1)I<100 mmol/L(Na+)时,LYS-α-LA 可自组装形成微球;2)复合凝聚微球具有较好稳定性,I>250 mmol/L(Na+)时,仍能保持结构的完整性;3)与Mg2+、Na+相比,Ca2+更易破坏所形成的微球结构。
2.3 温度
异蛋白复合物粒径大小及多分散性系数(PDI)分布表现出温度、时间依赖性。Monteiro 等[37]发现,LYS-α-LA 复合物粒径及PDI 随温度升高(25~75 ℃)而降低,在温度高于50 ℃时,复合物粒径及PDI 随加热时间的延长而增大。Pan 等[50]将LYS-β-CN 复合物溶液进行高温热处理(80 ℃、30 min)后得到单分散的纳米颗粒,其粒径及PDI 较未热处理时的复合物均有所降低。此外,温度变化可导致复合物呈现不同的超分子结构。LYS-α-LA在pH 7.5,5 ℃条件下形成不规则聚集体,而在45℃条件下形成微球型复合物[43],且不规则聚集体在温度提高后能够重组为凝聚微球[38,40]。
2.4 混合比例
混合比例决定异蛋白复合凝聚的程度,这一过程与pH 值紧密相关,不同的混合比例所对应的复合凝聚最适pH 值不同,最终可导致复合物的组成存在差异[1]。Anema 等[24]在探究LF-BLG 复合凝聚过程时发现,随着体系中LF/(LF+BLG)比例增加,最适复合凝聚所需pH 值升高,其在最适复合凝聚条件下形成的复合凝聚物的组成固定,即LF-BLG 物质的量比约为1∶3。Yan 等[23]通过固定体系pH 值为6.0,发现凝聚物中LF-BLG 物质的量比随体系中LF-BLG 质量比的降低而降低,在质量比为1∶1 时,体系获得最大凝聚效率,所对应的LF-BLG 物质的量比约为1∶4。类似的,Tavares 等[25]在pH 5.5 条件下发现,随初始溶液中LF-BLG 物质的量比的降低,凝聚物中LF-BLG 物质的量比在1∶4 至1∶8 间变化。此外,Nigen 等[43]研究了LYS/α-LA 物质的量比例对凝聚物中α-LA 回收率的影响:当LYS/α-LA 物质的量比<1.0时,凝聚体中α-LA 回收率与物质的量比呈线性增加趋势;当物质的量比为1.0 时,凝聚体中最大α-LA 回收率达70%;进一步增加比例,α-LA 的回收率几乎不变。
2.5 蛋白浓度
蛋白浓度也是复合凝聚物形成的影响因素。Yan 等[23]在pH 6.0 条件下对不同浓度的LF-BLG体系进行离心,结果发现质量浓度为40 g/L 时体系获得最大凝聚效率,高于此质量浓度,BLG 自聚集与LF-BLG 复合物竞争导致复合凝聚效率降低;总蛋白质量浓度低于10 g/L 时,无法观察到复合凝聚物,这一结果与Tavares 等[25]的研究基本一致。
3 异蛋白复合凝聚在食品中的应用
3.1 小分子活性成分的荷载
维生素是机体维持正常生理功能的一类微量有机物质,在人体的生长、代谢、发育过程中发挥着重要的作用,而在生产加工过程中,维生素因极端pH 值、光照、加热等条件而降解,导致生物利用率低[61]。基于异蛋白复合凝聚,Chapeau 等[28]制备了含VB9的LF-BLG 复合物,其荷载量高达6~16 mg/g(VB9/蛋白)。在稳定性试验中[29],未经凝聚体包封的VB9,在模拟紫外照射48 h 后含量降低了90%,而在复合物包封下的VB9含量仅降低了50%。通过H2O2加速氧化降解18 h,包封与未包封的VB9分别降低20%,75%;另外,含VB9的LF-BLG 复合物可应用于规模化生产[30]。类似地,Diarrassouba 等[54-55]利用LYS-BLG 复合凝聚微球成功包封VD3,且通过大鼠喂食试验证实体系包封下的VD3生物利用度提高。
岩藻黄质(fucoxanthin,FX)是存在于可食性棕褐色海草中的类胡萝卜素,结构中含有烯键、环氧基团和多烯链共轭羰基,具有抗炎作用、抗氧化等功效[62-63],与维生素类似,对光照、加热等条件敏感。研究表明,FX 可通过非共价相互作用与WPI自发形成纳米复合物,随后与LYS 凝聚,荷载率达(82.36±3.85)%;对WPI-FX、WPI-FX-LYS 两组样品分别进行加热、储藏稳定性试验,结果表明经WPI-LYS 包封的FX 稳定性最佳,其在两项试验中分别保留了74.4%,63.4%;而WPI-FX 仅保留20.9%,27.8%[59]。
沙丁胺醇(Salbutamol)是一种选择性的肾上腺素受体激动剂,可缓解哮喘、慢性气道疾病引起的支气管痉挛[64]。Tiwari 等[22]通过pH 诱导GEAGEB相互作用形成复合凝聚体,用于封装沙丁胺醇,结果表明:在GEA-GEB浊度开始上升之前,将沙丁胺醇添加至体系中,具有更高的包封率及释放率;在模拟胃液消化试验中,发现药物的体外释放动力学具有双相性,在开始的10 h 内,沙丁胺醇释放速度迅速上升至最大值 (10 h 内释放约10%),随后40 h 以最大释放速度在体外释放。以上研究证实异蛋白复合凝聚体系在小分子活性成分荷载方面具有良好的应用前景。
3.2 益生菌的包埋保护
益生菌在维持肠道菌群平衡,调节血糖平衡,改善肠易激综合症等方面效果显著[65],被广泛应用于食品、药品等行业。益生菌对环境敏感、容易死亡,微囊化是改善这一问题的有效手段[66]。Zhao等[21,67]采用异蛋白复合凝聚和蛋白/多糖复合凝聚两种形式,构建含益生菌的GEA-Cas 和GEA-GA(阿拉伯胶)复合凝聚体系,结果表明:GEA-Cas 微囊中的益生菌在模拟胃肠液、常温贮藏和热处理过程中存活率显著提升,与构建的GEA-GA 微囊相比,益生菌在模拟胃液、肠液、热处理条件下存活率分别提高了2.06,0.47,1.58 lg(CFU/g)。与蛋白/多糖复合凝聚体系相比,异蛋白复合凝聚体系可降低微囊的吸湿性和润湿性,减缓益生菌微囊在胃肠液中的崩解速率。综上,作为一种新的益生菌包埋体系,异蛋白复合凝聚体系保护效果显著。
3.3 蛋白的分离纯化
复合凝聚过程中蛋白质间相互作用具有选择性,可通过调节理化参数来分离目的蛋白。BLG 存在两个亚型:BLGA和BLGB,两者间仅存在两个氨基酸的差异,其等电点分别为5.1,5.2。Tavares 等[25]对LF-BLGA、LF-BLGB、LF-(BLGA+BLGB相同物质的量)3 种复合凝聚体进行定量分析,结果发现:在pH 5.5 条件下凝聚体中LF 的回收率范围分别为:75%~82%,2%~6%,45%~55%,可通过LF 的选择凝聚作用分离凝聚相中的BLGA和贫瘠相中的BLGB。此外,Pathak 等[68]研究表明,当GEBBSA-BLG 以质量比1∶1∶0.75 的比例存在于溶液中,调控体系pH 值至其共同的等电点(pH 5.0±0.02),因蛋白表面电荷的不均一性,故GEB可选择性地与BSA 分子发生复合凝聚。这使得GEBBSA 复合凝聚体富集于凝聚相中,而贫瘠相中主要含有BLG 分子,最后用体积分数35%的乙醇分离凝聚体中BSA 分子,所得回收率为40%。这些研究对异蛋白复合凝聚体系应用于蛋白分离纯化提供了新的思路。
3.4 乳液稳定
基于复合凝聚,异蛋白间可自组装成纳米颗粒,其可应用于皮克林乳液的稳定。Wei 等[57]在OVT/LYS=8、pH 9.3 条件下制备单分散、润湿性适中的纳米颗粒,其在含量2%条件下可稳定高内相乳液(油相分数为0.75),该乳液在室温储藏30 d后,乳液无明显分层现象。在模拟胃肠液试验中,皮克林乳液具有较大的界面面积,与空白样品相比,该乳液的脂解程度由32.1%提至71.5%。此外,悬浮于乳液内相中的姜黄素生物利用率由16.1%提至38.3%。该研究在乳液稳定方面提供了一种新的思路,也提供了一种疏水性活性成分输送壁材。
4 结语
蛋白作为关键的食品组分,常常多种蛋白混合共存于蛋制品、乳制品、肉制品、蛋白饮料等各类食品中,发挥稳定、增稠、乳化、发泡、凝胶化、调节冰晶生长等功能,同时赋予产品特定的质构、风味、营养特征。深入了解异蛋白复合凝聚,对食品质构调控、食品功能因子荷载、食品配料复合等领域具有重要意义。目前,异蛋白复合凝聚研究处于起步阶段,其复合凝聚热力学、动力学、结合模型等机制需进一步研究。另外,异蛋白复合凝聚在食品中的应用需进一步挖掘,如改善起泡性、膜特性、凝胶特性等食品功能,荷载递送更多功能因子或风味成分。
