副干酪乳杆菌L9缓解抑郁大鼠腹泻的作用机制
2022-01-10陈善斌邢寒竹任发政王希璠
陈善斌,邢寒竹,王 然,任发政,王希璠*
(1 中国农业大学食品科学与营养工程学院 北京 100083 2 齐鲁工业大学(山东省科学院)食品科学与工程学院 济南 250353 3 中国农业大学营养与健康系 北京 100083)
据世界卫生组织统计,抑郁症患者数量高达3.22 亿,是全球最大的疾病负担之一[1]。抑郁症病人不仅遭受精神上的折磨,还伴随着躯体症状,其中就包括胃肠道症状。据报道,高达93.5%抑郁病人有胃肠道症状,其中42.3%为腹泻症状[2-3]。亚临床抑郁症患者腹泻的发生风险是正常人的2 倍[4]。改善胃肠道症状,对于抑郁症的治疗具有非常重要的意义。
抑郁与腹泻共病具有其生理基础。抑郁症的一个重要风险因素是应激,而应激会影响胃肠道动力,增加胃肠道疾病的发生风险[5-6]。研究表明,应激会刺激肠道细胞分泌5-羟色胺(5-HT),作用于5-HT3 和5-HT4 受体,导致结肠蠕动加快[7]。5-HT 受体功能异常可能是抑郁病因[8]。5-HT 受体可能是治疗抑郁病人胃肠道症状的重要靶点。
益生菌是公认的肠道功能调节剂,能够有效缓解腹泻症状。如鼠李糖乳杆菌JB-1 对应激诱导的腹泻具有缓解作用,可使肠道蠕动恢复到正常水平[9]。然而,益生菌对抑郁并发腹泻的缓解作用仍有待研究。副干酪乳杆菌L9(Lactobacillus paracasei L9,L9) 是一株分离自长寿老人肠道的益生菌,具有调节肠道菌群,调节免疫,缓解过敏反应等功能[10-11],并且L9 可以调节肠道蠕动[12]。本研究的目的是探究L9 对慢性应激诱导的抑郁大鼠腹泻症状的缓解作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性Wistar 大鼠,6 周龄,体重180~200 g,购自北京维通利华实验动物技术有限公司。动物实验室恒温(22±2)℃,恒湿(50%~60%),每12 h 昼夜交替。所有大鼠自由饮水采食。
1.1.2 试验菌株 副干酪乳杆菌L9,保藏于中国普通微生物菌种保藏管理中心,保藏号为CGMCC No.9800,菌粉由中国农业大学益生菌研究中心提供。
1.1.3 试剂 蔗糖,国药集团化学试剂有限公司;胭脂红、甲基纤维素,阿拉丁试剂(上海)有限公司;TRIzol 试剂,美国Life Technologies 公司;5×All-In-One RTMasterMix,加拿大Applied Biological Materials 公司;SYBR Premix Ex Taq,日本TaKaRa Biotechnology 公司。
1.1.4 仪器 旷场试验分析系统 (含SuperMaze软件),上海欣软信息科技有限公司;全自动血液细胞分析仪RT-7200,雷杜生命科学股份有限公司;LightCycler 96 定量PCR 仪,瑞士罗氏分子系统公司。
1.2 方法
1.2.1 动物试验 实验动物适应1 周后,随机分为2 组,CMS 组18 只,对照组9 只。CMS 组大鼠进行慢性温和应激(Chronic Mild Stress,CMS)处理5 周,单笼饲养;对照组分笼饲养,每笼3 只,不做应激处理;随后进行糖水偏好试验(Sucrose Preference Test,SPT)、强迫游泳试验(Forced Swimming Test,FST)、旷场试验(Open Filed Test,OFT)和排便试验,并采血用于检测血常规。干预前将CMS 组大鼠随机分成CMS-L9 组和CMSNS 组,每组9 只。第6 周开始,CMS-L9 组每只大鼠每天灌胃1 mL 1×1010CFU/kg bw L9,CMS-NS组和对照组每天灌胃等体积生理盐水,持续4 周;干预结束后进行排便试验。每周称量实验动物体重。试验结束后,将大鼠用乙醚麻醉,眼内眦采血用于检测血常规,颈椎脱臼处死,解剖,取结肠用生理盐水冲洗后保存于-80 ℃。
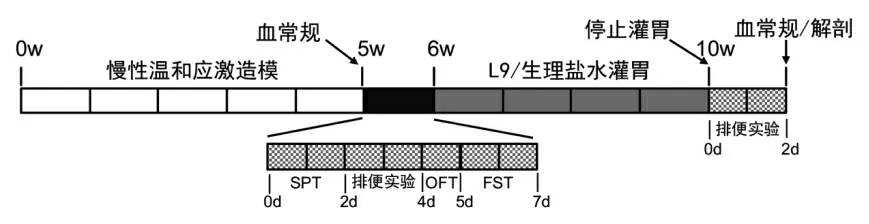
图1 试验流程Fig.1 Experimental flow graph
1.2.2 慢性温和应激 慢性温和应激操作参考黄春霞[13]的方法。应激期间每天施加1~2 种应激因子,应激因子随机选择,每天施加应激因子的时间不固定。应激因子包括夹尾、冷水浴、禁水、昼夜颠倒、禁食、合笼、潮湿垫料、空瓶刺激、热水浴、噪音、束缚。
1.2.3 糖水偏好试验 糖水偏好试验用于评价大鼠抑郁样行为。首先将所有大鼠单笼单只饲养,每个笼子放置2 个外观一致的饮水瓶,一个瓶子装10 g/L 蔗糖水,另一个瓶子装饮用水。大鼠预先适应从两个瓶子中饮水,适应期为24 h,期间每12 h 交换糖水瓶和饮用水瓶的位置。适应期结束后,记录24 h 内糖水和饮用水的饮用量。计算糖水偏好度,公式如下:
糖水偏好度(%)=糖水饮用量/(糖水饮用量+饮用水饮用量)×100 (1)
1.2.4 强迫游泳试验 FST 参考Slattery 等[14]的方法。FST 在透明的圆桶中进行,桶高45 cm,直径20 cm。桶中装水至水深30 cm,水温23~25 ℃。大鼠先练习在桶中游泳15 min,24 h 后进行正式试验。将大鼠置于桶中游泳10 min 并录像,计时不动状态持续时间。不动状态指漂浮在水中或者四肢轻微划动以保持头部露出水面。游泳结束后,将大鼠捞出,擦干后放回原来的笼子。
1.2.5 旷场试验 旷场试验用于评价大鼠的焦虑水平。将大鼠放置在边长为1 m 的正方形旷场中央,通过旷场上方的摄像系统观察5 min,采用SuperMaze 软件分析。计算大鼠在旷场中央区域活动时间比例和路程比例,公式如下:

1.2.6 排便试验 收集24 h 的粪便,记录粪便粒数,真空冷冻干燥后称量粪便干重[15]。收集新鲜粪便,进行真空冷冻干燥,称量干燥前后质量,计算水分含量。计算公式:

用不可吸收的胭脂红来测定全肠传输时间[16]。用5 g/L 甲基纤维素溶液制成质量浓度为60 g/L 的胭脂红悬液,每只大鼠灌胃1 mL,每隔15 min 观察大鼠的粪便,直到排出红色粪便。全肠传输时间为从灌胃到排出首粒红色粪便的时长。
1.2.7 血常规检测 采用全自动血液细胞分析仪分析血样中红细胞计数 (RBC)、白细胞计数(WBC)、血红蛋白含量(HGB)、红细胞比积(HCT)和平均红细胞体积(MCV)。
1.2.8 定量PCR 用TRIzol 试剂提取结肠总RNA。取0.2 μg 总RNA 和2 μL 5×All-In-One RTMasterMix 混合,用ddH2O 水补至10 μL,反转录得到cDNA。反转录反应程序如下:25 ℃孵育10 min,42 ℃反转录15 min,85 ℃5 min 灭活反转录酶。用定量PCR 检测mRNA 的表达量。定量PCR 反应体系包括1 μL cDNA,10 μL SYBR Premix Ex Taq,各0.5 μL 上下游引物(10 μmol/L)和8 μL ddH2O,总体积20 μL。定量PCR 反应程序如下:95 ℃预变性5 min;95 ℃变性5 s,60 ℃退火20 s,72 ℃延伸20 s,扩增40 个循环;最后进行溶解曲线检测。引物序列如下:β-actinF:5’-CGCGAGTACAACCTTCTTGC-3’,-actinR:5’-CGTCATCCATGGCGAACTGG-3’,5-HT3F:5’-TAGTGTGCATGGCTCTGCTG-3’,5-HT3R:5’-CAGTGGTTTCCCATGGCTGAG-3’,5-HT4F:5’-TCCACTCATGTGCTAAGGGAT-3’,5-HT4R:5’-GTCATTGTCCTGGGGCCTAC-3’。结肠mRNA表达量以β-actin 作为内参基因进行标准化。
1.2.9 统计分析 所有数据表示为平均值±标准差。用SPSS21.0 的单因素方差分析和Dunnett's 多重检验比较均值。显著性水平α=0.05。
2 结果
2.1 CMS 和L9 干预对大鼠体重和摄食量的影响
由图2a 可知,从造模第21 天开始,CMS 大鼠体重显著低于对照组(P<0.05)。停止造模后,CMS大鼠体重仍低于对照组,CMS-L9 组大鼠体重与CMS-NS 组无差异,且两组体重仍低于对照组(图2b)。造模阶段,CMS-L9 组和CMS-NS 组日均摄食量低于对照组(图2c);干预阶段,CMS-L9 组和CMS-NS 组大鼠采食量恢复到对照组大鼠水平(图2d)。
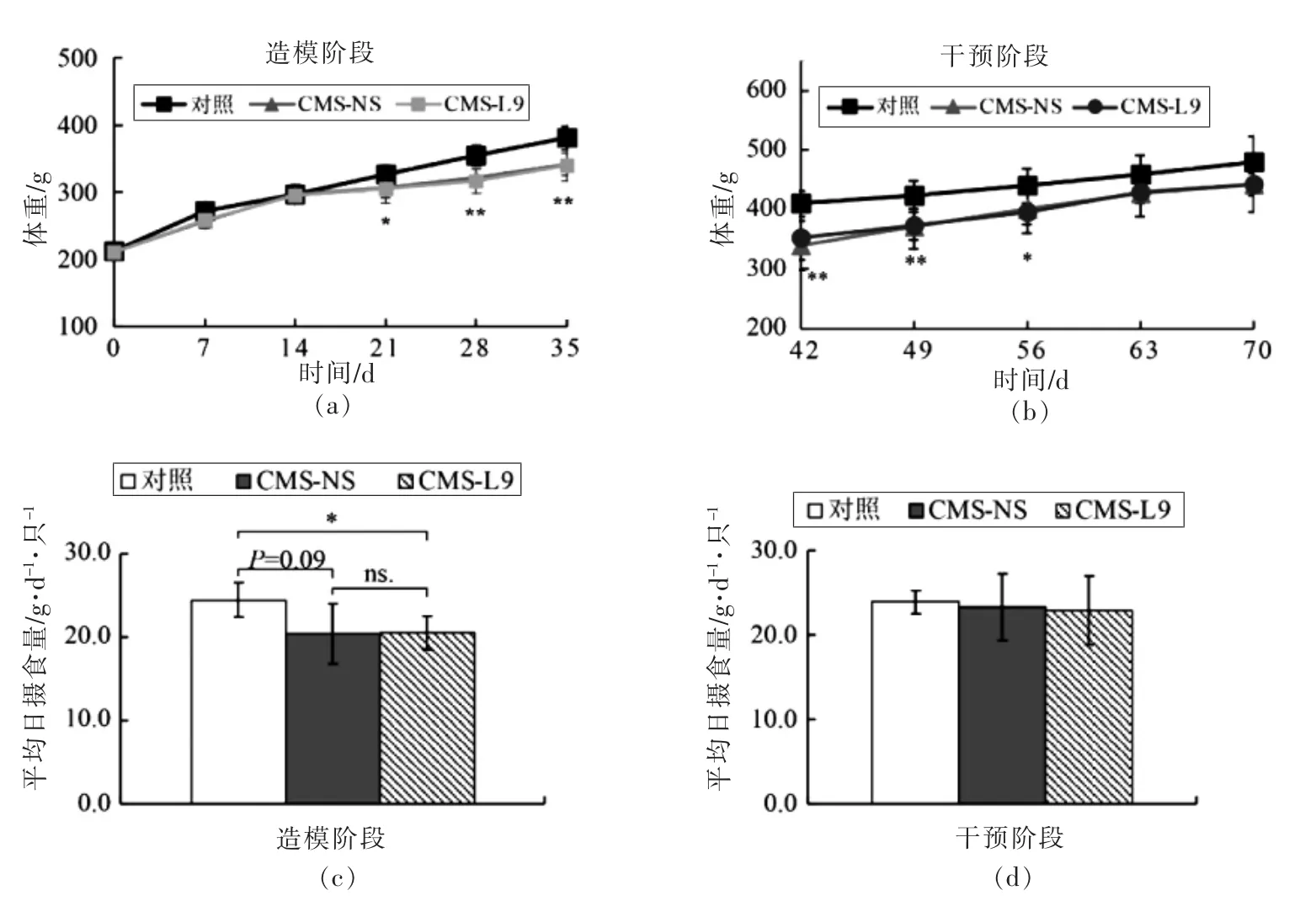
图2 各组大鼠的体重变化(a 和b)和平均每日摄食量(c 和d)Fig.2 The bodyweight changes (a and b) and mean daily food intakes (c and d) of rats
2.2 CMS 和L9 对大鼠血常规的影响
干预前和干预后大鼠的血常规如表1所示。干预前、后,CMS-L9、CMS-NS 组和对照组WBC、RBC、HGB、HCT、MCV 无显著差异。说明CMS 造模和L9 干预未造成大鼠感染或者贫血等疾病。
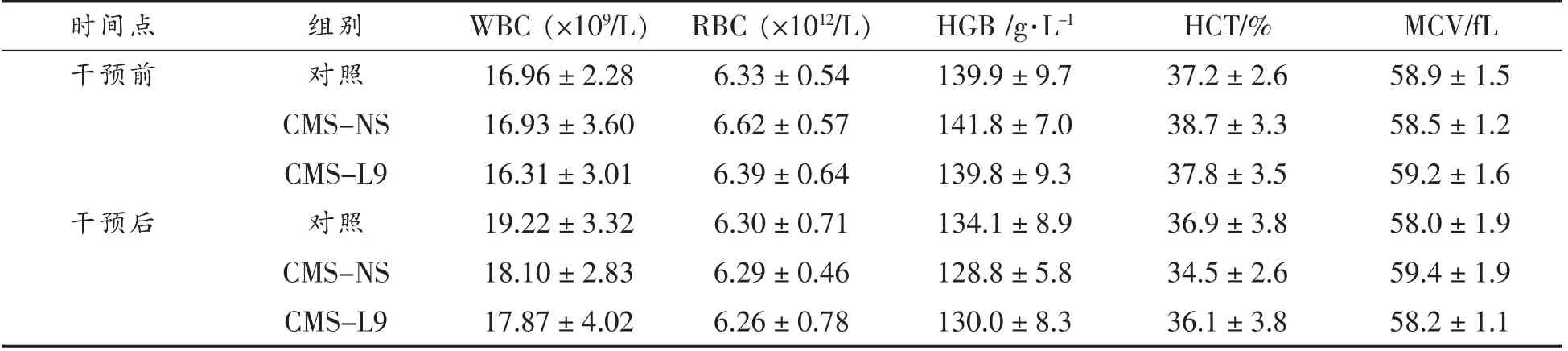
表1 CMS 和L9 对大鼠血常规的影响Table 1 Effects of CMS and L9 on the hematological parameters of rats
2.3 CMS 对大鼠抑郁行为的影响
本研究通过糖水偏好试验、强迫游泳试验和旷场试验来研究大鼠的抑郁程度,结果如图3所示。L9 干预前,CMS-L9 和CMS-NS 组大鼠糖水偏好度均显著低于对照组(P<0.01,图3a),强迫游泳试验的不动时间也显著高于对照组 (P<0.05,图3b)。CMS 组在旷场中央区域活动路程有低于对照组的趋势(图3c),在中央区域活动时间显著小于对照组(P<0.05,图3d)。以上结果说明CMS 诱导大鼠表现出抑郁样行为。
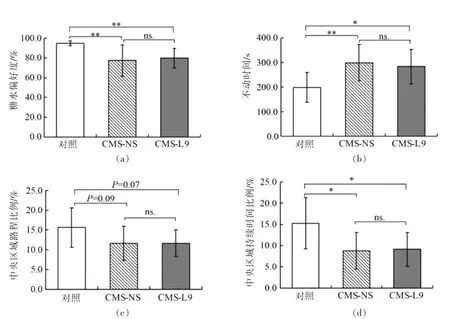
图3 CMS 对大鼠行为的影响Fig.3 Effects of CMS on the behaviors of rats
2.4 CMS 和L9 对大鼠粪便指标和全肠传输时间的影响
如表2所示,干预前,CMS-L9 组和CMS-NS组粪便水分含量均高于对照组,但无显著差异(P值分别为0.079 和0.051);24 h 排便的粒数和粪便总干重均显著高于对照组(P<0.05)。CMS-L9 组和CMS-NS 组大鼠全肠传输时间显著低于对照组(P<0.01),肠道蠕动加快。以上结果表明,抑郁大鼠出现腹泻症状。
由表2可知,在对抑郁大鼠干预4 周后,CMS-NS 组大鼠粪便水分含量高于对照(P=0.083),24 h 排便的粒数和粪便总干重显著高于对照组(P<0.05),肠传输时间也显著低于对照组(P<0.05),说明停止造模后大鼠仍持续腹泻症状。CMS-L9 组大鼠粪便水分含量低于CMS-NS 组(P=0.085),恢复至对照组的水平;排便粒数和粪便总干重均显著低于CMS-NS 组(P<0.05),接近对照组的正常水平;全肠传输时间显著高于CMSNS 组(P<0.05),且与对照组无显著差异。以上结果表明,L9 干预可显著缓解抑郁大鼠的腹泻症状。
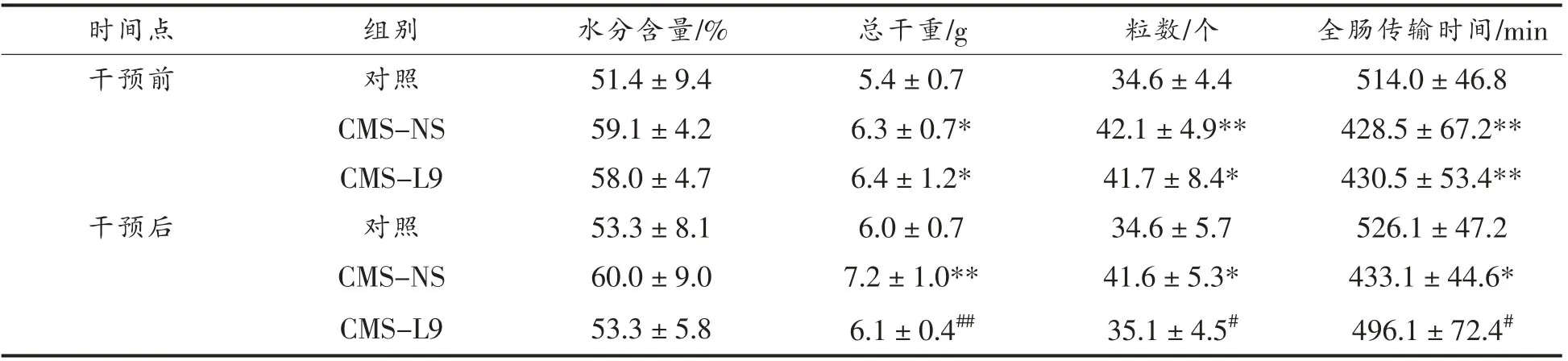
表2 CMS 对大鼠粪便指标和全肠传输时间的影响Table 2 Effects of CMS on stool parameters and intestinal transmission function of rats
2.5 CMS 和L9 对结肠5-HT 受体mRNA 表达的影响
如图4所示,CMS-NS 组和CMS-L9 组大鼠结肠5-HT3 受体mRNA 表达水平与对照组相比无显著变化。CMS-NS 组大鼠结肠5-HT4 受体mRNA 表达高于对照组(P=0.09),而L9 进行干预后,5-HT4 受体mRNA 表达量显著降低(P<0.01),恢复到正常水平。
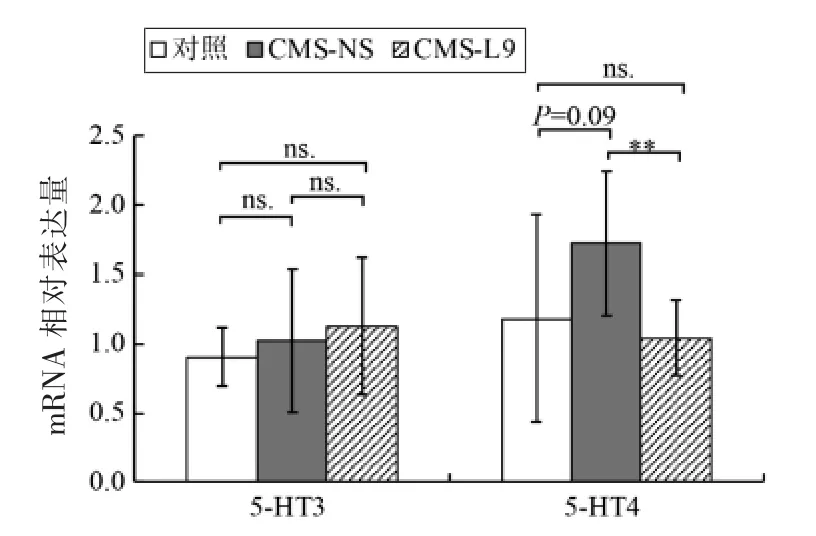
图4 CMS 和L9 对结肠5-HT3 和5-HT4 受体mRNA 表达的影响Fig.4 Effects of CMS and L9 on the mRNA expression of 5-HT3 receptor and 5-HT4 receptor in colons of rats
3 讨论与结论
本文应用慢性温和应激(CMS)构建抑郁大鼠腹泻模型,研究了副干酪乳杆菌L9 对抑郁大鼠腹泻症状的缓解作用。
本研究采用CMS 刺激5 周后,大鼠在强迫游泳试验、糖水偏好试验和旷场试验中表现抑郁样行为。CMS 诱导的抑郁大鼠体重增长减缓,这与文献报道的结果相似[17],尽管也有文献报道应激并未导致体重的改变[18],这可能与应激的程度有关。此外,应激过程中大鼠采食量也有减少,即可解释体重的变化。应激大鼠血常规与对照组无显著差异,与周天航等[19]的研究结果一致,表明CMS 未造成大鼠感染和贫血等症状。停止应激后,CMS 处理大鼠采食量恢复正常。L9 对大鼠采食量和血常规指标均没有显著影响,表明L9 干预大鼠未出现感染或者炎症等免疫反应,这印证了L9 的安全性[20]。
CMS 诱导的抑郁大鼠排便量增加,粪便水分含量升高,全肠转运时间缩短,肠蠕动加快,表现出腹泻症状。大量研究发现慢性或者急性应激可导致腹泻症状[21-22]。体外观察研究发现,应激大鼠的结肠推进性收缩速度和频率加快[23],这与本文中应激诱导抑郁大鼠腹泻的结果相符。Lu 等[24]发现在非应激诱导抑郁模型中,大鼠肠道传输速度也是加快的。由此可见,应激或者非应激抑郁实验动物大都呈现腹泻症状。但是,抑郁病人的肠道健康问题更为复杂,抑郁病人不仅有腹泻症状,也有很高比例病人伴随便秘症状[3]。因此未来对抑郁病人肠道健康问题的研究还需要进一步借助更多样的动物模型来模拟其复杂的肠道症状。
本文用L9 对应激诱导抑郁的腹泻症状进行干预,结果表明L9 使抑郁腹泻大鼠排便粒数、粪便质量、粪便水分含量和全肠传输时间恢复正常,改善腹泻症状。益生菌被报道能有效缓解一般腹泻。如鼠李糖乳杆菌LGG 和布拉酵母在多项随机双盲对照临床试验中表现出对抗生素相关腹泻良好的效果[25];两歧双歧杆菌能够降低婴儿轮状病毒相关腹泻的发生率[26]。抑郁相关腹泻具有不同于一般腹泻的特点,它的发病不仅仅是肠道本身的病变,同时也涉及到中枢神经系统的改变,二者通过肠脑轴相关联。本研究发现益生菌对于抑郁相关腹泻也有良好的效果。这说明益生菌可能通过肠脑轴对抑郁产生影响。事实上,已经有研究报道益生菌能缓解病人抑郁症状[27]。
本研究中,抑郁大鼠结肠5-HT4 受体mRNA表达量显著升高。肠道5-HT4 受体是调控肠道蠕动的关键。研究表明,5-HT4 受体拮抗剂能够抑制肠道推进运动[28],激活5-HT4 受体可以加速肠道的推进运动[29]。这说明应激激活了大鼠5-HT4 受体,使得5-HT 信号更易通过5-HT4 受体传递,从而导致了抑郁大鼠肠道蠕动过快,出现腹泻症状。肠道5-HT 受体的表达受到肠腔内微生物的影响。无菌小鼠的肠道5-HT4 受体表达量显著降低,而移植特定菌群可以恢复5-HT4 受体的表达[30]。本研究发现,L9 可以使抑郁且腹泻大鼠的肠道5-HT4 受体mRNA 表达量恢复到正常水平,使全肠传输时间恢复到接近正常水平,表明L9 通过调节5-HT4 受体表达缓解腹泻症状。肠道微生物对宿主5-HT 受体表达的影响可能与肠道菌群代谢物有关[30]。有研究指出,短链脂肪酸具有缓解应激诱导的肠道蠕动异常的作用[9]。L9 被报道会增加粪便中乙酸和丙酸的含量[31],推测L9 可能通过调节肠道菌群代谢物影响宿主5-HT4 受体的表达,这还有待进一步研究。
综上所述,副干酪乳杆菌L9 能通过调节宿主5-HT4 受体的表达有效缓解应激诱导的抑郁大鼠的腹泻症状。
