基于网络药理学和分子对接技术的“土茯苓-茵陈”药对治疗银屑病作用机制的研究
2022-01-10李俊辰申倩马育晓林海月张宇
李俊辰 ,申倩 ,马育晓 ,林海月 ,张宇
(1.天津中医药大学,天津 301617;2.天津医科大学研究生院,天津 300070;3.天津市中医药研究院附属医院,天津 300120)
银屑病是一种遗传与环境共同作用诱发、免疫介导的慢性、复发性、炎症性、系统性疾病,治疗困难,常罹患终身[1]。目前,银屑病在全球范围内的发病率大约是0.1%~3.0%,且在持续升高,而发病机制尚未完全明确,因此全球对于银屑病的研究仍在进一步探索[2]。
药物配伍是中医临证组方过程中的重要环节之一,“药对”就是药物配伍的一种重要体现。“药对”能够通过药物之间的配合而达到超过单味药功效的效果[3]。“土茯苓-茵陈”药对是中国中西医结合治疗皮肤病奠基人边天羽教授治疗银屑病的常用“药对”。银屑病系列药方以土茯苓、茵陈作为君药,发挥清热祛湿的作用,佐以其他药物,临床治疗银屑病的效果显著[4],因此,“土茯苓-茵陈”药对是治疗银屑病的系列药方中的核心组分,下文简称为核心组分。
中医药重视药物之间的配伍关系,在临床上常多种中药同时使用发挥功效,而网络药理学有整体性、系统性等优点,近年来广泛应用于筛选中药活性成分、阐释中药多成分、多靶点的作用机制、老药新用、中药方剂主成分与配伍关系等方面的研究[5]。本文将基于网络药理学的研究方法探索核心组分治疗银屑病的作用机制。
1 资料方法
1.1 核心组分化合物及作用靶点的筛选 釆用TCMSP(http://lsp.nwsuaf.edu.cn/tcmsp.php),以土茯苓、茵陈为关键词,口服生物利用度(OB)≥30%且类药性(DL)≥0.18为标准,收集并筛选出核心组分的活性化合物及其作用靶点。
1.2 疾病靶点的确定 利用人类孟德尔遗传数据库(OMIM,https://omim.org/)、Genecards(https://www.genecards.org/)、PharmGkb(https://www.pharmgkb.org/)以及药物靶标数据库(TTD,http://bidd.nus.edu.sg/group/cjttd/)疾病数据库,以银屑病为关键词,高相关性为标准,筛选汇总疾病的高关联度靶点。
1.3 疾病-化合物共同靶点的筛选 利用VennPainter软件,将核心组分化合物的作用靶点与疾病靶点取交集,筛选出二者共同的作用靶点。
1.4 药物-共同靶点-疾病网络的构建 将核心组分中的化合物、银屑病以及二者的共同靶点蛋白上传至 Cytoscape软件(http://www.cytoscape.org/)生成体现药物-共同靶点-疾病相互作用的网络图,以探究核心组分的药理学作用机制。
1.5 蛋白互作网络(PPI)的构建 利用String(https://string-db.org/)蛋白互作数据库和Cytoscape软件分析共同靶点蛋白之间的相互作用,并用R语言进行计数分析。
1.6 基因功能注释(GO)功能富集分析 利用Cytoscape软件对共同靶点蛋白进行GO功能富集分析,以了解共同靶点蛋白在基因功能中的作用,通过Omicshare软件(http://www.omicshare.com/tools/index,php/)对结果进行可视化处理。
1.7 京都基因与基因组百科全书(KEGG)通路富集分析 利用 David(https://david.ncifcrf.gov/)数据库和Cytoscape软件将共同靶点进行KEGG通路富集分析,对共同靶点蛋白在信号通路中的作用做注释分析,得到核心组分治疗银屑病的信号通路,通过Omicshare软件对结果进行可视化处理。
1.8 主要化合物-共同靶点分子对接 为了进一步验证靶点预测结果的可靠性,对筛选所得的主要化合物及主要相关靶点进行分子对接验证。在蛋白质数据库(http://www.rcsb.org)下载主要相关靶点蛋白结构,在PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载主要化合物结构,使用DockThor软件将主要化合物与主要靶点进行分子对接。
2 结果
2.1 核心组分化合物及作用靶点的筛选 利用TCMSP分别查找核心组分的化合物及作用靶点,经过整理,核心组分活性化合物共有26种,其中土茯苓15种、茵陈13种(二者共有的化合物为槲皮素、β-谷甾醇),见表1。查找核心组分中化合物的靶点,通过筛选,共有103个化合物作用靶点。

表1 核心组分中26个候选化合物的基本信息
2.2 疾病靶点及药物-疾病共同靶点的确定 利用OMIM、Genecard、PharmGkb以及TTD疾病数据库,汇总、去重后筛选出1 475个疾病靶点。结合化合物的103个靶点,利用VennPainter软件,分析得出核心组分与银屑病的共同靶点有44个。
2.3 药物-共同靶点-疾病网络的构建与分析 利用Cytoscape软件构建药物-共同靶点-疾病的网络图,见图1。图中一共有68个节点,包括1个银屑病节点(红色)、1个核心组分节点(黄色三角)、2个土茯苓、茵陈节点(黄色椭圆)、44个共同靶点的节点(粉色)、20个化合物节点(绿色),其中,有6种化合物由于与药物-疾病共同靶点没有联系,因此未参与网络的构建。在20种化合物中,包括土茯苓的9种化合物、茵陈的13种化合物,其中二者共同包含的化合物是槲皮素和β-谷甾醇,说明这2种化合物在核心组分组成中占到重要地位。调控的靶点数目排前5位的化合物是槲皮素、β-谷甾醇、柚皮素、薯蓣皂苷元、异鼠李素,说明这些化合物在核心组分治疗银屑病中起主要作用。化合物调控的靶点数目前4位是前列腺素内过氧化物合酶(PTGS)-1、丝氨酸蛋白酶(PRSS)-1、过氧化物酶体增殖物激活受体(PPARG)-γ、网状内皮细胞过多症病毒癌基因同源物(REL)-A,是核心组分治疗银屑病的主要靶点。
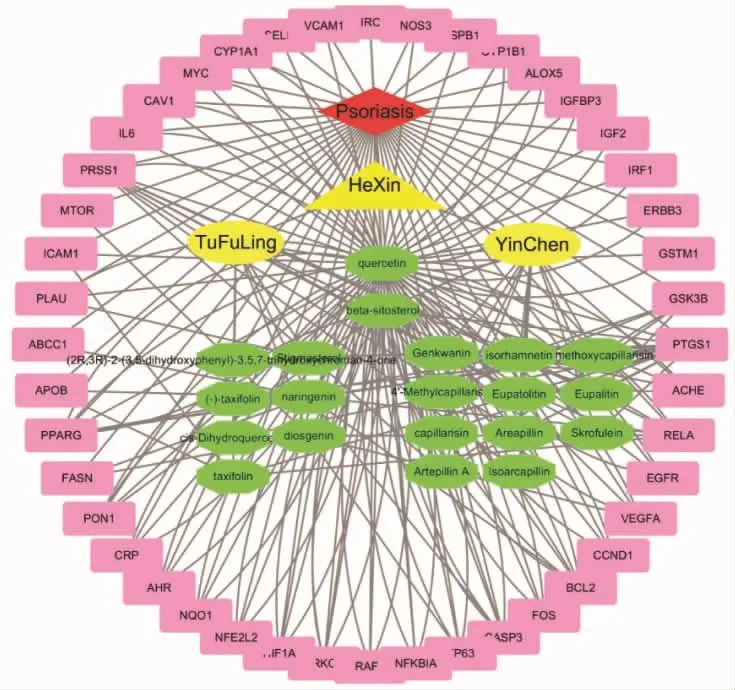
图1 药物-共同靶点-疾病网络
2.4 PPI网络的构建与分析 利用String蛋白互作数据库和Cytoscape软件分析共同靶点蛋白之间的相互关系,选择高可信度(0.700),并隐藏网络中断开连接的节点:ATP结合盒C亚家族成员(ABCC)-1、PRSS-1、乙酰胆碱酯酶(ACHE)。节点表示蛋白质,之间的连线表示蛋白质之间相互作用的证据,见图2。PPI计数排名前3位的靶点是白细胞介素(IL)-6、血管内皮生长因子(VEGF)-A、表皮生长因子受体(EGFR),相互关系计数越多,说明该靶点在核心组分治疗银屑病中起更为重要的作用,见图3。

图2 PPI网络

图3 PPI计数
2.5 GO功能富集分析 对核心成分化合物和银屑病的共同靶点进行GO功能富集分析,以错误发现率(FDR)<0.05为标准,确认了697条结果,利用Omicshare软件对结果进行可视化处理,展示前20个共同的基因功能,见图4。排名前5位的分别是对氧水平的反应、对缺氧的反应、对低氧水平的反应、对氧化应激的反应以及对活性氧代谢过程的反应。

图4 GO功能富集
2.6 KEGG通路富集分析 对核心组分化合物与银屑病的共同靶点利用DAVID数据库进行KEGG通路富集分析,以P<0.01,FDR<0.05进行筛选,并将结果利用Omicshare软件可视化,见图5。信号通路主要包括在糖尿病并发症中的晚期糖基化终产物(AGE)-晚期糖基化终产物受体(RAGE)信号通路、流体剪切损伤和动脉粥样硬化通路、卡波西肉瘤相关的疱疹病毒感染通路、结肠癌通路、癌症蛋白多糖通路、EGFR酪氨酸激酶抑制剂耐药通路、肿瘤MicroRNAs通路、肝细胞癌通路、人巨细胞病毒感染通路、前列腺癌通路、磷脂酰肌醇-3激酶(PI3K)-蛋白激酶 B(Akt)信号通路、低氧诱导因子(HIF)-1信号通路、肿瘤坏死因子(TNF)信号通路、乙型肝炎、丝裂原活化蛋白激酶(MAPK)信号通路、酪氨酸激酶受体(ErbB)信号通路、松弛素信号通路、细胞程序性死亡-配体1(PD-L1)表达和程序性细胞死亡蛋白(PD)-1检查点信号通路、麻疹、丙型肝炎。
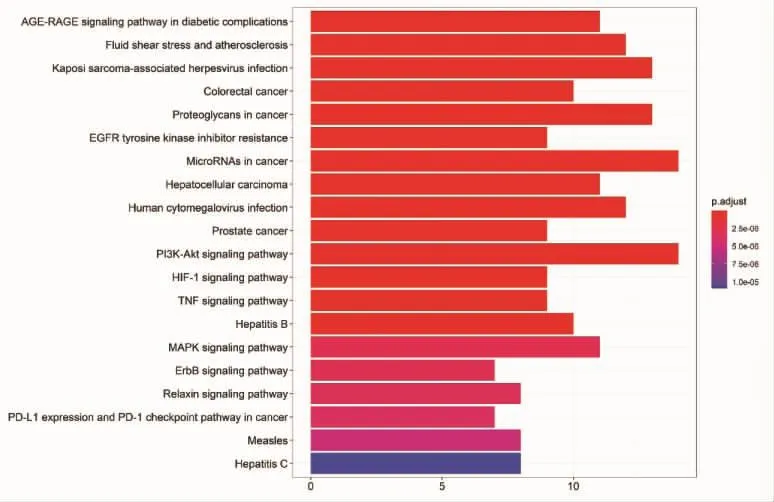
图5 KEGG通路富集分析
2.7 主要化合物-主要靶点分子对接 将主要化合物槲皮素、β-谷甾醇、柚皮素与主要靶点IL-6、VEGF-A、EGFR两两组合,进行分子对接,见表2。根据DockThor结果显示β-谷甾醇与IL-6,槲皮素、柚皮素与VEGF-A之间的分子结构无法实现对接,证明二者之间可能不存在相互作用。当配体与受体结合的构象越稳定时,能量越低,发生作用的可能性越大,根据最低结合能的结果显示,排名前3位的是槲皮素与EGFR、β-谷甾醇与EGFR、β-谷甾醇与VEGF-A,见图6。

图6 主要化合物与主要靶点对接示意图

表2 主要化合物-主要靶点对接最低结合能(kcal/mol)
3 讨论
3.1 核心组分主要化合物对银屑病的作用 根据TCMSP分析结果显示,核心组分包含活性化合物共有26种,其中土茯苓15种、茵陈13种(二者共有的化合物为槲皮素、β-谷甾醇)。根据药物-共同靶点-疾病网络显示,核心组分中起主要作用的化合物是槲皮素、β-谷甾醇、柚皮素、薯蓣皂苷元、异鼠李素。
已有研究发现,银屑病的主要病理改变是角质形成细胞的过度增殖[6]。Src家族酪氨酸激酶(SFK)是触发细胞生长和分化信号通路的关键,研究发现,槲皮素能够通过与SFK分子结合,调控角质形成细胞的生长[7]。β-谷甾醇的调控靶点数目仅次于槲皮素,其能够抑制皮肤的炎性反应,减少TNF、IL-1β和IL-6的释放,改善银屑样特征性皮损[8]。柚皮素可以抑制IL-6的过度表达,减轻银屑病皮损部位的炎性反应[9]。此外,柚皮素可以降低银屑病治疗用药甲氨蝶呤的肝毒性,减少不良反应[10]。薯蓣皂苷元能通过阻滞细胞周期和降低核因子(NF)-κB水平而抑制人永生化角质形成细胞生长,同时通过调节含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3诱导细胞凋亡,并且通过抑制Toll样受体(TLR)-4髓样分化因子(Myd88)途径下调促炎性细胞因子,此外,薯蓣皂苷元通过降低角质形成细胞中VEGFA的表达而部分抑制血管形成,因此,薯蓣皂苷元能从多个方面减轻银屑病的发生和发展[11]。目前,异鼠李素对银屑病的作用机制尚不明确,有研究发现异鼠李素有保护心脑血管、抗肿瘤、抗炎、抗氧化、保护器官、预防肥胖等作用,相关机制包括调节PI3K-AKT、NF-κB、MAPK 等信号通路以及相关细胞因子和激酶的表达[12]。因此可推测异鼠李素可能通过抑制角质形成细胞的增殖,减轻皮损炎性反应来治疗银屑病,但具体机制还需要进一步实验验证。
3.2 核心组分与银屑病主要共同靶点对银屑病的作用 根据药物-共同靶点-疾病网络显示,化合物调控的靶点数目前4位是PTGS-1、PRSS-1、PPAR-G、REL-A。
PTGS-1在银屑病中的作用主要体现在导致血管内皮生成异常,和增强内皮的炎性反应2个方面[13-14]。PRSS-1是肽酶S1家族中的一员,S1家族在银屑病的炎性反应中起重要作用,但PRSS-1对银屑病的具体机制尚不明确,可能与炎性反应密切相关[15]。PPAR-G是PPAR脂肪酸代谢中的关键基因,研究发现,银屑病患者的皮损组织与健康人皮肤组织相比,包含PPAR-G在内的7个PPAR脂肪酸代谢相关基因表达都降低,说明银屑病的发生不仅与免疫相关,也与各种代谢途径相关[16]。REL-A属于NF-κB家族,研究发现,NF-κB能够与TNF-α联合作用影响银屑病的发生发展[17]。
3.3 核心组分治疗银屑病的作用方向及信号通路 KEGG信号通路富集分析可以看出核心组分治疗银屑病的信号通路主要集中在氧水平、免疫反应、炎性反应、细胞增殖分化等方面。银屑病的病理特征包括角质形成细胞异常增殖和/或关节滑膜细胞与软骨细胞的炎性反应,以及微血管的异常新生,其中角质形成细胞的异常增殖,会导致表皮细胞对氧的需求增加。与健康人相比,银屑病患者表皮组织的HIF-1α表达显著增加[18]。获得2019年诺贝尔生理学或医学奖“氧感知通路”反映了生物体对氧的反应机制,同时也提示医者银屑病的发生发展是否与其有密不可分的关系。从现有的文献来看,在皮肤损伤或感染后,病原体相关分子模式被TLR识别[19]。在角质形成细胞中,NF-κB被TLR激活,并易位至核内,以诱导人源抗菌肽(LL-37)和HIF-1α表达[20]。LL-37通过抑制泛素连接酶-E3对HIF-1α的水解,而增加HIF-1α的水平[21-23]。而后HIF-1α通过HIF-1α/VEGF/Akt/eNOS通路调节血管内皮细胞,促进血管生成,引发银屑病[24-25]。另一方面,NF-κB与IL-36共同作用,通过IL-6影响Th17/Treg平衡产生更多的Th17细胞[26]。Th17细胞活化后通过STAT3/HIF-1α/RORγt/IL-17通路产生IL-17[27-28]。IL-17可通过调控丝聚合蛋白的表达,引起角质形成细胞的角化不全[29]。综上所述,HIF-1α相关通路在角质形成细胞、血管内皮细胞与Th17细胞的病理改变中发挥了关键作用,进而引起了角质形成细胞异常增殖、血管新生异常活跃与一系列炎性反应瀑布式级联反应,因此,银屑病的发生可能与HIF-1α相关通路密切相关。通过GO富集分析可以发现,核心组分治疗银屑病的作用主要体现在氧感知方面,同时KEGG富集结果中MAPK、HIF-1α、PI3K-AKT等信号通路均与氧感知相关,这说明核心组分对银屑病的治疗主要表现在对氧感知相关通路的调控上。
“土茯苓-茵陈”药对是边天羽教授治疗银屑病的系列药方中的核心组分,临床有良好的疗效,但是药理研究报道较少,本研究通过网络药理学方法构建了“土茯苓-茵陈”药对治疗银屑病多成分-多靶点-多通路的复杂网络关系,研究结果分析了“土茯苓-茵陈”药对治疗银屑病的活性成分和分子机制,为进一步开展“土茯苓-茵陈”药对治疗银屑病作用机制的研究提供了科学依据。
