酸浆果实多酚和多糖双水相提取工艺及其抗氧化活性
2022-01-08让凤菊刘伟欧阳艳
让凤菊,刘伟,欧阳艳
(伊犁师范大学化学与环境科学学院新疆维吾尔自治区教育厅普通高等学校重点实验室,新疆 伊宁 835000)
酸浆(Physalis alkekengi L.)是茄科酸浆属多年生草本植物,性寒,归肺经,广布于亚欧大陆,如中国、日本、俄罗斯等[1]。果实和宿萼是其主要入药部位,现已发现其主要含有酸浆苦味素类、多酚类、生物碱类、多糖、挥发油类等多种生理活性物质[2-6]。目前对酸浆果实的研究多集中在酸浆苦素类及其他活性成分的药理活性上,如国内外学者研究发现酸浆具有抗肿瘤、抗炎、抗氧化等作用[7-10]。多酚、多糖是植物中主要活性成分,而有关酸浆中多酚、多糖较少关注。
有研究发现心血管疾病、肿瘤、阿尔兹海默症等疾病都与体内自由基的高反应活性有关[11]。因而含有大量无毒天然抗氧化剂(如多酚、类黄酮、维生素C等)的药用植物[12]引起研究人员关注,已有研究表明酸浆多酚具有抗氧化、改善认知、降血糖等功效[13-15],酸浆多糖具有免疫调节、抗氧化、降血糖血脂等活性[16]。但对其提取工艺研究较少。武乾英[17]优化乙醇水提取酸浆果实多酚工艺,获得多酚得率为0.899%;王文祥[14]采用酸加酶的热水浸提法提取酸浆多糖,多糖提取率较高,为33.2%。王晓林等[18]探究了微波协同双水相法提取酸浆宿萼总黄酮工艺,最佳工艺:正丙醇-水比为0.7、微波提取时间 20 min、料液比 1∶50(g/mL),硫酸铵质量浓度为0.35 g/mL,微波功率为400 W。
双水相同时提取酸浆果实多酚和多糖类工艺的研究报道较少,本试验以酸浆果实为研究对象,根据多酚易溶于醇相,多糖易溶于水相特点,采用C2H5OHK2HPO4构造双水相体系,辅助超声波同时提取酸浆果实中多糖、多酚,通过正交试验优化粗提工艺,并评价其体外抗氧化性。
1 材料与方法
1.1 材料与试剂
酸浆果实:市售,洗净后于烘箱45℃烘干,粉碎过60目筛密封保存冷藏备用。
石油醚、无水乙醇、K2HPO4、苯酚、福林酚、浓硫酸、碳酸钠(均为分析纯):天津市福晨化学试剂厂;没食子酸、葡萄糖标准品(优级纯):上海士峰生物科技有限公司。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)、三吡啶基三嗪:上海阿拉丁生化试剂科技股份有限公司。
1.2 仪器与设备
UV-2500紫外可见分光光度计:日本岛津分析仪器厂;YB-250粉碎机:永康市速锋工贸有限公司;KQ-250DE型超声波清洗器:昆山市超声仪器有限公司。BSA124S电子天平:北京赛多利斯仪器有限公司。
1.3 方法
1.3.1 样品脱脂
将酸浆果实粉末置于烧瓶中,以1∶15(g/mL)料液比加入石油醚,超声提取40 min,抽滤。取出滤渣后再重复上述操作2次,滤渣常温中挥干,装瓶冷藏备用。
1.3.2 标准曲线绘制
采用福林酚比色法测定多酚含量,具体方法参考张艳霞等[19]的方法稍有改动。精确配制1 g/L没食子酸标准溶液,取适量标准液于50 mL容量瓶,稀释成不同浓度没食子酸溶液(10 mg/L~60 mg/L),依次取1 mL该没食子酸溶液于10 mL的试管中,加入去离子水5 mL,Folin-Ciocalteu试剂(加水稀释10倍)1 mL,摇匀,再加入7.5% Na2CO3溶液3 mL,摇匀后室温黑暗静置2 h,于最大吸收波长718 nm处测量不同浓度的没食子酸溶液吸光度,绘制没食子酸标准曲线。
参考巫永华等[20]的方法测定多糖含量,配制浓度为1 mg/mL的葡萄糖标准液,依次吸取标准液0、0.2、0.4、0.6、0.8、1.0 mL于试管中,用蒸馏水补足至 2 mL,摇匀,分别加入6%苯酚溶液1 mL和浓硫酸5 mL后摇匀,冷却至25℃,以葡萄糖浓度为0的那组作为空白参比,对该6组溶液按体积比稀释50倍,在最大吸收波长488 nm处测定不同浓度葡萄糖溶液的吸光度,绘制葡萄糖标准曲线。
1.3.3 酸浆果实中多酚和多糖的分离提取
称取1.00 g酸浆果实粉末于100 mL锥形瓶中,按料液比1∶30(g/mL)加入30 mL一定浓度双水相体系。在一定温度下超声提取20 min,抽滤,室温下分液漏斗静置一段时间分层后,读出上、下层溶液体积,按照
1.3.2 方法测得上下相中多酚、多糖的吸光值,根据标准曲线计算多酚、多糖的浓度。
1.3.4 酸浆果实中多酚和多糖得率、萃取率的测定
酸浆果实中多酚和多糖得率按式(1)、萃取率按式(2)计算[21]。
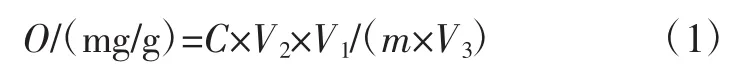
式中:O为酸浆果实多酚(或多糖)得率,mg/g;C为由回归方程计算的多酚(或多糖)的浓度,mg/mL;V1为多酚(或多糖)提取液的体积,mL;V2为多酚(或多糖)为显色反应的定容体积,mL;V3为酸浆测定多酚(或多糖)取样体积,mL;m为酸浆提取样品质量,g。
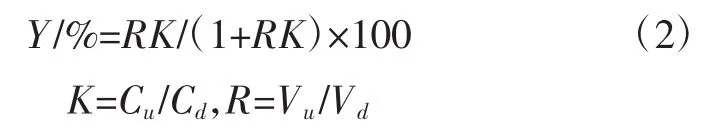
式中:Y为多酚(或多糖)萃取率,%;K为多酚(或多糖)在上下相中的分配系数;R为上下相的体积比;Cu,Cd分别为多酚(或多糖)上下相的浓度,mg/L;Vu和Vd为上下相体积,mL。
1.4 单因素试验
根据1.3.3的试验步骤进行试验,分别研究料液比[1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)]、超声时间(10、20、30、40、50 min)、温度(20、30、40、50、60 ℃)、乙醇的质量分数(15%、18%、21%、24%、27%)和K2HPO4质量分数(20%、26%、31%、36%、41%)5个因素对酸浆多酚和多糖萃取率的影响。
1.5 正交试验
在单因素试验基础上,进行四因素三水平正交试验,以多酚(或多糖)萃取率为响应值,设计L9(34)正交试验,优选酸浆果实多酚和多糖提取工艺。多酚提取因素水平选取见表1,多糖提取因素水平选取见表2。

表1 多酚正交试验因素水平Table 1 Orthogonal test factors level of polyphenols

表2 多糖正交试验因素水平Table 2 Orthogonal test factors level of polysaccharides
1.6 酸浆果实中多酚和多糖抗氧化性试验
1.6.1 清除DPPH自由基能力的测定
DPPH溶液配制:称取DPPH 6.3mg,无水乙醇溶解,定容于100 mL容量瓶中,即制成浓度为0.16 mmol/L的DPPH工作液。
样品、VC、空白(乙醇)溶液分别与DPPH溶液等体积混合,充分摇匀,暗处反应30 min,分别于517 nm处测吸光度,按下式计算DPPH自由基清除率。
DPPH自由基清除率/%=[1-(Ai-Aj)/Ac×100]
式中:Ac表示2 mL DPPH溶液+2 mL乙醇溶液的吸光度;Ai表示2 mL样品溶液+2 mL DPPH溶液的吸光度;Aj表示2 mL样品溶液+2 mL乙醇溶液的吸光度。
1.6.2 铁离子还原力(ferric ion reducing antioxidant power,FRAP)实验
FRAP工作液制备:酸浆多酚、多糖的FRAP实验参考Xu等[22]的方法稍有改动。准确配制一定体积的20 mmol/L FeCl3·6H2O 溶液、10 mmol/L TPTZ溶液(溶于40 mmol/L盐酸)和300 mmol/L醋酸盐缓冲液(pH3.6),然后按照按 1∶1∶10 体积比混合。
VC标准曲线绘制:配制一定体积的0.2 mg/mL的VC甲醇溶液作为母液,将母液稀释成一系列的浓度。分别取上述溶液100 μL,加入3 mL FRAP工作液,混匀后常温反应90 min于593 nm处测定吸光度,以去离子水做对照。得到VC的FRAP标准曲线方程:y=4.308 29x-0.043 45(R2=0.998 2)。
样品中酸浆多酚和多糖的FRAP值:将酸浆多酚、多糖粗提物配制不同浓度溶液,按照做VC标准曲线方法显色,测出各样品吸光度,根据VC标准曲线计算出相同吸光度下VC的浓度,以此浓度的数值作为FRAP值。
1.7 数据处理
所有试验均重复3次,结果用平均值±标准差表示。本试验运用Microsoft Excel 2016进行数据处理,采用origin 8.0绘图软件绘制图形。
2 结果与分析
2.1 多酚和多糖标准曲线
没食子酸标准曲线方程:A=0.01C+0.021,R2=0.9953(式中:A为吸光度;C为没食子酸标准溶液浓度,mg/L),表明在浓度0~60 mg/L范围内有良好的线性相关性。葡萄糖标准溶液的线性回归方程:y=0.301 7x+0.009 7,R2=0.999 4(式中:y为吸光度;x为葡萄糖标准溶液浓度,mg/L),表明在浓度0~2.5 mg/L范围内有良好的线性相关性。
2.2 单因素试验
2.2.1 料液比对酸浆多酚和多糖萃取率的影响
料液比对酸浆多酚和多糖萃取率的影响见图1。
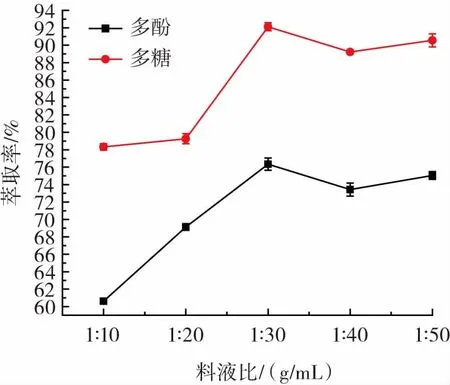
图1 料液比对酸浆多酚和多糖萃取率的影响Fig.1 Effect of solid liquid ratio on the extraction rate of Physalis alkekengi polyphenols and polysaccharides
如图1所示,总体上多酚萃取率远低于多糖,且都呈现先增后减的趋势。料液比为 1∶10(g/mL)~1∶30(g/mL)时,多酚萃取率随溶剂量增加直线上升,1∶30(g/mL)时达最大值76.35%,随后稍减至平缓;多糖的萃取率则随料液比 1∶20(g/mL)上升到 1∶30(g/mL)快速增加到最大值92.12%,之后多酚萃取率波动不大,说明随着溶剂量的逐渐增加,物料黏度逐渐变小,且浓度梯度随之变大,扩散速度加快,原料中的多酚、多糖得以大量转移到提取液中,使得提取更加完全。试验结果与巫永华和邵圣娟等[20,23]相似,因此多酚和多糖提取料液比均选择 1∶20、1∶30、1∶40(g/mL)3 个水平设计正交试验。
2.2.2 超声时间对酸浆多酚和多糖萃取率的影响
超声时间对酸浆多酚和多糖萃取率的影响见图2。
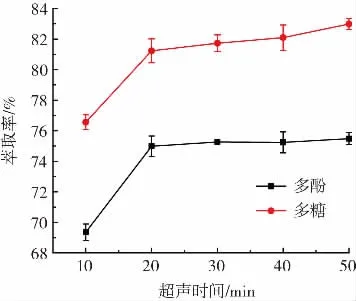
图2 超声时间对酸浆多酚和多糖萃取率的影响Fig.2 Effect of ultrasonic time on the extraction rate of Physalis alkekengi polyphenols and polysaccharides
由图2可知,超声时间在20 min内多酚和多糖的萃取率快速增加,之后增加缓慢,涨幅较小,在50 min时分别到达最大值75.48%和82.98%。说明样品中的多酚、多糖在超声20 min时已经充分溶出,随后超声时间增加对其萃取率的影响都不明显,并且延长超声时间会降低工作效率。故本试验没有把时间因素作为正交试验考察对象,超声时间均为20 min。
2.2.3 超声温度对酸浆多酚和多糖萃取率的影响
超声温度对酸浆多酚和多糖萃取率的影响见图3。
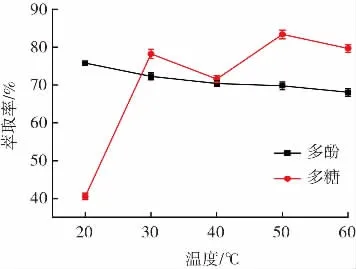
图3 温度对酸浆多酚和多糖萃取率的影响Fig.3 Effect of temperature on the extraction rate of Physalis alkekengi polyphenols and polysaccharides
如图3所示,多酚萃取率随温度升高而降低,变化幅度不大,20℃时萃取率最高,为75.79%,可能是因为随温度升高乙醇挥发加快。在20℃~60℃时,多糖萃取率整体上呈现随温度的升高先增大而后又有所下降的现象,50℃时达到最大值83.38%,可能是因为温度升高导致酸浆果实细胞壁大量破裂,基质中多糖快速溶出,故萃取率上升,继续升温,影响双水相体系分配系数和压力等因素,导致萃取率降低[24]。多酚提取正交试验温度选择20、25、30℃3个水平,而多糖提取选择的3个水平为50、55、60℃。
2.2.4 乙醇质量分数对酸浆多酚和多糖萃取率的影响
乙醇质量分数对酸浆多酚和多糖萃取率的影响见图4。
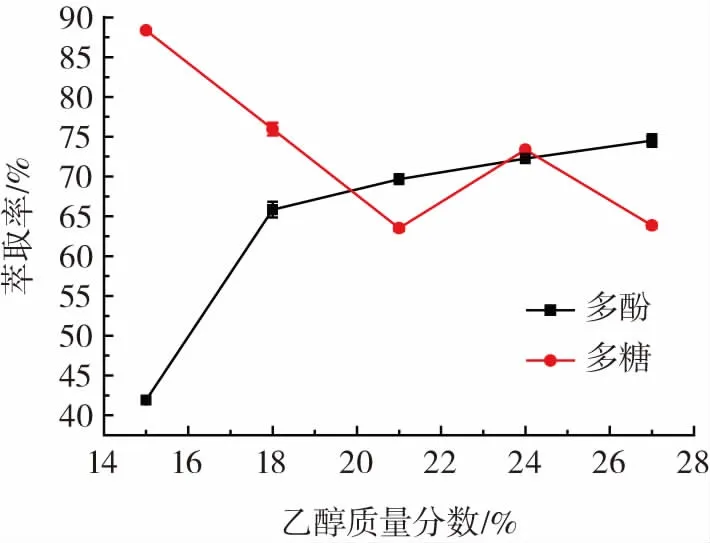
图4 乙醇质量分数对酸浆多酚和多糖萃取率的影响Fig.4 Effect of ethanol mass fraction on the extraction rate of Physalis alkekengi polyphenols and polysaccharides
从图4可以看出,C2H5OH-K2HPO4双水相萃取体系中,酸浆多酚萃取率随着乙醇质量分数的升高逐步增大,因为多酚类物质在乙醇中的溶解度大于水中的溶解度,故乙醇质量分数增加,多酚萃取率上升。多酚萃取率在乙醇质量分数27%时达最高值74.53%。而多糖萃取率则与乙醇质量分数成反比,多糖在水中的溶解度远大于乙醇的溶解度,随着乙醇的质量分数升高,体系中水含量减少,多糖的溶解量降低,萃取率降低[25]。而适量乙醇的存在增加了脂溶性多糖的溶出故出现多糖萃取率在降低的趋势下有所回升。故多酚提取正交试验中乙醇质量分数选择21%、24%、27%3个水平,而多糖提取则选择15%、18%、和21%3个水平。
2.2.5 K2HPO4质量分数对酸浆多酚和多糖萃取率的影响
K2HPO4质量分数对酸浆多酚和多糖萃取率的影响见图5。
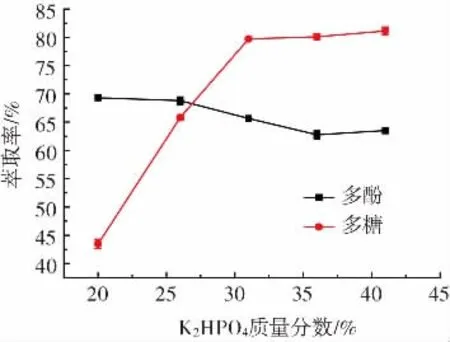
图5 K2HPO4质量分数对酸浆多酚和多糖萃取率的影响Fig.5 Effect of K2HPO4mass fraction on the extraction rate of Physalis alkekengi polyphenols and polysaccarides
由图5知,多酚萃取率随K2HPO4质量分数的增加而逐渐减小,最高为69.3%,原因主要是双水相体系中K2HPO4质量分数太高抑制了多酚的萃取,这与徐方祥等[26]研究结果一致,而多糖萃取率则随着K2HPO4质量分数的增加而增大,最高达81.12%。这是因为双水相体系中存在无机盐与有机小分子醇争夺体系中的水分子,下相中随K2HPO4质量分数的增大,无机盐争夺水分子的能力增强,溶于上相的水分子会进入下相,多糖萃取率升高。故多酚提取选择质量分数20%、26%、31%的K2HPO4进行正交试验,而多糖提取则选择质量分数31%、36%、41%的K2HPO4。
2.3 正交试验
多酚和多糖提取的正交试验结果见表3和表4。
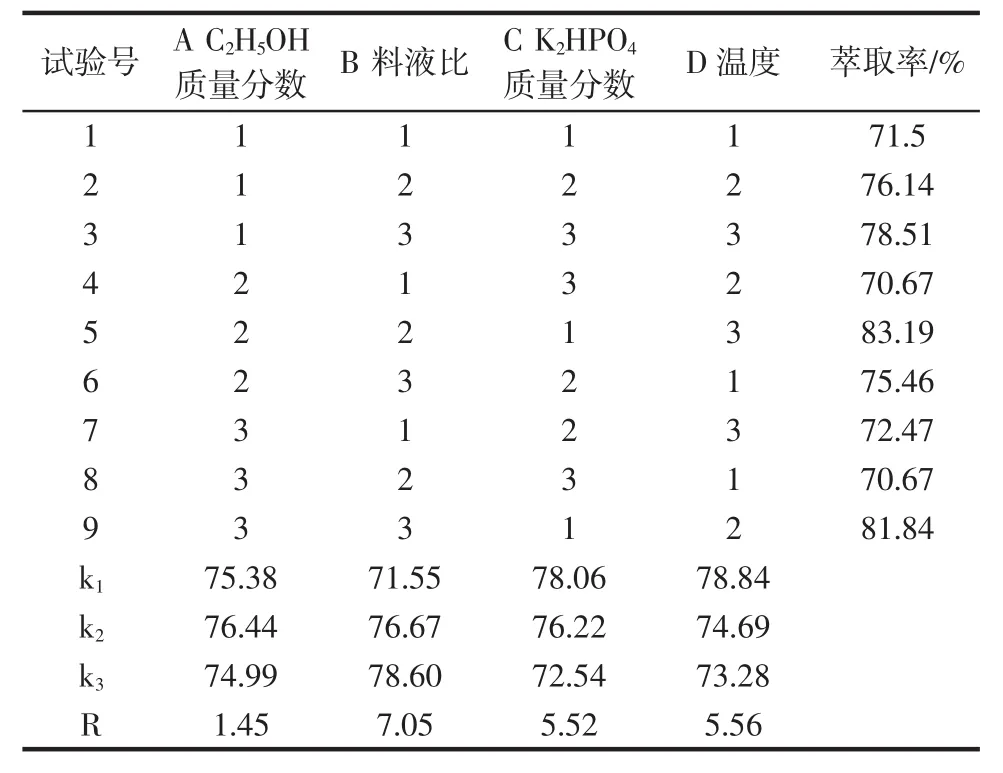
表3 酸浆多酚正交试验结果Table 3 Results of orthogonal test of Physalis alkekengi polyphenols
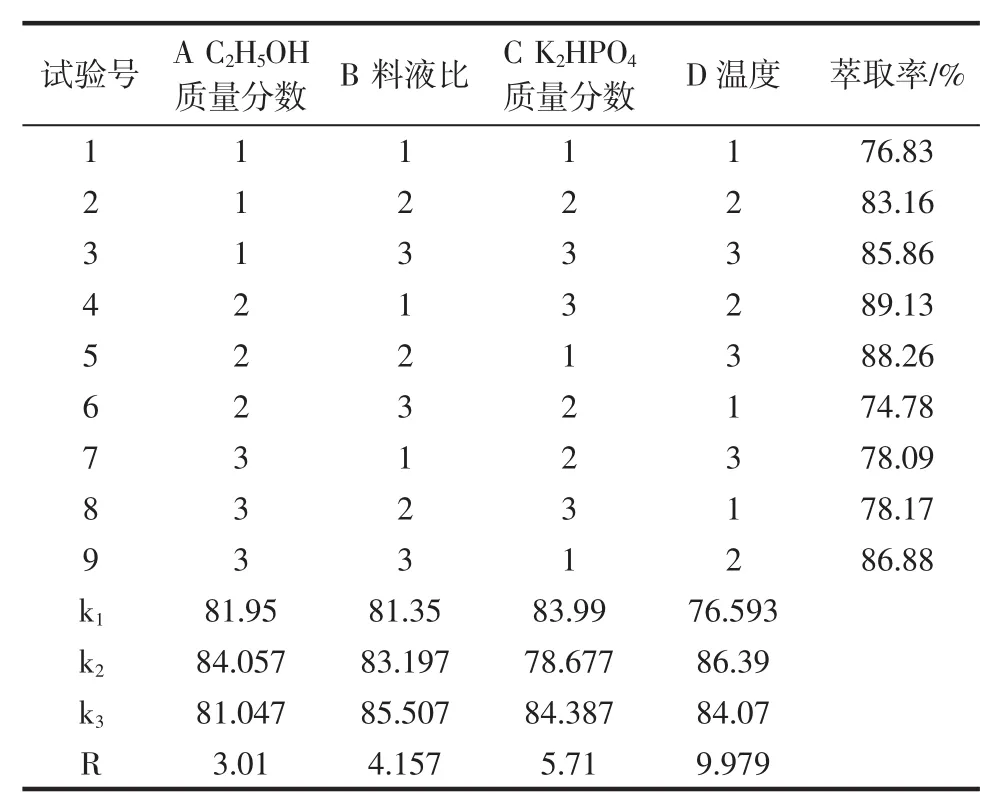
表4 酸浆多糖正交试验结果表Table 4 Results of orthogonal test of Physalis alkekengi polysaccharide
由表3多酚正交试验结果可以看出,影响多酚萃取率主次顺序为 B>D>C>A,最佳水平为 A2B3C1D1,即乙醇的质量分数为24%、料液比为1∶40(g/mL)、K2HPO4质量分数为20%、超声温度为20℃。
从表4多糖的正交试验结果可知,影响多糖萃取率的主次顺序为D>C>B>A,最优水平为A2B3C3D2,即乙醇质量分数为 18%,料液比 1∶40(g/mL),K2HPO4质量分数为41%,温度为55℃。
根据正交试验结果,各称取酸浆果实粉末3 g,分别在多酚、多糖最佳粗提工艺条件下进行试验,各3份重复,计算平均值。分别得到多酚、多糖萃取率为83.44%、89.16%;略高于表3、表4中多酚、多糖的最高萃取率。得率分别为14.774 4 mg/g和15.8 mg/g;平均萃取率相对标准偏差分别为1.27%、1.78%,说明该粗提工艺结果重现性好。
2.4 酸浆多糖和多酚DPPH自由基清除能力
酸浆多糖和多酚DPPH自由基清除能力见图6。
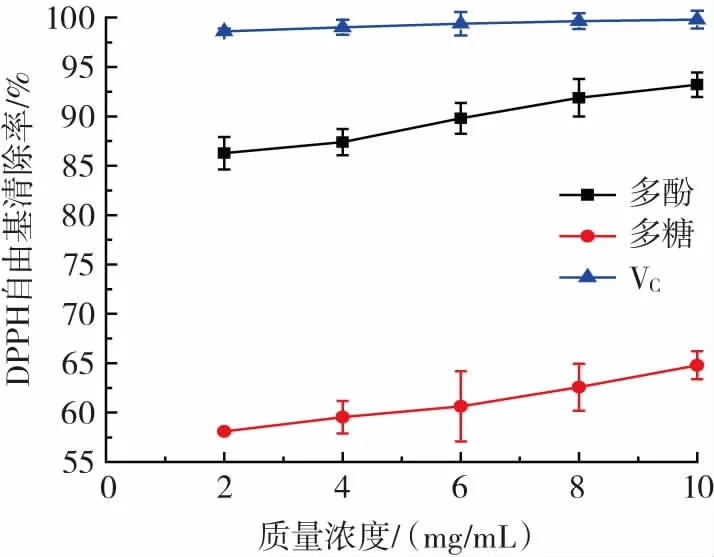
图6 酸浆多酚和多糖清除DPPH自由基能力Fig.6 DPPH radicals scavenging ability of Physalis alkekengi polyphenols and polysaccharides
由图6可知,双水相提取酸浆多酚和多糖均对DPPH自由基有清除能力,其清除率随浓度的增大而升高。同浓度下多酚对DPPH自由基的清除率显著高于多糖,且均低于对照VC的DPPH自由基清除率。多糖清除DPPH自由基能力与巫永华等[20]的研究不一致,原因可能是多糖未纯化,且水相中的磷酸氢二钾含量高,影响多糖纯度,进而影响多糖抗氧化能力。
2.5 酸浆多糖和多酚的铁离子还原能力
酸浆多糖和多酚的铁离子还原能力见图7。
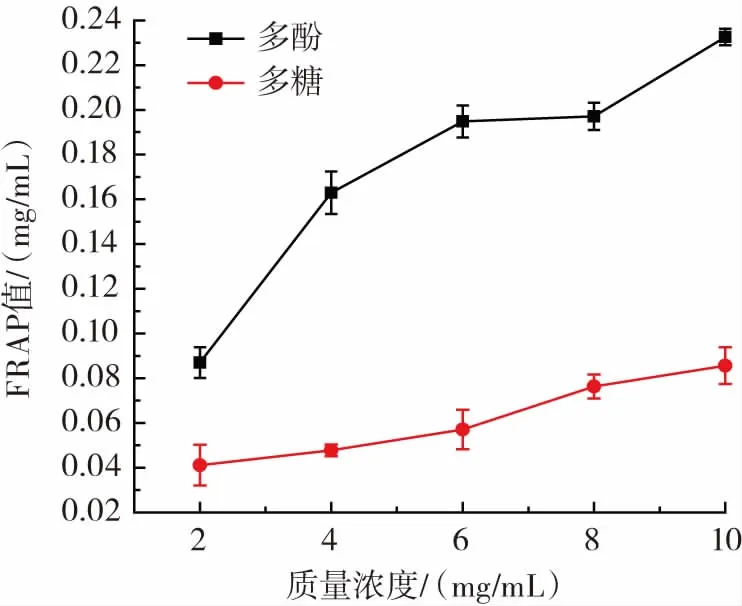
图7 酸浆多酚和多糖的铁离子还原能力Fig.7 Iron ion reduction ability of Physalis alkekengi polyphenols and polysaccharides
由图7知,酸浆多酚、多糖抗氧化能力均与浓度成一定的量效关系。在浓度2 mg/mL~10 mg/mL时,酸浆多酚的FRAP值显著高于多糖的最高值,10 mg/mL的酸浆多酚的FRAP值为0.239 6 mg/mL,同浓度的多糖仅为0.085 6 mg/mL,说明酸浆果实多酚和多糖具有一定的抗氧化性且有差别。
3 结论
采用正交试验对超声辅助双水相法提取酸浆果实多酚和多糖的工艺进行优化,优化的酸浆多酚提取工艺为乙醇的质量分数24%、料液比1∶40(g/mL)、K2HPO4质量分数20%、超声温度20℃;酸浆多糖最佳提取工艺:乙醇质量分数18%、料液比1∶40(g/mL)、K2HPO4质量分数41%、温度55℃。最优提取条件下多酚、多糖的萃取率分别为83.44%、89.16%;得率分别为14.774 4、15.8 mg/g;萃取率相对标准偏差分别为1.27%、1.78%,说明该粗提工艺结果合理可重复。体外抗氧化评价结果显示酸浆多酚具有较好抗氧化活性,而酸浆多糖较差,可能与双水相提取酸浆多糖未进行纯化有关,有待进一步研究。
