我国红皮梨资源及果实着色机制研究进展
2022-01-08杜昱彤曲柏宏李润文
杜昱彤, 曲柏宏*, 李润文
(1.延边大学 农学院,吉林 延吉 133000;2.梅河口市园艺特产工作站,吉林 梅河口 135000)
梨是我国栽培的重要果树之一,栽培面积和产量位居世界第1位。我国是梨属植物最主要的原产地之一,梨的原种起源于第3纪的我国西部或西南部山区,现已命名的梨属植物种、变种和类型有900个以上,但基本种可能有20个[1]。在丰富的梨属种质资源中,有13个种和1 600多个梨品种起源于我国[2]。梨属种质资源按果皮颜色划分为绿皮梨、褐皮梨和红皮梨3种类型,其中,红色是花青苷积累的结果,而褐色是由于木栓层覆盖果面而形成的[3]。在我国白梨、秋子梨大多为绿皮梨类型,砂梨主要为绿皮梨类型和褐皮梨类型,而新疆梨和西洋梨主要为绿皮梨类型和红皮梨类型[4]。在我国现存的红皮梨品种较少,其中,着色鲜艳、品质优良、果形大的品种就更为少见。
大量研究表明,果皮红色取决于花青苷的含量和组成,花青苷受各种环境因素的影响,其生物合成受结构基因、调控基因和转录因子的共同调控[5]。随着对梨果实着色基因组学、转录组学等分子机制研究的不断深入,关于梨果皮着色相关基因的克隆、差异表达、转化验证等报道越来越多,使得利用分子手段进行红皮梨种质改良成为可能[6]。而我国关于红皮梨种质资源相关的研究主要集中在云南地区的红皮梨品种,以及新疆库尔勒香梨等品种,对苹果梨等特色梨品种的相关研究报道较少。该文主要综述了我国红皮梨种质资源,总结了国内关于梨果实着色机制方面的相关研究进展,探讨我国红皮梨种质资源与果实着色研究方面存在的问题,以期为今后揭示梨果实着色机理提供理论依据。
1 我国红皮梨种质资源与育种
1.1 我国红皮梨资源
我国的红皮梨资源主要分布在西南地区的云南及四川,以砂梨系统为主;少部分分布在华北和东北,以白梨和秋子梨系统为主[7]。其中,西南地区的云南省地处低纬度、高海拔地区,热量资源丰富、光照充足,果实成熟期昼夜温差大,十分有利于红皮梨的着色,且拥有极其丰富的红皮梨资源,包括火把梨、巍山红雪梨、红水扁梨、砚山红香酥梨、巍宝梨、弥渡香酥梨等品种,这些品种着色面积可达到1/2或3/4以上,性状稳定,是我国优质的红皮梨种质资源[8]。在我国北方地区也有少量红皮梨资源分布,如新疆的库尔勒香梨、鞍山的南果梨以及延边的苹果梨等品种,这些品种在北方地区种植,由于受到不定的环境因素限制,着色不均且普遍着色效果不好,不能够充分展现出红皮梨的特点,从而限制了其发展。红皮梨因其外观鲜艳漂亮,深受消费者的喜欢,但我国的红皮梨种质资源相对较少,因此,开展红皮梨种质资源创新与新品种选育成为目前国内梨研究领域的重点之一。
1.2 我国红皮梨育种
近些年来,我国科研工作者培育出许多品质优良的红皮梨新品种。通过对引进的西洋梨品种与我国固有的红皮梨品种进行杂交选育,培育出了具有西洋梨优点且适合在我国种植的新品种,如中国农业科学院果树研究所以“八月红”和“红香酥”进行人工授粉杂交,选育出的红皮梨新品种“华艳”[9]和“华蜜”[10];以“八月红”作母本、“酥梨”作父本杂交培育的白梨、砂梨和西洋梨的杂交种“红宝石”,抗寒且抗病性强,适合在华北北部、西北地区及东北三省种植[11];用“幸水”和“火把梨”杂交选育出了“红酥脆”、“满天红”和“美人酥”一系列新品种[12]。中国农业科学院郑州果树研究所用“库尔勒香梨”作为母本、郑州“鹅梨”作为父本,先后培育出“红香酥”[13]和“红香蜜”[14]等品质优良的红皮梨新品种。山西省果树研究所用“库尔勒香梨”和“雪花梨”进行杂交,选育出内在品质很好的红皮梨品种“玉露香”[15]。吉林省农业科学院果树研究所从“南果梨”与“晋酥梨”的杂交组合中选育出抗寒红皮梨新品种“寒红梨”[16]。沈阳农业大学以“南果梨”与“苹果梨”杂交选育出色泽鲜红、品质极佳、抗寒丰产、抗病性强的南苹梨[17]。
研究发现,苹果梨在自然生长条件下,果实底色为绿色,在阳面能够着红色,而对其果实进行套袋处理,在采收前期进行解袋,果实表面着色效果更好[18],并可以改善苹果梨内在品质,从而提高果实的商品价值[19]。苹果梨作为能够大面积着色的特殊梨品种,具有独特的果实品质和育种价值。以其作为骨干亲本对我国梨育种贡献率最大,以其为亲本育成了34个F1代品种(表1),其中,包括5个芽变品种和3个实生品种以及26个杂交品种;由这些品种又衍生出了34个F2代及F3代品种(表2),构成了梨育种第1大族系——苹果梨族系[20]。在以“苹果梨”为亲本育成的1代品种和衍生的多代品种中,“苹果梨”ד砀山酥梨”杂交后代“硕丰”的果实着色近于全红;以“早酥”为亲本衍生的“红早酥”、“早酥红”、“八月红”、“红宝石”等品种色泽鲜艳,已经在全国多地进行广泛栽培,大多数为品质佳、果大、耐贮藏,且抗寒、抗病虫害能力强的优良品种,具有较高的红皮梨育种价值以及广阔的推广应用前景。

表1 以苹果梨为亲本育成的F1代品种
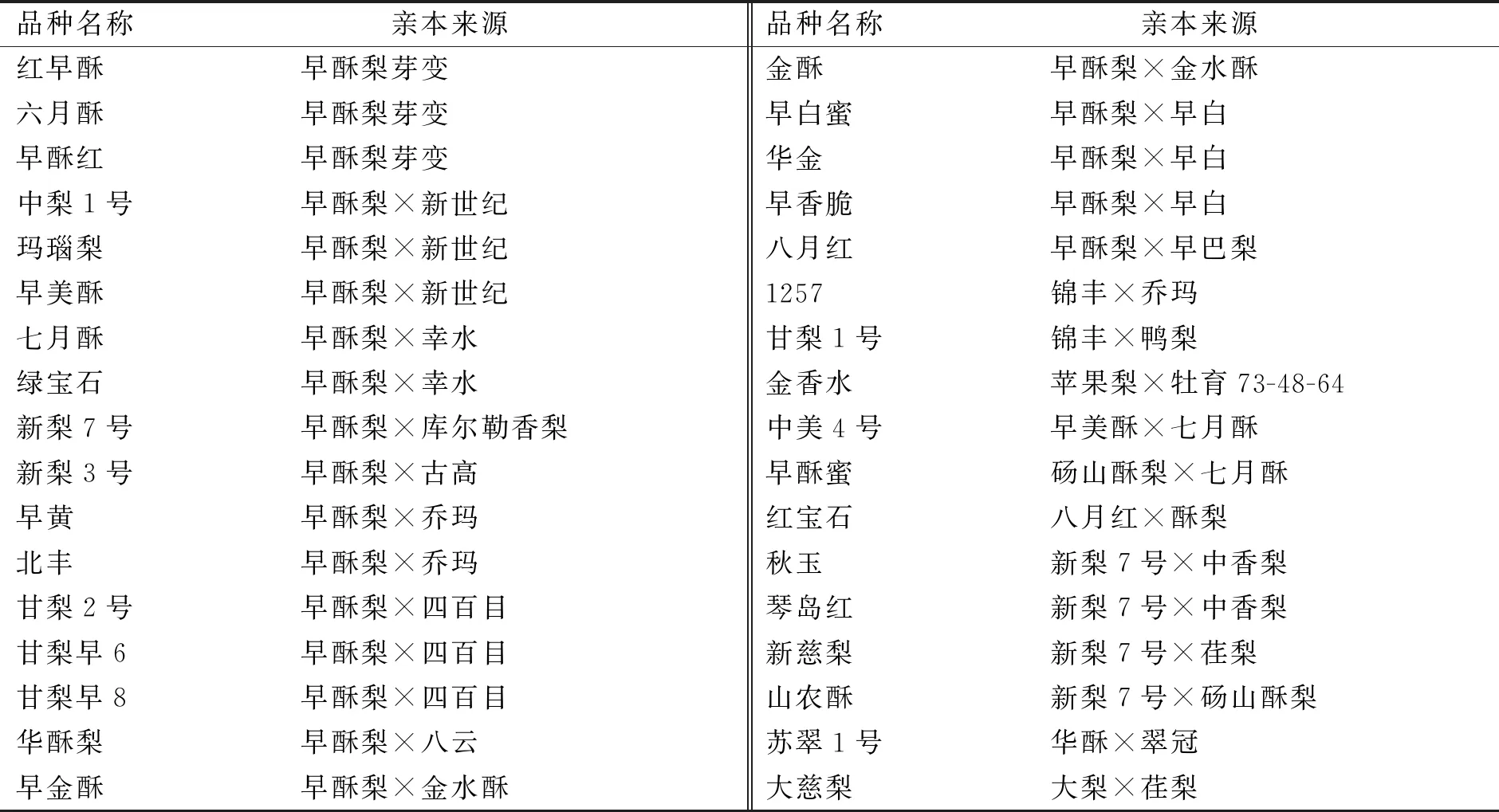
表2 以苹果梨为亲本育成的F2代和F3代品种
2 梨果实着色机理研究进展
2.1 梨果皮中花青苷含量与组分
果实的色泽是衡量外观品质的一个重要指标,但果实的色泽发育是一个复杂的生理过程。研究发现,梨果实的颜色主要是由叶绿素、类胡萝卜素和花青素的含量来共同决定的,其中,花青苷的积累使梨的果皮表现出红色,叶绿素、类胡萝卜素的积累使梨果皮分别表现出绿色和黄褐色,其中花青苷对果实着色的影响作用最大[21]。
花青苷是花青素与含糖苷键的糖类结合形成的一种黄酮多酚类化合物,又名花色苷、花色素苷,广泛存在于花、果实、茎、叶和根细胞的细胞质中,是一类次生代谢产物,种类繁多,具有组织、种质和物种特异性,属于苯丙烷类次生代谢产物[22],其合成的时期和合成的量决定果实的着色程度[23]。自然界中普遍存在的花青素种类有天竺葵素、矢车菊素、芍药素、飞燕草素、锦葵素和矮牵牛素等6种[24]。花青素是天然的抗氧化剂,具有抗癌性、保护心血管、抑菌、降低肥胖及II型糖尿病的发病率等药理作用,同时它能保护人体免受自由基等有害物质的侵害[25]。花青素主要以糖苷类形式存在,增加了它的稳定性和水溶性。普遍存在的有3-单糖苷、3-双糖苷、3,5-双糖苷和3,7-双糖苷4种类型,梨果实中最普遍的是矢车菊色素-3-葡萄糖苷[6]。
花青苷在不同果实中的组成成分并不相同,肖长城等[26]在37个红皮梨品种中研究发现,白梨、秋子梨、西洋梨果皮中以矢车菊素-3-半乳糖苷和芍药素-3-半乳糖苷为主,而砂梨中花色素苷组分主要为矢车菊素-3-半乳糖苷和矢车菊素-3-葡萄糖苷。王甜元等[27]利用高效液相色谱法对苹果梨果皮花色苷组分及含量进行测定,发现苹果梨果皮中花青苷的主要组分为矢车菊素-3-O-半乳糖苷,其含量高达总含量的90%,芍药素-3-O-半乳糖苷含量最低。王龙等[28]研究发现,“红香酥”梨果皮花青苷合成与积累高峰出现在果实发育后期,期间含量有所下降,在接近果实成熟时花青苷含量急剧增加,成熟时达到最高峰。
2.2 梨果实着色与花青苷合成的影响因素
花青苷的生物合成也受多种因素的影响,其调控机制较为复杂。迄今为止的研究结果表明,影响花青苷生物合成的主要因素包括:环境因素、植物激素、转录因子和表观遗传修饰。花青苷生物合成激活受影响因素调控机制如图1所示,MYB转录因子的特点是高度保守的MYB结构域,MYB蛋白通常与bHLH转录因子和WDR蛋白相互作用以调节花青苷的生物合成。植物激素,如:茉莉酸(JA)、赤霉素(GA)、脱落酸(ABA)、乙烯等内在因素,以及光照、温度、肥力等外在环境因素,都会对靶基因的转录激活和花青苷的生物合成、积累和转运产生高度影响。发育过程中环境因素可诱导MYB转录因子的形成,然后激活WDR和bHLH转录因子,从而形成MBW复合体,而MBW复合体由MRE(MYB识别元件)和BRE(bHLH识别元件)组成,它们与靶基因的启动子结合,最终靶基因的转录激活促进花青苷的生物合成。但不同植物物种的花青苷代谢途径及相关基因转录在不同条件下的变化也相应不同。
任小云等[29]研究发现,就改善果实着色效果而言,最适宜“玉露香”梨的果袋种类为外层袋为条纹黄色单光,内层袋为黑色加蜡的木浆纸的果袋,最佳解袋期为采前3周。蔡忠民等[30]研究发现,套袋可以使“南果梨”果实着色指数提高,果点变小,果面光滑,底色变白;且显著影响了其后熟程度,降低了单果重量和维生素C含量;采用内黑外灰内外疏水双层果袋可显著提高“南果梨”着色指数;在落花后60 d套袋,采前10 d解袋最好。刘冰雁[31]利用不同种类的果袋对苹果梨进行套袋处理,然后通过对处理后的苹果梨果皮中的叶绿素、花青苷的含量以及果实品质进行测定,筛选出最适宜苹果梨的果袋种类,结果表明,外层袋为黄褐色纸,内层袋为红色蜡纸的双层果袋对苹果梨果实着色效果最佳,并且单位面积内果点个数也明显减少。李伟等[32]分别在苹果梨盛花后的5个时期进行套袋处理,测定了不同套袋期苹果梨果皮叶绿素、类胡萝卜素及花青素的含量,结果表明,套袋时间越早果皮中叶绿素含量越低。杨林先等[33]对套袋苹果梨进行了不同时期解袋试验,并对果皮叶绿素、类胡萝卜素、花青素的含量进行测定,结果表明,不同时期解袋均影响果实的着色效果,解袋时期过早或过晚果实着色均较慢,采收前10~15 d解袋,果实上色快,且着色艳丽,这段期间果皮中叶绿素含量较低,花青素、类胡萝卜素含量最高,且显著优于其他处理和对照,为苹果梨的最佳解袋时期。张晓东等[34]对云南红梨果实进行套袋处理并探讨光照对其着色和果实品质的影响,结果发现,云南红梨果皮着色指数与光照时间和光照质量有关,自然光、桔黄色光和白色光是诱导果皮花色苷合成的主要色光,其中,自然光对果皮着色影响最大;套袋果实在摘除果袋后接受光照,果皮内的光受体受光诱导后促进花青苷合成途径结构基因的大量表达,使果皮中的花青苷迅速合成并积累,使果实着色面积增加,提高了其商品价值。邬濛[35]发现高温高光处理使“早酥梨”果皮变红,并通过转录组筛选出其中调控花青苷合成的光响应基因PbCOP1.1、PbPIF3.1和PbZAT12,研究表明PbCOP1.1负调控花青苷积累,PbPIF3.1和PbZAT12正调控花青苷积累。赵芫[36]研究了乙烯利、乙烯抑制剂和茉莉酸甲酯对红梨品种“红早酥”果皮着色的影响,发现乙烯利处理通过抑制红早酥梨果皮中花青苷的积累以及提高其他黄色黄酮类化合物的含量诱导果皮变黄且不着红色;乙烯抑制剂通过促进花青苷的积累而使“红早酥”梨果皮变红,茉莉酸甲酯能够协同乙烯利进一步促进黄色黄酮类物质的积累使果皮显著变黄,也能够协同乙烯抑制剂使果皮中积累更多花青苷而变得更红。肖长城等[37]研究发现,在“云红梨2号”果实着色初期,套袋和外源ALA处理均有明显的促进果皮着色的效果,且两者共同处理促进作用更为显著。Bai等[38]研究发现,PpBBX16是光诱导花青素积累的正调节因子,但其本身不能直接诱导花青苷生物合成相关基因的表达,需要与PpHY5共同作用才能调节花青苷生物合成相关基因的表达,进而促进花青苷的合成。白金月[39]通过白天遮光夜晚照灯的方式打破苹果梨光周期、改变其光照时长,并对不同光处理下的苹果梨进行qRT-PCR鉴定,发现遮光处理后PbMyb4-like1、PbbHLH130-like等基因明显上调表达,WDR基因明显下调,而花青苷含量显著减少,果实着色不良,分析这可能是由于在光的调控下改变光周期从而改变基因的表达量,进而影响苹果梨花青苷合成与着色。因此,环境因素(例如光、温度等)以及植物激素对花青苷的生物合成和梨果实的颜色形成具有重要的调节作用。
2.3 梨果实着色与花青苷生物合成的调控
花青苷生物合成过程如图2所示,是通过莽草酸途径经苯丙氨酸支路完成,此过程包含许多步骤,并由不同酶催化[40]。
花青苷的生物合成包括3个阶段,第1阶段由苯丙氨酸到香豆酰CoA,受苯丙氨酸解氨酶(PAL)调控,肉桂酸羟化酶(C4H)和4-香豆酰CoA连接酶(4CL)参与这个过程;第2阶段从香豆酰CoA到二氢黄酮醇,这一过程由查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮-3-羟化酶(F3H)、类黄烷酮-3'-羟化酶(F3'H)或类黄酮-3',5'-羟化酶(F3'5'H)和二氢黄酮醇还原酶(DFR)等参与完成;第3阶段是花青苷的合成,由花青素合成酶(ANS)和类黄酮-3-O-葡糖基转移酶(UFGT)共同完成[41]。
控制植物花青苷代谢的基因分为2大类,一类是以上直接编码花青苷代谢生物合成酶类的结构基因,另一类是通过控制结构基因的表达从而控制花青苷生成的调节基因[42]。调节基因主要包括MYB转录因子、bHLH转录因子与WD40蛋白形成的蛋白复合体等。
2.3.1 梨果实花青苷合成结构基因研究
花青苷合成途径中的结构基因有PAL、CHS、CHI、F3H、F3'H、DFR、ANS和UFGT等,这些结构基因相互协作,最终完成从花青苷合成前体苯丙氨酸到各种主要色素的合成和转化过程。近年来,国内外对园艺植物中果实的花青苷合成结构基因已进行了较多研究报道,国内诸多学者已经从许多梨品种中克隆出CHS、CHI、F3H、DFR、ANS和UFGT等结构基因,并进行基因表达分析。Yu等[43]在2个品种的红皮梨套袋果实中均检测到PpPAL、PpCHI、PpCHS、PpDFR、PpF3H、PpANS和PpUFGT7种花青苷生物合成结构基因的表达,所有这些基因在果实解袋后均显著上调,并在去除袋子后的几天达到峰值,研究结果表明,这些基因均与花青苷的积累呈正相关,在去除袋子后通过光照诱导PyMYB10积累,从而促进花青苷生物合成结构基因的表达,进而增强花青苷的积累。张雪等[44]认为,花青苷生物合成酶在不同的红皮梨品种中作用并不相同,研究发现CHI是“早白蜜”花青苷合成的关键酶,而对于中晚熟品种“中熟32”和“云红梨1号”PAL与CHI只参与花青苷的合成启动。黄春辉[45]对砂梨进行套袋处理,发现在去袋后通过曝光诱导了UFGT等与花青苷合成相关酶的活性,从而促进花青苷快速积累,且在去袋后10 d左右达到高峰。Yang等[46]检测了7种花青苷生物合成结构基因以及3个相关的调节基因的表达,表明ANS和UFGT是红皮梨花青苷生物合成的决定性基因,它们的不同表达导致了西方梨和东方梨之间的着色差异。有研究表明,果皮由绿色到红色的表型变化是UFGT控制调节基因的表达发生作用的结果,认为UFGT基因是花青苷合成途径中的最关键的基因,它负责将糖基连接到不稳定的花青素上,从而使花青素变成稳定的花青苷[47-48]。黄春辉等[49]对2个不同遗传背景的红皮砂梨品种在其着色过程中色素的变化与相关酶活性进行了探究,发现在果实着色初始期,PAL和UFGT活性相继达到最高值,之后随着花青苷的快速合成,PAL活性急剧下降,但UFGT活性一直保持在很高的水平,认为红皮砂梨花青苷的合成积累主要是在果实生长发育后期,PAL与花青苷合成的启动有关,而UFGT与花青苷的积聚密切相关,因此,UFGT基因的研究对于花青苷合成的研究十分重要。在“红早酥”梨中PbUFGT基因序列中含有MYB、bHLH的连接位点,说明PbUFGT基因可以由MYB、bHLH转录因子控制,与其联合控制花青苷生成[50]。而在“巴梨”红色芽变品种“红巴梨”幼果期果皮中UFGT表达量约为“巴梨”的2倍,但在果实成熟期其表达量低于“巴梨”,并且发现该基因在“红巴梨”果肉中不表达[51],因此,对于UFGT与花青苷合成的关系仍需要进一步深入研究。作者所在课题组近年来采用同源克隆及实时荧光定量PCR的试验方法,从苹果梨中成功克隆了PAL、CHS、CHI、DFR、ANS和F3H等结构基因,并对其在苹果梨解袋前后果实着色过程中的表达特性及与花青苷积累的关系进行分析,发现这些基因的表达量与果实着色及花青苷含量关系密切,表明这些结构基因对果实花色素苷积累具有促进作用[52-57]。
2.3.2 梨果实花青苷合成调节基因
国内关于梨果实着色调节基因的研究在MYB转录因子家族报道相对较多。根据MYB蛋白所含R基序数目的不同将MYB转录因子家族分为4类(R1-MYB、R2R3-MYB、R1R2R3-MYB和R4-MYB),其中R2R3-MYB家族最为庞大,大多MYB家族基因跟花青苷积累呈正相关,并且已经研究发现,R2R3型MYB基因跟花青苷生物合成密切相关[58]。冉昆等[59]利用RT-PCR和RACE技术对“杜梨”MYB家族基因进行克隆,获得了2个杜梨MYB基因Pb3RMYB和Pb4RMYB,分别属于3RMYB和4R-MYB亚家族。钱敏杰[60]在梨的“满天红”和“凯斯凯德”两个品种中研究发现,PpMYB10的表达水平可以受套袋处理及采收后紫外光、可见光处理的影响,并发现MYB10不同启动子区段的DNA甲基化程度都会影响MYB10的表达活性,进而影响梨果实外观显色情况。Feng等[61]从亚洲梨“奥冠”中分离出R2R3-MYB转录因子基因PyMYB10,序列分析表明,PyMYB10基因是调控红肉苹果中花青苷生物合成的MdMYB10基因的直系同源基因,经在基因组水平上鉴定发现PyMYB10具有3个外显子,其上游序列包含参与光反应的顺式作用调控元件的核心序列。通过对果实进行套袋解袋处理发现光可以诱导PyMYB10的表达从而促进花青苷的生物合成,并且过表达PyMYB10的转基因拟南芥植物在未成熟的种子中表现出异位色素沉着,该研究表明,PyMYB10在调节花青苷生物合成中发挥重要作用,且PyMYB10的过表达足以诱导花青苷的积累。孙莎莎[62]从“奥冠梨”果皮中分离PyMYB10基因时,得到另一个花青苷调控基因PyMYB10.1,通过酵母双杂交、双分子荧光互补以及烟草瞬时表达分析表明,PyMYB10.1和PyMYB10为同源基因,均可响应光照与MeJA信号,可以通过与bHLHs互作共同激活花青苷结构基因的表达,进而促进花青苷合成。鹿艳新等[63]以延边“苹果梨”果实为试材,采用同源克隆的试验方法,研究了果实着色过程的转录基因PyMYB114,并对其进行生物信息学分析,通过同源性分析表明,PyMYB114基因与白梨的MYB114基因核酸序列的相似性高达99%,系统进化树表明,PyMYB114编码的氨基酸和白梨的MYB114编码的氨基酸在进化上亲缘关系最近。刘冰雁[31]成功构建了PbMyb4-like1、PbMyb4-like2、PbMYB1R1、PbWDR基因的过表达载体,通过冻融法导入到农杆菌GV3101中,在番茄中进行瞬时表达,试验结果表明,转入pRI-PbMYB1R1过表达载体的番茄果实花青苷含量显著高于对照和其他处理。
bHLH是具有碱性-螺旋-转角-螺旋结构的一大类基因,其成员主要有c-MYC、MADL、MAX、MIXL和MNT基因。bHLH转录因子能够与某些跟花青苷合成有关的关键基因相结合,以促进花青苷的产生与累积。孟富宣等[64]利用生物信息学方法对云南红皮梨bHLH基因进行分析,对不同植物间bHLH基因氨基酸序列的同源性比对,并且对该基因编码的蛋白质的理化性质、结构和功能等进行预测和分析。结果表明,该蛋白属于亲水性蛋白,其二级结构中的主要结构元件是α-螺旋和无规则卷曲,并散布于整个蛋白。有研究表明在花青苷的转录调控中MYB和bHLH常作为复合物起作用,如张士伟[50]在“红早酥”梨上利用克隆得到PbUFGT基因,并且发现MYB与bHLH转录因子均能与PbUFGT基因启动子结合,共同调控PbUFGT基因的表达。崔道雷[65]通过试验发现,云南红梨的PyMYB、PybHLH和PyWD40 3个转录因子,作用于结构基因PyANS、PyDFR和PyUFGT,两两相互作用,共同促进花青苷的积累。Yao等[66]克隆得到PyMYB114,通过在烟草叶片、草莓和梨果实中的瞬时转化发现其与PyERF3、PybHLH3相互作用共同调控梨花青苷生物合成。孟义淳[67]在苹果梨果实中克隆得到PbbHLH130、PbMYC2基因,并利用qRT-PCR方法测定自然生长条件下的苹果梨与套袋后不同时期解袋的苹果梨中上述基因的差异表达,发现PbbHLH130、PbMYC2与花青苷的积累呈显著正相关,推测其为花青苷合成过程中重要基因。
WD40蛋白家族的成员具有4~10个随机的WD重复结构域,每个结构域包含约40个以色氨酸(W)和天冬氨酸(D)结尾的氨基酸序列。WD40蛋白质本身没有催化功能,但可以与多种蛋白质可逆地相互作用,从而为组装大型蛋白质复合物提供平台或链接。许多研究表明,花青苷合成途径主要受植物中的多种三元MBW(MYB-bHLH-WD40)复合物调控。其他转录因子,例如WRKY、ERF、NAC和bZIP也可以协调或参与花青苷合成的调节,从而丰富了花青苷的调节网络[68],但目前国内缺少这些转录因子与红梨花青苷积累关系的相关研究报道。
2.3.3 转录组技术在梨果实着色研究中的应用
转录组学能够在整体水平上研究细胞中基因转录情况及调控规律,其研究对象是植物细胞在特定功能状态下转录出的所有RNA的总和,包括多聚腺苷酸信使RNA(m RNA)、前体m RNA(pre-m RNA)和非编码RNA(noncoding RNA)[69]。转录组是连接基因组遗传信息与生物功能的蛋白质组的必然纽带,也是生物体最重要的调控方式。目前,利用分子生物学及生物工程技术手段进行转录组学分析,能够在较短的时间里了解果树细胞中基因的转录情况及转录调控规律,可以进一步解析果树各种性状,同时也可以为培育高产、优质和抗逆的果树新品种奠定坚实基础[70]。
近年来,转录组分析在梨果实发育、抗性研究、品种鉴定等方面取得了一些进展,其中,齐丹[71]对4个绥中地方梨品种及秋白梨的8个可能变异单株进行了EST-SSR鉴定分析,对7号单株进行了亲本鉴定,认为秋白梨是其亲本之一,同时可排除绥中谢花甜、水红霄和洋红霄为其亲本;王西成等[72]发现,“1293条梨”的EST序列中含有SSR位点的序列为82条,SSR位点92个,二核苷酸、三核苷酸和六核苷酸重复是最主要的SSR类型,分别占48.91%、17.39%和17.39%;刘汉婷[73]以“早酥”梨及其红色芽变“红早酥”为材料,利用花托和叶片转录组分析,筛选得到在白梨中尚未有研究报道的编码GST转运蛋白的基因PbGSTF12和编码MATE转运蛋白的基因PbTT12;韦云[74]以“南果梨”及其红色芽变“南红梨”果皮为试验材料进行转录组测序,分析发现结构基因PuUFGT和调控基因PuMYB10、PuMYB12基因的表达在2个品种中表达差异明显且与“南果梨”和“南红梨”果皮花青苷合成变化一致;为确定引起“南果梨”和“南红梨”果皮着色差异,又在转录组测序中获得了9个蛋白激酶相关基因,对这9个基因在“南果梨”和“南红梨”果皮不同发育时期表达情况进行分析,发现其中2个基因在“南红梨”中比在“南果梨”中表达量高,初步推测这2个基因可能在“南果梨”和“南红梨”果实着色差异中起作用;杨雅楠[75]利用Illumina测序平台对“早红考密斯”及其绿色芽变品种各3个发育时期果实的果皮进行数字化表达谱测序,并比较不同发育时期“早红考密斯”及其绿色芽变品种之间的转录组,发现除了已知的MYB家族以外,还出现了AP2、WRKY和MADS等3个新的转录因子家族,与花色素苷生物合成有一定的相关性;刘冰雁[31]通过Illumina测序平台对苹果梨果实解袋后3个发育时期果皮进行测序,比较不同发育时期之间测序数据,共获得91.36Gb Clean Data,各样品的Reads与参考基因组的比对效率为65.14%~66.92%。其中,差异基因表达共有1 371个,575个上调差异表达,796个下调差异表达;并通过比较转录组学和基因表达分析,确定了几个与花青苷生物合成相关的关键基因,包括MYB类、bHLH类、WDR和DFR等。
3 问题与展望
我国丰富的梨种质资源为红皮梨育种工作奠定了良好材料基础,但较中国丰富的梨种质资源而言,红皮梨品种育种的利用率相对较低,还有一部分已经育成的红皮梨品种果实品质较差,性状不稳定且不耐贮藏,此外一些品种只适合生长在部分地区,缺少能够使这些红皮梨大面积着色的自然环境条件。因此,未来在对我国固有的红皮梨种质资源进行保存的同时,也要对已培育出的红皮梨品种进行遗传改良选育,并充分挖掘我国红皮梨种质资源的优异性状,选育出更多的红色性状稳定、抗性强、耐贮藏、丰产性好的优质品种。
在当前大数据背景下,基因组学、转录组学、蛋白质组学和代谢组学的综合分析将为果实花青苷调节模型和代谢途径的未知部分提供新的思路,并为揭示果实色泽和其内在品质之间的关系奠定基础。花青苷合成代谢是一个复杂的调控网络,尽管在苹果、猕猴桃和草莓等其他园艺植物中已经开展了较多有关花青苷合成代谢与调控等方面的研究工作,但不同果树花青苷合成过程中关键酶基因的表达涉及多种调控因子,且调控因子调控的关键酶基因也不尽一致,当前的研究成果还不足以揭示红皮梨花青苷生物合成代谢的全貌。在已经发表的一系列与梨果实着色相关的报道中,大部分局限于对西洋梨以及个别砂梨品种的研究,而关于白梨、秋子梨和新疆梨种类中的库尔勒香梨、苹果梨等红皮梨品种研究还不深入。关于红皮梨性状遗传规律、着色机制研究以及可辅助红皮梨育种的实用分子手段等方面尚存在较多问题,今后我国红皮梨的研究重点应该放在对现有的红皮梨资源进行收集、保存以及农艺性状和遗传多样性研究;筛选优良红皮梨品种,充分利用苹果梨、库尔勒香梨等特色梨品种以及选育出的红皮梨新品种的果实特点进行杂交并选育出优质红皮梨品种;深入开展红皮梨花青苷合成相关基因的克隆、表达和功能分析以及转录组、基因组、蛋白组学研究工作,加强连锁分析、基因定位发掘与基因表达、功能验证相结合的综合研究,以寻找出关键基因并结合生物技术手段培育红皮梨新品种;加强红皮梨花青苷积累水平影响因素研究,探究影响红皮梨花色苷代谢的环境因子和调控措施,研发红皮梨外观品质提升栽培管理综合配套技术,进行大规模红皮梨商业化开发,从而为推动我国红皮梨资源利用、红皮梨育种及产业化发展提供技术支撑。
