蔷薇科植物果实花青苷积累研究进展
2021-01-22卢雯瑩赵磊李天奇崔鹤云廖平安
卢雯瑩 赵磊 李天奇 崔鹤云 廖平安
(1. 漯河市农业科学院,漯河 462000;2. 中国科学院武汉植物园,武汉 430074;3. 漯河市农业农村局,漯河 462000)
蔷薇科植物是自然界的重要组成部分,世界上许多水果,如苹果、梨、草莓和桃等均属于蔷薇科植物。蔷薇科果实因富含花青苷而具有丰富多彩的颜色。花青苷作为一种重要的抗氧化酚类化合物,具有预防心血管疾病、抗炎抗癌活性,是重要的保健物质[1]。近年来,消费者对水果保健功能的要求越来越高,如何提高水果的花青苷含量是果树学家长期研究的课题。
不同于糖酸代谢,花青苷是植物体内重要的次生代谢产物,代谢起始物质为葡萄糖分解产生的苯丙氨酸。花青苷的生物合成途径已十分清晰,研究表明,光照和温度等外界环境、乙烯和茉莉酸等激素水平均能调节花青苷代谢,从而影响果实的花青苷含量。随着分子生物学技术水平的提高,科学家们对花青苷积累的的分子机理进行了探索,这些机理将为提高蔷薇科果实花青苷含量奠定坚实的理论基础。为此,本文对近些年来有关蔷薇科果实花青苷积累的分子调控机理研究进行了综述。
1 花青苷生物合成及转运途径
植物之所以显示颜色,主要是富含叶绿素、类胡萝卜素、甜菜素和黄酮类等物质,花青苷作为黄酮类的重要组成,对园艺作物果实色泽有着重要的影响[2-3]。20世纪初,Weldon[4]对孟德尔关于豌豆着色的研究进行了总结,自此,花青苷生物合成途径被不断完善。基于前人对玉米、金鱼草和矮牵牛花色突变体的研究,Holton等[5]第一次详细总结了植物花青苷生物合成途径。花青苷合成起始于苯丙氨酸代谢产生的香豆素-辅酶A和乙酸代谢途径产生丙二酰-辅酶A,在查尔酮合成酶(Chalcone synthase,CHS)的催化下,1分子香豆素-辅酶A和3分子的丙二酰-辅酶A形成4-羟基查尔酮,经查尔酮异构酶(Chalcone isomerase,CHI)催化,4-羟基查尔酮生成柚苷配基,在黄烷酮-3-羟化酶(Flavanone 3-hydroxylase,F3H)、黄烷酮-3'-羟化酶(Flavonoid 3'-hydroxylase,F3'H)和黄烷酮-3',5'-羟化酶(Flavonoid 3',5'-hydroxylase,F3'5'H)催化下,柚苷配基产生矢车菊色素和飞燕草色素,经二氢黄酮醇-4-还原酶(Dihydroflavone alcohol-4-reductase,DFR)还原成无色花青素,再经无色花色素双加氧酶或花青素合成酶(Leucoanthocyanidin dioxygenase,LDOX或ANS)催化产生显色花青素,在葡萄糖基转移酶(Flavonoid/anthocyanidin 3GT,UFGT)的作用下,完成糖基化修饰,生成各种花青苷。最后,O-甲基转移酶(O-methyltransferase,OMTs)完成甲基化修饰,产生锦葵色素、芍药色素和矮牵牛色素等最终产物[6-11]。植物中花青苷的生物合成十分保守。近几十年来,随着分子生物学的兴起,花青苷生物合成途径基因在蔷薇科果实中也不断被克隆。使用软件Clustalx和网站BoxShade(https://embnet.vitalit.ch/software/BOX_form.html),对花青苷生物合成途径关键基因CHS、DFR和UFGT在拟南芥及常见蔷薇科不同种属部分物种(表1)间进行蛋白多序列比对,结果发现这3个基因蛋白序列都较为保守;CHS、DFR这2个基因的蛋白序列在拟南芥中存在明显的分化,但在蔷薇科果实中十分保守(图1-A、1-B);相较于CHS、DFR而言,虽然UFGT序列上存在差异,但其蛋白相似性依然较高(图1-C)。尽管在蔷薇科不同种属果树中都找到了控制花青苷生物合成的基因,但由于基因表达以及拷贝数不同,造成了不同果实积累的花青苷种类和含量存在差异。
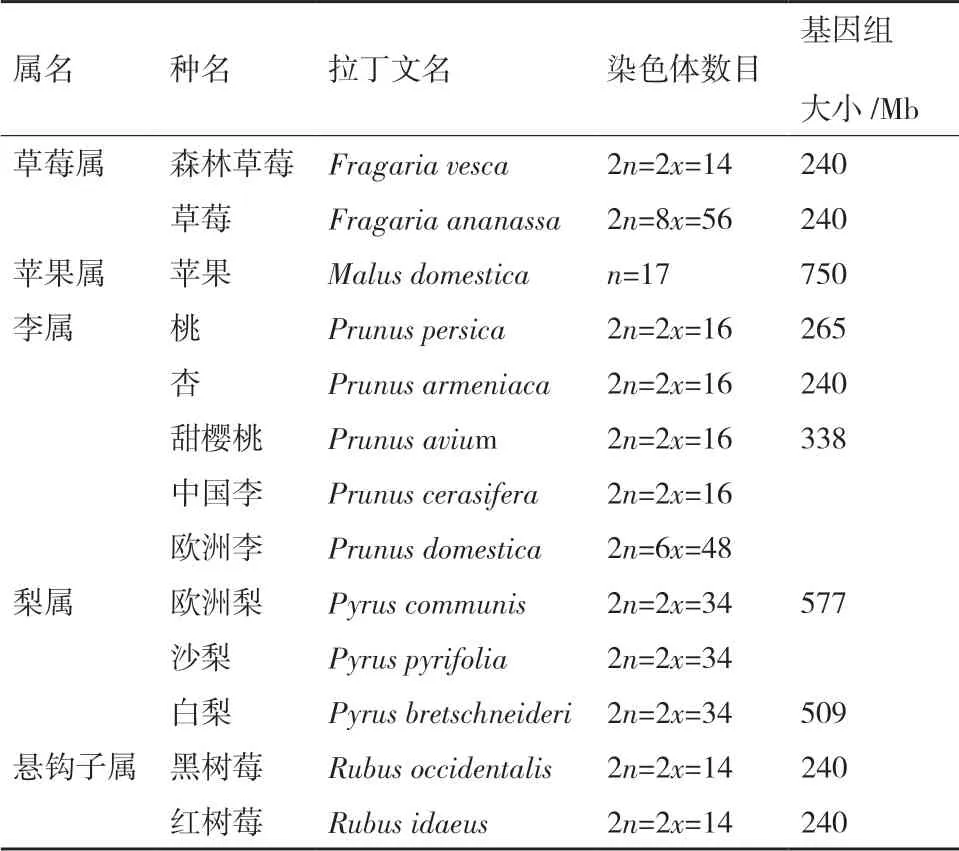
表1 常见蔷薇科植物种属信息
细胞质中形成的花青苷转移到细胞液泡中进行储存。液泡内稳定的环境使花青苷免于降解而显示多种颜色。近年来,科学家们在研究如何提高花青苷生物合成途径基因表达量的同时,也关注花青苷液泡转运对于果实积累花青苷的决定性影响。目前,在蔷薇科果实花青苷转运方面,主要集中在对多药与毒性化合物排出转运蛋白(Multidrug and toxic compound extrusion,MATE)和谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)转运体的研究。蔷薇科不同种属果实中GST转运蛋白序列相对保守(图2)。Gomez等[12]通过对葡萄转基因毛状根花青苷自发荧光的分析,揭示了MATE对参与以小囊泡为介质,转移花青苷到液泡这个过程中所起的关键作用,而GST转运体则可能通过直接结合花青苷的方式完成液泡转运。GST对花青苷转运的重要影响先后在草莓、苹果、梨、桃等果实上得到证实[13-16]。蔷薇科不同种属果实中GST转运蛋白序列相对保守(图2)。
2 调节基因对花青苷积累的影响

植物花青苷生物合成基因的表达受MYB-bHLHWD40,即MBW复合体的调控,作用机制相对保守。MBW复合体是由MYB转录因子(蛋白序列含一至多个MYB结构域)、bHLH转录因子(蛋白具有螺旋-环-螺旋结构)和WD40蛋白(蛋白由40个左右的氨基酸残基组成,具有保守WD序列)特异互作形成(即MYB与bHLH直接互作,bHLH与WD40直接互作,这种互作在苹果果实中得到验证[17])。对模式植物拟南芥花青苷形成的调控机理研究表明,AtMYB11/12/111等MYB转录因子对花青苷生物合成的早期基因AtCHS、AtCHI、AtF3H和AtF3'H有激活表达的作用,后期合成基因AtDFR、AtLDOX、AtUFGT的表达受AtMYB75/90/113/114等形成的MBW复合体进行调控[18-19]。由此可见,MYB转录因子对花青苷生物合成基因的调节起着至关重要的作用。MYB转录因子由于其结构域数量的差异,功能而有所不同。目前在蔷薇科果实花青苷研究领域,主要集中在对R2R3 MYB转录因子的研究。

图1 主要蔷薇科植物CHS(A)、DFR(B)和UFGT(C)蛋白多序列比较

图2 主要蔷薇科植物GST转运蛋白多序列比较
在不同苹果品种中分离得到MdMYB1、MdMYB10、MdMYBA这3个高度同源的R2R3类型MYB基因,MdMYB1和MdMYBA对苹果果皮着色起关键作用[20-21],而苹果果肉着色主要受MdMYB10调控[22]。另外,对苹果果实外源施加茉莉酸后,MdMYB9和MdMYB11表达量升高,二者可与MdLDOX、MdANR和MdLAR的启动子结合,促进花青苷和原花青苷的生物合成[23]。MdMYB24L被激活表达并作用于MdUFGT启动子上,促进花青苷积累[24]。与拟南芥同源的MdMYB3能激活MdCHS、MdCHI、MdUFGT、MdFLS等基因的表达,促进包括花青苷在内的众多黄酮类物质积累[25]。苹果MdMYB308L受冷害诱导表达,协同MdbHLH33增强与MdCBF2和MdDFR启动子的结合,促进苹果果实着色[26]。
从沙梨(Pyrus pyrifolia)和西洋梨(Pyrus communis)果实中克隆得到的PyMYB10和PcMYB10两个R2R3类型基因[27-28]对花青苷积累起着决定性作用。Feng等[29-30]通过全基因分析,从不同沙梨品种中克隆了另外2个促进花青苷积累的R2R3类型MYB转录因子:PyMYB10.1和PyMYB70。PyMYB10.1的作用模式和PyMYB10相同,通过与PybHLH形成复合体,激活花青苷生物合成基因表达。库尔勒香梨(Pyrus bretschneideri Rehd)PbMYB10b和PbMYB9通过激活PbDFR和PbUFGT的表达,促进花青苷生物合成[31]。梨果实着色的原因则是位于5号连锁群的PyMYB114与PyERF3、PybHLH3形成复合体,共同激活下游靶基因的结果[32]。
对花青苷生物合成起关键作用的R2R3类型MYB转录因子,在其他蔷薇科果实中也逐渐被报道发现。草莓FaMYB10、中国李PcMYB10.6、桃PpMYB10.1、甜樱桃PavMYBA和PavMYB10.1、杏PaMYB10等基因已被证实对果实的花青苷积累有重要作用[33-38]。在不同品种桃果实中,位于3号染色体串联重复的PpMYB10.1、PpMYB10.2、PpMYB10.3基因表达存在差异,其中,PpMYB10.1对桃果实花青苷生物合成起着最为关键的作用[10,34,39]。MYB转录因子除了有促进花青苷生物合成的作用外,一些还具有抑制花青苷积累的作用。在拟南芥的研究中发现,R2R3类型MYB转录因子中AtMYB4/6/7/32抑制花青苷合成。目前对蔷薇科果实花青苷抑制型转录因子的研究,同样集中在R2R3类型MYB转录因子,如草莓FaMYB1(从Fragaria×ananassa克隆得到)和FcMYB1(从Fragaria chiloensis克隆得到)、桃PpMYB18、苹 果MdMYB16和MdMYB15L、梨PbMYB120等[40-45]。这些R2R3型MYB转录因子大多数是由于其蛋白C端存在EAR 抑制基序,且与激活型MYB竞争性结合bHLH转录因子,从而减弱花青苷生物合成基因的表达,抑制果实着色。
MYB转录因子除了可以直接激活花青苷生物合成基因表达外,还能直接促进花青苷转运蛋白的表达,促进花青苷的液泡转运。从草莓诱变产生的白色品种YW5AF7中克隆得到的FaMYB10转录因子虽然能直接促进FaGST的表达,但由于FaGST编码的蛋白提前终止使得花青苷无法正常转运至液泡中,从而导致白色性状产生[13]。苹果中重要的花青苷转运蛋白MdGSTF6受MdMYB1调控表达,直接影响花青苷的液泡积累[14]。
使用软件Clustalx和MEGA6.0,对调节花青苷生物合成基因MYB转录因子构建 Neighbor-Joining系统进化树,结果图3所示,绿色和红色覆盖区域分别代表促进型和抑制型MYB转录因子。这些MYB明显分成两大组:其中由绿色线条组成的区域与拟南芥AtMYB75/90/113/114亲缘关系较近,是其同源基因的促进型MYB转录因子;红色线条组成的区域中既包含AtMYB4/6/7/32、FcMYB1、PpMYB18和MdMYB16等在内的抑制型MYB转录因子,也包含AtMYB11/12/111、MdMYB3、MdMYB9和PbMYB9等在内的促进型MYB转录因子,系统进化关系较为复杂。
3 外界环境因素对果实着色的研究
植物感受外界环境变化会产生一系列的代谢反应。光照和温度等外界环境的刺激能引起蔷薇科果实花青苷积累发生显著变化。光照对花青苷积累的影响主要由光强和光质2个因素决定,苹果果实在黑暗环境下,细胞核内的E3泛素连接酶MdCOP1蛋白介导在花青苷积累过程中起重要作用的MdMYB1转录因子的降解[46]。光照能够激活细胞内多条信号通路,促进果实花青苷积累:首先,黑暗条件下,COP1会泛素化降解MdMYB1,光照刺激下,光受体(红光受体PhyA/B,蓝光受体CRY1/2、紫外受体UVR8)会竞争MdMYB1与COP1互作,有效避免MdMYB1降解而稳定存在于细胞核内;其次,光照能够诱导表达光信号途径重要转录因子MdHY5,并直接结合MdMYB10启动子E/G-box元件,促进MdMYB10基因表达[47];另外,光照条件会激活MdBBXs表达。MdBBX1能增强MdMYB10行使其激活花青苷生物合成基因表达的功能[48],MdBBX37与MdMYB1互作后负调控果实着色[49];高光诱导表达MdTCP46蛋白与MdMYB1转录因子形成复合体,增强MdMYB1对下游靶基因的激活能力[50];光照促进MLNC3.2 和 MLNC4.6 这2个lncRNA(长链非编码RNA)的表达,介导miR156a对花青苷的调节[51]。梨PyMYB10基因启动子区域存在光响应元件,其表达量随光照直接发生变化[27],光照同时刺激PyBBX16表达,协同PyHY5转录因子共同激活PyMYB10的表达[52]。二倍体草莓品种“Ruegen”(Fragaria vesca)的果实在光照刺激后,被激活表达的FvbHLH9和FvHY5形成二聚体并结合在下游靶基因FvDFR启动子上,促进果实花青苷的生物合成[53]。
光质对植物的生长发育至关重要,不同光质对果实花青苷积累影响存在差异。Tao等[54]通过比较不同光质对“红早酥”梨果实着色的影响发现,红光对花青苷的影响小,蓝光则能明显促进果实着色。Ni等[55]证实在蓝光条件下,上调表达的Py4ERF24和Py12ERF96转录因子与PyMYB114互作,共同增强对下游靶基因PyUFGT的激活作用,促进梨果实花青苷积累。蓝光能激活草莓花青苷生物合成途径基因表达,促进果实着色[56]。Zhao等[57]发现桃果实对不同的紫外线响应存在品种差异性,紫外线激活PpHYH(HY5 Homolog)、PpGST等蛋白的表达,促进桃果实花青苷积累。紫外线处理促进苹果果实花青苷积累至少存在两条途径:MdBBX20和MdBBX22表达升高,协同MdHY5增强对下游靶基因MdMYB10、MdCHS的激活[58-59];表达升高的MdWRKY72结合MdHY5和MdMYB1基因启动子W-box元件,促进果实着色[60]。
温度会显著影响蔷薇科果树花青苷的积累,并对花青苷的稳定性产生影响。低温处理能促进苹果果实花青苷的积累。一方面,低温胁迫增强了MdbHLH3表达,促进其对下游靶基因MdDFR、MdUFGT和MdMYB1的激活[61];另一方面,MdMYB308L激活表达后协同MdbHLH33增强与MdCBF2和MdDFR启动子结合[26];低温还能诱导MdBBX20表达,与MdHY5形成二聚体共同激活MdMYB10、MdCHS的表达[59]。高温降低了调节苹果花青苷形成的MBW复合体多种组分的转录水平[62]。温度条件对草莓果实着色也有显著影响:低温能够促进FaMYB10、降低FaMYB1的表达,从而促进花青苷积累,高温影响花青苷的稳定性[63-64]。
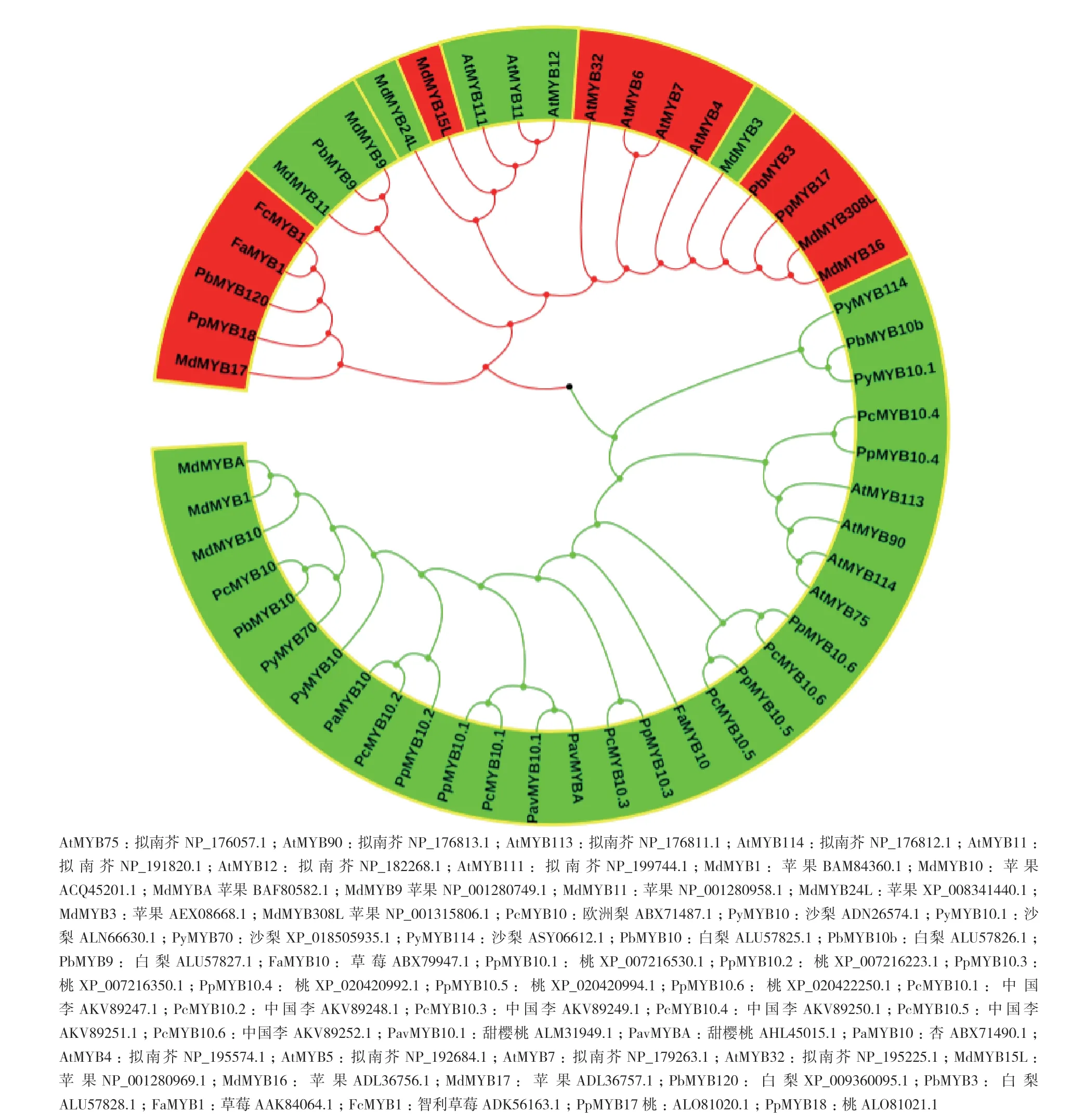
图3 主要蔷薇科植物MYB调节基因系统进化关系
除了光照和温度能影响蔷薇科果实花青苷积累外,干旱胁迫、外源氮等处理等在一定程度上也能影响果实着色。干旱条件下,苹果MdERF38激活表达,协调MdMYB1促进花青苷生物合成[65]。外源氮处理促进苹果氮响应蛋白MdBT2表达并介导MdMYB1泛素化降解[66]。CO2处理草莓果实能下调花青苷生物合成基因表达,抑制采后着色[67]。
4 激素物质对花青苷积累影响的研究
植物激素是一些微量而能调节自身生理过程的有机化合物。激素对植物的生长发育有重要的调控作用。蔷薇科果实花青苷积累受植物激素乙烯(Ethylene,ETH)、茉莉酸(Jasmonic acid,JA)、脱落酸(Abscisic acid,ABA)、生长素(Auxin)等信号通路的影响。
乙烯影响植物成熟衰老,是果实产生的最重要激素之一。乙烯促进蔷薇科苹果、李等果实着色[68-70]。外源添加乙烯处理的苹果果实,乙烯信号通路中MdEIL1和MdERF1B激活表达,直接提高MdMYB1和MdMYB9、MdMYB11等转录因子的表达量,促进果实花青苷积累[69-70]。乙烯对果实花青苷积累具有多重性。研究表明,梨果实施加乙烯处理后,PyMYB10、PyMYB114等转录因子被抑制表达,花青苷积累过程受阻[71]。
茉莉酸影响花青苷积累主要是通过其信号通路重要因子:JAZ蛋白发挥作用的。在拟南芥中,JAZ蛋白与调控花青苷生物合成的bHLH转录因子互作,影响了MBW复合体的功能,抑制花青苷生物合成[72]。在苹果中,茉莉酸可以通过不同的JAZ蛋白发挥调控作用。MdJAZ2可通过结合MdbHLH3进而抑制后者与MdMYB9、MdMYB11的结合作用,因此减弱MdMYB9、MdMYB112个转录因子对MdUFGT的激活[23];MdJAZ8、MdJAZ11可以靶向MdMYC2(bHLH转录因子),抑制MdMYC2与MdMYB24L结合,从而抑制MdMYB24L对MdUFGT的转录[24]。在外源施加JA后,JAZ蛋白被泛素途径降解,从而促进苹果花青苷生物合成基因的表达。同样,梨果实外源添加JA处理后,上调表达的PbERF22增强了PbMYB10对下游PbUFGT的转录活性,促使梨果实着色[73]。
脱落酸促进蔷薇科果实苹果、甜樱桃等花青苷积累[36,74],苹果MdZIP44受脱落酸诱导表达,协同MdMYB1增强苹果果实花青苷生物合成[74]。生长素影响草莓、红树莓和苹果等蔷薇科果实着色[75-77]。对苹果研究表明,生长素通过“MdIAA121-MdARF13”模块介导对花青苷的积累[77]。赤霉素通过其信号通路中不同的酶发挥调节花青苷积累的作用。模式植物拟南芥赤霉素抑制活性酶AtGA2ox1以依赖AtHY5、AtHYH的方式,参与低温诱导花青苷的过程[78]。在梨果实中,赤霉素途径酶PbGA2ox8能诱导果皮花青苷积累,使果皮呈现条状红色[79]。此外,细胞分裂素和油菜素甾醇对蔷薇科果实花青苷积累也有报道。细胞分裂素处理苹果果实,MdMYB10基因上调表达,抑制因子MdMYBL2下调表达,共同促进苹果果实花青苷积累[80-81]。油菜素甾醇处理能上调表达苹果果实花青苷生物合成途径及关键MYB转录因子的表达水平,促进果实花青苷积累[82]。
5 小结
花青苷作为一种重要的抗氧化剂,对蔷薇科植物果实着色起着至关重要的影响。如何提高果实的花青苷含量既是消费者提出的现实要求,也是果树学家们研究的重点方向。在蔷薇科植物不同果实中,花青苷生物合成基因及花青苷转运基因相对保守,其功能也大致相同,但调节机制存在差异。目前,在蔷薇科植物不同果实中均克隆得到AtMYB75/90/113/114的同源MYB基因(图3,绿色线条分支),这些MYB转录因子调节花青苷生物合成作用机制基本相同。但在苹果、梨等果实中还发现了其他MYB转录因子,如苹果MdMYB9、MdMYB11、MdMYB308L和梨PyMYB70、PyMYB114等促进型MYB转录因子及MdMYB15L、MdMYB16和PbMYB120等抑制型MYB转录因子,这表明MYB基因在不同物种中各自分化,在不同的外界或激素响应中起调节作用,发掘不同果实中的MYB调节因子仍是关键。
蔷薇科植物果实花青苷积累调节机制存在差异,不同果实对外界环境或激素处理的响应不同:苹果、草莓等果实着色必须依赖于光照,而桃果实花青苷积累可以不依靠光照,产生“近核红”这一现象;乙烯处理促进苹果、草莓等果实其着色,而抑制梨果实花青苷生成。对于如何提高果实花青苷生成,以往的研究往往集中于某单一因素,但最近的研究发现,环境因子和激素信号通路可以联系在一起。如提高碳供给能介导赤霉素、茉莉酸、细胞分裂素和脱落酸等激素信号关键因子对果实花青苷的促进作用[83-86]。这些研究结果表明,外界环境因素可以直接或间接影响蔷薇科果树激素代谢水品,从而影响着色。也就是说,对果实采取多因素协调控制,可以更好地促进果实着色。
