环丙沙星降解菌的筛选及其降解特性探究
2022-01-07瞿春晓温健竹蔡振东潘道东
瞿春晓, 温健竹, 蔡振东, 潘道东,2, 吴 振*
(1. 宁波大学浙江省动物蛋白食品精深加工技术重点实验室, 浙江宁波 315211;2. 南京师范大学食品与制药工程学院,江苏南京 210097)
抗生素是一类具有抑菌活性的化学物质,在预防和治疗细菌感染疾病上具有良好的效果,但是人们在使用抗生素时却忽略了抗生素对环境的污染问题[1]。 随着医疗和畜牧养殖业的蓬勃发展,抗生素的消费量日益增长,然而抗生素的频繁使用导致环境污染问题日趋严峻,引起全球学者的广泛关注和高度重视[2]。 氟喹诺酮类是一系列广谱合成类抗生素,广泛用作人和兽医药物[3]。 部分氟喹诺酮类药物通过动物代谢很容易进入陆地环境。 环丙沙星是应用于疾病治疗的最为广泛的处方氟喹诺酮类抗生素[4-7],然而经常在环境中检测到高浓度残留,而且环丙沙星被证明具有遗传毒性[8]。 进入环境中的抗生素不仅会诱导环境中抗性微生物和抗性基因的产生,还会加速抗生素抗性的传播和扩散,所以解决抗生素残留问题已刻不容缓[9-10]。
目前,控制抗生素的方法主要有非生物法和生物法。 非生物法包括物理方法、化学方法等,物理方法如原料清洗和特殊材料的吸附作用等;化学方法如臭氧降解、添加化学添加剂等,但是运用这些方法的高成本和尚不明确的安全性限制了它们的长期应用和推广[11]。 生物法是通过生物的代谢作用改变抗生素的物理化学性质, 即破坏抗生素的结构,使其从复杂化合物降解成简单化合物,实现抗生素的生物转化[12]。相比于非生物法,生物法具有成本低廉、降解过程简单等优点,是目前较为经济有效的方法[13]。
乳酸菌作为一类发酵糖类产物为乳酸的益生菌,其特点是革兰氏染色呈阳性。 目前已知的较多乳酸菌作为肠道内的有益微生物,是人类胃肠道中的常驻菌群。 乳酸菌具有较多的益生功能,包括维持肠道菌群的稳定性[14]和预防胃黏膜病变[15]等,在治疗消化道疾病上具有良好的效果[16]。 自然界中存在着丰富的乳酸菌。 有研究表明一些乳酸菌有降解抗生素的功能,郝莹等[17]筛选出一株能降解多种抗生素的乳酸菌,其中对红霉素、罗红霉素与螺旋霉素的降解率分别能达到92.1%、68.9%和82.8%,并且不同菌株的降解能力存在一定差异。 近年来关于如何降低抗生素污染逐渐成为研究热点,而国内外关于抗生素的微生物降解研究集中在磺胺类抗生素上[18]。 因此筛选高效降解环丙沙星的乳酸菌具有重要意义。
作者采用高效液相色谱法筛选高效降解环丙沙星的菌株, 结合菌株生理生化特性和16S rDNA基因序列相似性分析,对菌株进行鉴定。 此外,探究了乳酸菌降解环丙沙星的特性,包括致死菌的吸附和活菌的生物降解等。 对今后开发功能性菌剂,缓解喹诺酮类抗生素的污染奠定基础,也为微生物治理复杂环境的抗生素污染提供参考。
1 材料与方法
1.1 实验仪器
Multigene Thermal Cycler PCR 仪: 美国Labnet公司产品;FE28 pH 计:上海梅特勒-托利多仪器有限公司产品;QHZ-12A 型恒温振荡培养箱: 江苏盛蓝仪器制造有限公司产品;LDZX-50KBS 型高压灭菌锅: 上海申安医疗器械厂产品;TH-YJ-1450A/B型净化工作台: 苏州华科净化设备有限公司产品;Agilent1260 型高效液相色谱仪: 美国Agilent 公司产品;M200 Reader 酶标仪: 美国Tecan 公司产品;WH966 漩涡搅拌器:上海康华生化仪器制造有限公司产品;CX21FS1 生物显微镜: 日本Olympus 公司产品;E0303 电泳仪: 宁波欧普仪器有限公司产品;GT16-3M 型迷你离心机:杭州米欧仪器有限公司产品。
1.2 主要试剂和培养基
色谱级乙腈、三乙胺、磷酸、环丙沙星(纯度≥90%)、MRS 培养基: 上海生物工程有限公司产品;细菌DNA 提取试剂盒:北京全氏金有限公司产品。
环丙沙星标准储备液(1 mg/mL):色谱级环丙沙星标准品溶解在0.03 mol/L NaOH 溶液中以获得1 mg/mL 环丙沙星的储备溶液, 并在-20 ℃下保存在棕色瓶中。
BSM 培养基[19-20]:4 mg/L MgSO4·7H2O、0.1 mg/L CaCl2、4 mg/L KCl、0.01 mg/L FeSO4、0.2 mg/L NaCl、0.5 mg/L KH2PO4、0.5 mg/L K2HPO4;pH 7.0。
CaCO3-MRS 琼脂培养基: 在MRS 固体培养基基础上加质量分数1%的碳酸钙。 培养基均在121 ℃下灭菌15 min。
1.3 方法
1.3.1 环丙沙星降解菌的筛选将纯化过的乳酸菌接种至MRS 培养基中,在37 ℃活化菌株6 h,并按体积分数2%接种到BSM 培养基中,添加环丙沙星至质量浓度为4 μg/mL。 将培养基置于转速为150 r/min 的摇床中37 ℃培养48 h,取上清液,用高效液相色谱测定剩余环丙沙星质量浓度,筛选对环丙沙星具有较强降解作用的菌株。 同时设未加入菌体的同质量浓度环丙沙星溶液作为阴性对照。 其中高效液相色谱条件: 采用ZORBAX XDB-C18 色谱柱(250 mm×4.6 mm,5 μm),检测波长为278 nm,柱温为30 ℃,流动相A 为0.05 mol/L 磷酸溶液(三乙胺调pH 至2.4),B 为色谱级乙腈,V(乙腈)∶V(0.05 mol/L 磷酸溶液)=87∶13,流量为1.0 mL/min,进样量为20 μL。
分别配制质量浓度为1、2、5、10、20、100 μg/mL的环丙沙星溶液。 进样前将色谱柱平衡10~20 min,取1 mL 工作液按上述方法进行实验,空白为1 mL超纯水,取3 次平行实验结果。 以环丙沙星的相对峰面积表示纵坐标,相对应的环丙沙星质量浓度表示横坐标,将得到的数据绘制成标准曲线。
1.3.2 环丙沙星降解菌的鉴定对环丙沙星降解菌进行初步鉴定。 菌株活化培养后,用无菌生理盐水对菌株活化液进行梯度稀释,分别取0.1 mL 稀释度为10-4、10-5、10-6的培养液, 涂布在CaCO3-MRS琼脂培养基上,于37 ℃培养24 h。 随后进行革兰氏染色镜检和过氧化氢酶实验[21-23]。
另外, 挑取处于对数生长期的菌株进行16S rDNA 基因序列分析,用细菌DNA 提取试剂盒提取菌株的基因组DNA。 以下引物用于PCR 扩增编码16S rRNA 的基因:正向引物27F(5′-AGA GTT TGA TTC TGG CTC AG-3′), 反向引物1492R (5′-GGT TAC CTT GTT ACG ACT T -3′)[24]。PCR 反应体系如下:50 μL 反应体系,其中模板2 μL、上游引物1 μL、下游引物1 μL、2×TaqDNA 聚合酶25 μL、ddH2O 1 μL,其中空白对照组用ddH2O 补足。PCR 扩增条件:94 ℃预变性5 min;之后按94 ℃下30 s,55 ℃下30 s,72 ℃下30 s 的条件变性, 共33 个循环,72 ℃延伸10 min,4 ℃保温。 然后进行质量分数为1%的琼脂糖凝胶电泳验证所得PCR 产物, 将1 500 bp 左右的PCR 扩增产物送至上海生工有限公司测序,并登陆NCBI 网站对测序结果进行BLAST 比对,采用邻接法(neighborhood-joining)进行同源性分析,通过MEGA 7.0 软件用邻近法构建系统发育树。
1.3.3 菌体最适生长温度和pH 的确定菌株活化后, 按体积分数2%接种到6 份MRS 液体培养基中, 分别放置在培养温度为20、25、30、35、40 ℃和45 ℃的培养箱中培养24 h 后取样,每组3 次平行,酶标仪测定OD600。 加入无菌水作为对照实验。菌株活化后, 按体积分数2%接种到7 份无菌MRS 液体培养基中,调pH 至5、6、6.5、7、7.5、8 和9培养24 h 后取样, 每组3 次平行, 酶标仪测定OD600。 加入无菌水作为对照实验。
1.3.4 菌体活性对实验菌株降解环丙沙星的影响分别活化两份实验菌,其中一份经高温(121 ℃、20 min)致死。 收集两份菌体重悬于无菌BSM 培养基中, 调整菌体浓度和环丙沙星质量浓度为1×108CFU/mL 和4 μg/mL, 置于转速为150 r/min 的摇床中35 ℃培养48 h,每隔6 h 离心取上清液,用高效液相色谱测定环丙沙星质量浓度,同时设未加入菌体的同质量浓度环丙沙星溶液作为阴性对照。
1.3.5 胞内外物质以及细胞壁对降解环丙沙星的影响参考文献[25]的方法并修改,在100 mL MRS肉汤中活化实验菌, 收集菌体悬浮于0.01 mol/L 的磷酸盐缓冲液中,调整其菌体浓度为1×108CFU/mL,超声波破碎(350 W,工作8 s 间隔3 s)30 min,并在4 ℃条件下以转速14 000 r/min 离心30 min, 菌株胞内物质即为离心后的上清液,细胞壁成分为离心后的沉淀物,另外收集菌活化时的培养液为胞外物质,分别将胞内外物质和细胞壁与环丙沙星溶液共培养使其质量浓度达到4 μg/mL,并于35 ℃且转速为150 r/min 的摇床中培养24 h,分别在12、18、24 h离心取上清液,高效液相色谱法测定环丙沙星质量浓度,同时设未加入菌体的同质量浓度环丙沙星溶液作为空白对照。
1.3.6 数据处理和统计分析所有实验重复3 次,采用SAS 8.0 软件中单因素方差(One-way ANOVA)中的邓肯多重比较(Duncan’s Multiple Range Test)模型进行统计分析,P<0.05 表示差异显著。 采用Origin 9.0 软件进行绘图。 实验数据以平均值±标准差表示。
2 结果与讨论
2.1 环丙沙星降解菌的筛选
由图1(a)和图1(b)可知,环丙沙星标准品在13.059 min 有峰值, 且相对峰面积与环丙沙星质量浓度具有良好的线性关系。 在前期确定的最优色谱条件下,采用高效液相色谱法对环丙沙星质量浓度进行测定。 在18 h 时,WQ-Y1 降解率最高可达70.2%,见图1(c)。

图1 环丙沙星的测定及被菌株WQ-Y1 降解的情况Fig. 1 Determination of ciprofloxacin and its degradation by WQ-Y1
2.2 降解菌的鉴定
菌落外表直径为1~3 mm, 圆形隆起, 表面光滑,乳白色,符合乳酸菌菌落特征,由革兰氏染色和过氧化氢酶实验确定菌株WQ-Y1 镜检形态为革兰氏阳性,过氧化氢阴性杆菌。 16S rDNA 测序同源性分析见图2, 菌株WQ-Y1 与罗伊氏乳杆菌(Lactobacillus reuteri)处于同一进化分支上,两者核苷酸序列具有99%以上的同源性, 所以菌株WQY1 被鉴定为罗伊氏乳杆菌。保藏于中国微生物菌种保藏中心,其保藏编号为:CGMCC No.17078。

图2 菌株WQ-Y1 的形态特征和系统发育树Fig. 2 Morphological characteristics and phylogenetic tree of WQ-Y1
2.3 罗伊氏乳杆菌WQ-Y1 基本生长特性分析
由图3(a)可知,培养温度从20 ℃上升到35 ℃过程中,WQ-Y1 的菌密度呈递增趋势,35 ℃以后菌密度呈下降趋势, 说明当培养温度在35 ℃附近时菌体的生长状况较好。故实验温度选择35 ℃。由图3(b)可知,培养液最初pH 从5.0 上升到7.0 过程中,WQ-Y1 的菌密度呈递增趋势, 在pH 为7.0 以后菌密度呈下降趋势, 说明培养液pH 在约为7.0时菌体的生长情况是最好的, 故实验初始pH 选择7.0。

图3 不同温度和pH 下罗伊氏乳杆菌WQ-Y1 的生长情况Fig. 3 Growth of L. reuteri WQ-Y1 under different temperatures and pH
2.4 菌体活性对罗伊氏乳杆菌WQ-Y1 降解环丙沙星的影响
由图4 可知,相比于致死菌对环丙沙星的降解作用,活菌对环丙沙星的降解率明显较高。 这表明菌株的代谢活性是影响环丙沙星降解的一个重要因素,而致死菌株对环丙沙星的去除作用可能是由于菌株细胞表面具有吸附作用。 初步推断罗伊氏乳杆菌WQ-Y1 降解环丙沙星除了依靠菌体的代谢活性以外,还伴随着细胞壁的吸附作用。 前人研究发现,失活的乳酸菌能够有效去除黄曲霉毒素,原因是菌株细胞壁对黄曲霉毒素具有物理吸附作用[26]。由此得出结论: 罗伊氏乳杆菌WQ-Y1 依靠物理吸附和生物降解作用共同降解环丙沙星。
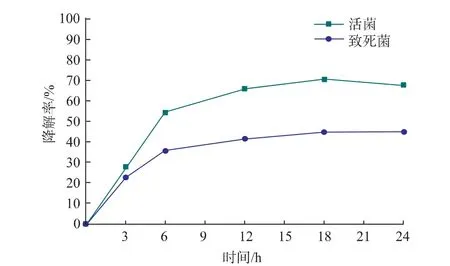
图4 菌体活性对罗伊氏乳杆菌WQ-Y1 降解环丙沙星的影响Fig. 4 Effect of bacterial activity on degradation of ciprofloxacin by L. Reuteri WQ-Y1
2.5 胞内外物质及细胞壁对罗伊氏乳杆菌WQY1 降解环丙沙星的影响
由图5 可知, 在18 h 时罗伊氏乳杆菌WQ-Y1的胞内外物质对环丙沙星的降解率均达到最高,其中胞外物质对环丙沙星降解率为17.7%, 胞内物质对环丙沙星的降解率达到23.4%, 但随着时间的增加,降解速率略有下降,并最终趋于稳定。 这可能是因为菌株达到对数期后继续培养, 菌株活性降低,降解环丙沙星的能力减弱。 而细胞壁对环丙沙星的降解率在3 个时间段稳定保持在37.0%左右。Jia 等研究发现细胞内的乙酰化酶和细胞色素P450 酶对降解硫酸盐还原菌污泥系统中的环丙沙星有促进作用[27]。 所以推测WQ-Y1 在降解环丙沙星时可能伴随生物酶的促进作用。 探究胞外物质对环丙沙星的降解,推测可能存在2 个方面:一方面是由于胞外代谢物存在某些成分能够与环丙沙星发生相互作用,导致环丙沙星含量下降,另一方面是由于胞外聚合物(EPS)形成过程中聚集了不同的带电基团和非极性基团[28],其中,EPS 中疏水区域有利于有机物的吸附[29]。在该研究中,无论是细胞壁还是胞内外物质对环丙沙星的降解率都远低于完整罗伊氏乳杆菌的降解率,这进一步表明菌株对环丙沙星的物理吸附作用和菌株体内的酶都并非是罗伊氏乳杆菌WQ-Y1 降解环丙沙星的单一途径, 而是依赖于具有活性的完整菌株。

图5 胞内外物质及细胞壁对降解环丙沙星的影响Fig. 5 Effects of intracellular and extracellular substances and cell walls on the degradation of ciprofloxacin
3 结 语
利用高效液相色谱法分析菌株降解环丙沙星的能力,筛选得到一株对环丙沙星具有高效降解作用的乳酸菌WQ-Y1,降解率达到70.2%。 通过16S rDNA 基因组分析鉴定WQ-Y1 为罗伊氏乳杆菌。此外, 罗伊氏乳杆菌WQ-Y1 降解环丙沙星是依靠物理吸附和生物降解的共同作用,而且胞内外物质和细胞壁对环丙沙星的降解率远低于完整罗伊氏乳杆菌的降解率,也说明了环丙沙星降解伴随着活菌代谢的作用。 为乳酸菌降解抗生素研究提供参考,也为微生物治理复杂环境的抗生素污染提供更多选择。
