黑曲霉β-葡聚糖酶基因eglA6 在乳酸克鲁维酵母中的表达及重组酶性质
2022-01-07王施岚徐楚涵杨梦莲德青美朵杨海泉夏媛媛陈献忠
王施岚, 徐楚涵, 姚 雁, 杨梦莲, 德青美朵,沈 微*,3, 杨海泉, 夏媛媛, 陈献忠,3
(1. 江南大学工业生物技术教育部重点实验室, 江苏无锡 214122;2. 无锡先秦生物科技有限公司, 江苏无锡 214073;3. 江南大学中国高校工业微生物资源数据平台,江苏无锡 214122)
内切型β-葡聚糖酶是纤维素酶类的重要成分之一, 主要降解纤维素长链分子中的β-1,4-糖苷键[1-2]。 除了降解纤维素,目前内切β-葡聚糖酶最重要的商业化用途是在啤酒生产和饲料工业中降解β-1,3-1,4-葡聚糖,以达到降低底物黏度并最终实现改善工艺条件、防止啤酒低温浑浊以及提高动物对饲料吸收率的目标[1-2]。 在啤酒和饲料工业中使用的葡聚糖酶都需要经受高温、酸性条件,因此在上述条件下保持稳定性和高活性的β-葡聚糖酶受到研究者的重视。 黑曲霉是工业应用最广泛的丝状真菌之一,也是工业用葡聚糖酶的生产菌种之一。 人们从黑曲霉中克隆了多条葡聚糖酶编码基因并实现了异源表达,这些基因的表达产物大多具有较高的耐酸性和一定的耐热性[2-7]。 作者所在课题组在前期工作中,以黑曲霉全基因组序列信息[8]为依据,从黑曲霉中筛选到一条cDNA 基因eglA6, 这条基因在巴斯德毕赤酵母中的表达产物AnEglA6 反应最适温度可达75 ℃,在75 ℃下酶活半衰期达到1.9 h,能短时耐受80 ℃高温[9]。 AnEglA6 的耐热性明显高于已见报道的黑曲霉来源的其他葡聚糖酶或其异源表达产物,在饲料加工中具有较好应用潜力[9]。 而现代饲料生产一般都有一个高温制粒过程,这个过程中高温有利于饲料中淀粉的糊化,提高颗粒饲料稳定度(PDI)[10]。 因此,高温条件下的稳定性是影响饲料用酶应用前景的关键指标之一。
乳酸克鲁维酵母具有较强的蛋白质分泌能力,是除巴斯德毕赤酵母外应用最广泛的外源蛋白质分泌型表达宿主之一,已实现了多种外源蛋白质的高效表达[11-13]。 可能由于翻译后修饰过程的差异,乳酸克鲁维酵母表达的外源蛋白质与同一基因在巴斯德毕赤酵母中的表达产物常常表现出一定的差异[12-15],因此有可能提供具有不同性质的重组酶。 作者所在课题组尝试以乳酸克鲁维酵母为宿主表达eglA6 基因,结果显示重组酶在相对分子质量、耐热性等方面与该基因在巴斯德毕赤酵母中的表达产物均有明显不同。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒大肠杆菌JM109/pPIC9KeglA6(基因克隆的出发菌)为作者所在课题组前期构建[9];表达载体pKLAC1 和宿主菌乳酸克鲁维酵母GG799:纽英伦生物技术(北京)有限公司产品;大肠杆菌JM109 为作者所在实验室保藏;表达重组酶AnEglA6 的菌株Pichiapastoris GS115/pPIC9KeglA6 XQ12 为课题组前期构建[9];AnEglA6 按照文献[9]中方法制备。
1.1.2 工具酶及主要试剂质粒提取、PCR 产物纯化以及胶回收试剂盒:康宁生物(吴江)有限公司产品; 限制性核酸内切酶、T4 连接酶、DL15000 DNA marker 等:大连宝生物工程公司产品;羧甲基纤维素钠(CMC-Na)、大麦葡聚糖、凝结多糖、昆布多糖等:Megazyme 公司产品; 引物合成、DNA 序列分析以及蛋白质羧基端测序均由上海生工生物工程技术服务有限公司完成;YNB 培养基:BD Difco 公司产品,产品货号BD Difco 291920,该产品由维生素和无机盐组成, 不含碳源及氮源;SDS-PAGE 电泳预制胶:上海生工生物工程有限公司产品;微晶纤维素:国药集团(上海)化学试剂有限公司产品;其他试剂均为国产分析纯试剂。
1.1.3 引物合成及测序根据eglA6 的核苷酸序列(NCBI 登录号:MG913988)设计PCR 扩增的引物:Psl01:5′-AATCAGATCTAGTCCGAGGGCTAAGC-3′Psl02:5′-AATAGTCGACCTACAAACACTGCGAATAC-3′
引物中带下划线部分分别为核酸内切酶Bgl II和Sal I 的识别位点。引物由上海生工生物技术服务有限公司合成。1.1.4 培养基大肠杆菌培养采用LB 培养基,酵母培养一般采用YPD 培养基, 均按常规方法配制[12]。 YCB 培养基(g/L):YNB 2.0、葡萄糖3.0、乙酰胺0.6, 用于重组乳酸克鲁维酵母转化子的筛选。YPG 培养基(g/L):乳糖20.0、酵母提取物10.0、蛋白胨20.0,用于乳酸克鲁维酵母摇瓶发酵。
1.2 实验方法
1.2.1 重组质粒pKLAC1-eglA6的构建以重组质粒pPIC9K-eglA6 为模板,以Psl01、Psl02 为引物进行PCR 扩增。 PCR 产物经电泳分离并回收1.2 kb的目标片段,用Bgl II 和Sal I 酶切并与经同样酶切的表达载体pKLAC1 连接, 连接后转化大肠杆菌JM109 感受态细胞, 在含100 μg/mL 氨苄青霉素的LB 平板上筛选转化子,任取4 个转化子提取质粒后酶切验证并进一步测序鉴定。 验证正确的转化子命名为JM109/pKLAC1-eglA6。
1.2.2 乳酸克鲁维酵母感受态细胞的制备接种宿主菌乳酸克鲁维酵母GG799 单菌落于10 mL 液体YPD 培养基中,200 r/min 条件下32 ℃培养24 h。 按2%的体积分数转接到新的装有50 mL YPD 培养基的500 mL 三角瓶中,32 ℃条件下250 r/min 剧烈振荡培养6 h,菌液在冰水浴中迅速降温并维持30 min。 菌液转入预冷的50 mL 离心管,4 ℃下4 000 r/min 离心3 min 收集菌体,用预冷的无菌水悬浮菌体,离心收集菌体后用预冷的1 mol/L 山梨醇溶液悬浮菌体,离心后再次用山梨醇溶液悬浮菌体, 再次离心后弃尽上清液, 用大约0.5~1.0 mL 山梨醇溶液悬浮菌体, 尽量缩小体积保持较高的细胞浓度。 以上操作均要保持菌体处于低温状态。
1.2.3 重组乳酸克鲁维酵母的转化含重组质粒的大肠杆菌JM109/pKLAC1-eglA6 经液体培养基培养后,大量提取质粒。 重组质粒用内切酶BstX I 酶切,进一步用DNA 片段纯化试剂盒纯化,操作步骤与试剂盒说明书一致,唯一的改变是最后一步从硅胶柱将DNA 片段洗脱时用纯水替代试剂盒提供的专用洗脱液。由此获得线性化的重组质粒。取90 μL乳酸克鲁维酵母感受态细胞菌,加入10 μL 线性化后的重组质粒,混匀后转入预冷的电转杯中,在碎冰中冷却10 min。 1 500 V 条件下5 ms 电击两次,迅速加入900 μL 预冷的山梨醇溶液悬浮菌体,将经山梨醇溶液重悬后的菌体涂布到以乙酰胺为唯一氮源的YCB 固体培养基,30 ℃继续培养2~3 d获得转化子。
1.2.4 重组葡聚糖酶的诱导表达与重组菌筛选取乳酸克鲁维酵母转化子单菌落,在新的YCB 平板上划线分离, 再取单菌落接种到装有5 mL YPD 液体培养基的25 mL 三角瓶中振荡培养过夜。 取500 μL 菌液接种于装有80 mL YPG 发酵培养基的500 mL 三角瓶,220 r/min 振荡培养,间隔12 h 取样检测上清液葡聚糖酶酶活,最高酶活一般在诱导培养48 h 时出现。 筛选酶活较高的转化子用于后续工作。
1.2.5 重组葡聚糖酶的纯化及酶活测定葡聚糖酶发酵液用0.22 μm 微孔滤膜过滤除去杂质。 用超滤离心柱浓缩至酶活200.0 U/mL 左右。 再用5 mmol/L Tris-HCl 缓冲液(pH 5.5)平衡后上样于1 mL QHP 阴离子交换柱,用含1 mol/L NaCl 的5 mmol/L Tris-HCl 缓冲液(pH 5.5)线性洗脱,进行离子交换层析, 收集活性峰,SDS-PAGE 电泳验证纯化效果,Bradfoard 法测定蛋白质含量。
采用DNS 法测定葡聚糖酶的活力。取50 μL 适当稀释的酶液, 加入450 μL 质量浓度为10 g/L 的大麦葡聚糖 (由0.05 mol/L 柠檬酸与0.1 mol/L Na2HPO4构成的缓冲液配置,pH 5.0),70 ℃下反应20 min,加入750 μL DNS 试剂,沸水浴煮15 min,在540 nm 波长下测定吸光度。
酶活单位定义:在相应条件下,每分钟分解底物产生的还原糖, 其还原力相当于1 μmol 葡萄糖所需的酶量,用1 U 表示。 如无特别说明,酶活检测一般是在最适条件下进行, 反应液不添加金属离子,底物为大麦葡聚糖。 底物特异性检测时,将底物改为同质量的相应底物,其他步骤不变。
考马斯亮蓝法测定纯酶的蛋白质含量,用于计算酶的比活力。
1.2.6 重组葡聚糖酶酶学性质的分析
1) 重组酶在不同条件下的酶活测定 在60~80 ℃内,温度梯度间隔为5 ℃。 对于pH 3.0~7.0 的缓冲液(由0.05 mol/L 柠檬酸与0.1 mol/L Na2HPO4构成),pH 梯度间隔为0.5, 测定不同温度和pH 下重组酶活力,以最高酶活为100%,计算各不同温度及pH 条件下的相对酶活, 初步确定重组酶最适反应条件。
2) 最适pH 的测定 分别配置pH 3.0~7.0 的缓冲液(由0.05 mol/L 柠檬酸与0.1 mol/L NaH2PO4构成),测定酶在不同pH 缓冲液中酶活力,以最高酶活性为100%,计算不同pH 条件下酶相对活性。
3) 金属离子对酶活的影响 在pH 5.0 的柠檬酸-柠檬酸钠缓冲液中分别添加金属离子 (均为氯化物), 使金属离子的最终浓度为1 mmol/L 和5 mmol/L,检测酶活。 以原酶液活力为100%,分析不同金属离子对酶活力的影响。
4) 重组酶对不同底物特异性研究 分别以大麦葡聚糖、凝结多糖、CMC-Na、微晶纤维素等为底物,在最适条件下测定重组酶的活力,分析重组酶对不同底物的水解能力。
酶学性质分析均做3 个平行样。
1.2.7 重组葡聚糖酶对底物的降解配制葡萄糖、麦芽糖、麦芽三糖、麦芽五糖、麦芽六糖和麦芽七糖混合标准样,每种糖为5 g/L。 为更清晰地显示麦芽三糖和五糖的位置,配制混合标样时没有加入麦芽四糖。 取5 g/L 的大麦葡聚糖溶液与过量葡聚糖酶反应。 用“海洋”牌硅胶板,体积比7∶11∶2 的乙酸乙酯、冰乙酸和水的混合液作展开剂,2 g 二苯胺、2 mL苯胺、10 mL 体积分数85%的磷酸和100 mL 丙酮溶解后混匀作为显色剂,对大麦葡聚糖水解产物进行薄层层析定性分析。
2 结果与分析
2.1 黑曲霉葡聚糖酶基因eglA6 的克隆与表达载体的构建
以重组质粒pPIC9K-eglA6 为模板, 经PCR 扩增获得一个1.2 kb 的目标片段,从电泳凝胶中分离该片段,与表达载体pKLAC1 连接后转化大肠杆菌JM109 感受态细胞, 任取4 个转化子提取质粒后酶切鉴定,图1 为其中1 号转化子的酶切图谱。 该转化子质粒用Bgl II 和Sal I 酶切后获得约9.0 kb 和1.2 kb 的两个条带, 分别与pKLAC1 空载体和基因eglA6 大小一致,符合重组质粒应有特征。 进一步将该质粒送至上海生工生物技术服务公司测序,结果显示,质粒中插入片段序列与MG913988 序列中成熟肽编码区序列完全一致。 为便于叙述,将上述重组质粒命名为pKLAC1-eglA6,用于后续实验。
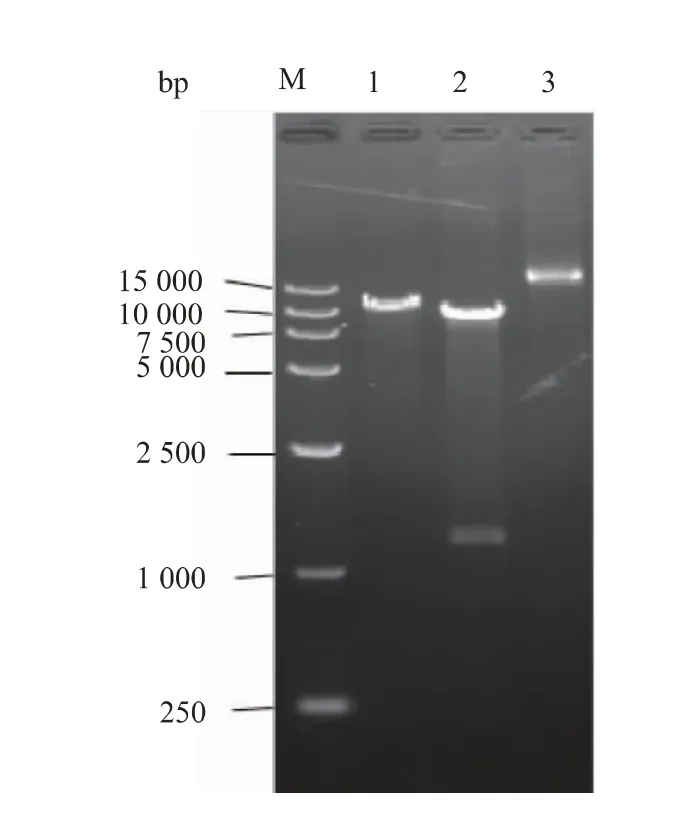
图1 重组载体pKLAC1-eglA6 的酶切鉴定Fig. 1 Indentification of pKLAC1-eglA6 by restriction analysis
2.2 eglA6 基因的表达与高产菌的筛选
将质粒PKLAC1-eglA6 线性化后, 电转化进乳酸克鲁维酵母G799 感受态细胞, 转化后涂布到以乙酰胺为唯一氮源的YCB 平板。由于pKLAC1 质粒上带有乙酰胺酶基因,因此只有转入了重组质粒的转化子才能分解乙酰胺获得氮源并长成菌落,但实际操作上在YCB 平板上一般会有大量假阳性转化子,GG799 转化后需要进行大量筛选才能获得真正表达目标产物的转化子。 因此一次任选50 个转化子,划线分离后进行摇瓶发酵。 结果显示,其中仅2个转化子发酵后表现出明显降解大麦葡聚糖的活性。 为了筛选相对酶活较高的转化子,经多次转化后共计筛选了800 个转化子进行摇瓶发酵,筛选到有明显酶活的转化子31 个,发酵酶活大约在10.0~25.0 U/mL,其余转化子与空质粒pKLAC1 转化乳酸克鲁维酵母获得的转化子一样,未检测出葡聚糖酶酶活, 有可能是假阳性。 由以上分析可知, 基因eglA6 编码的是一种葡聚糖酶。 在上述转化子中,一株编号为SL105 的菌株发酵酶活相对较高,该重组菌命名为Kluyveromyces lacis GG799/pKLAC1-eglA6 SL105,简称为SL105,用于后续工作。 为便于叙述, 将eglA6 基因在乳酸克鲁维酵母中的表达产物命名为AnEglA6K, 而前期工作中由巴斯德毕赤酵母表达的产物与文献[9]一致,命名为AnEglA6。
2.3 重组酶AnEglA6K 的纯化
将重组菌SL105 的发酵液先后用离子交换和分子筛的方法进行纯化。 SDS-PAGE 电泳显示了纯化结果(见图2)。 SL105 发酵液在5.5×104附近显示出一条明显的高表达条带。 经过纯化后,纯化液中的单一电泳条带与这一高表达条带相对分子质量一致。 用图像分析软件Image lab 4.0 推算重组蛋白质相对分子质量,结果显示,重组AnEglA6K 的表观相对分子质量为5.63×104。 根据基因eglA6 推测的翻译产物的理论相对分子质量为4.13×104, 表观相对分子质量比理论相对分子质量高出约36%,这是用酵母表达系统表达外源蛋白质时的常见现象,一般是重组蛋白在分泌过程中被糖基化所致。
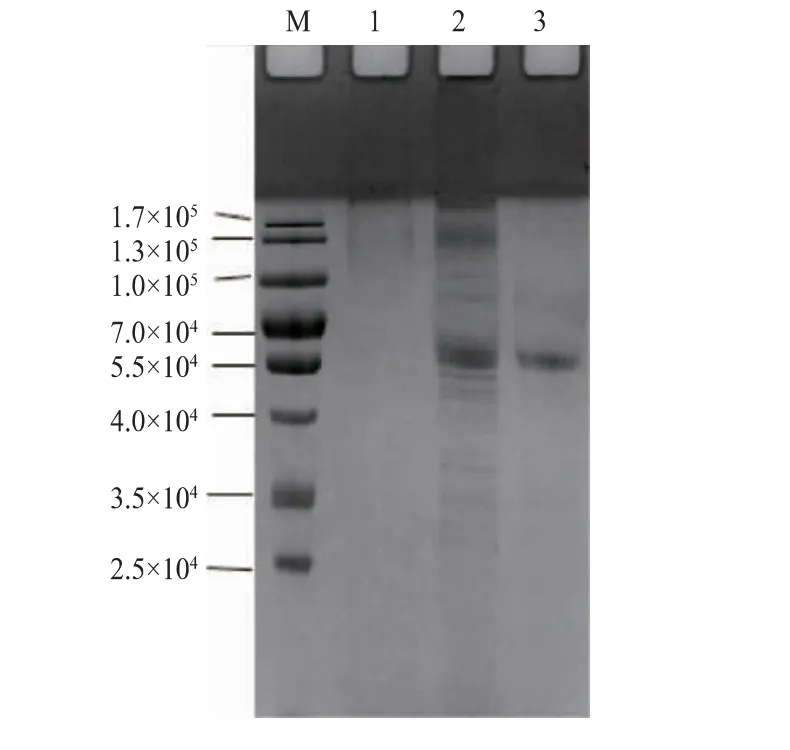
图2 AnEglA6K SDS-PAGE 电泳分析Fig. 2 SDS-PAGE analysis of AnEglA6K
作者所在课题组在前期研究中用巴斯德毕赤酵母实现了eglA6 基因的表达, 毕赤酵母表达的重组酶相对分子质量为5.2×104。从相对分子质量推算结果看,用乳酸克鲁维酵母表达的重组酶相对分子质量明显大于前者[9]。 为进一步验证两者的差异,将两种纯酶一起电泳,结果见图3。乳酸克鲁维酵母的表达产物AnEglA6K 的表观相对分子质量明显大于毕赤酵母的表达产物AnEglA6。 由于这两条肽链的氨基酸序列几乎完全一样,相对分子质量差异很可能源于糖基化的差异, 还有一种可能是源于AnEglA6 翻译时出现提前终止的情况。为此,将纯化后的AnEglA6 和AnEglA6K 送上海生工生物技术服务有限公司进行C-端测序,结果显示,两种蛋白质的最后4 个氨基酸均为Ser-Glu-Cys-Leu, 与根据eglA6 基因序列推测的氨基酸序列一致。 由此可见,AnEglA6 和AnEglA6K 的氨基酸序列是一致的,相对分子质量差异应该是源于糖基化程度的差异。
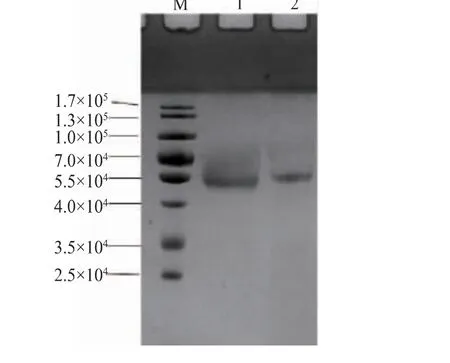
图3 两种蛋白质的相对分子质量比较Fig. 3 Molecular weight comparison of two proteins
2.4 重组酶AnEglA6K 的酶学性质分析
2.4.1 重组酶在不同条件下的酶活在pH 3.0~7.0和60~80 ℃内,对AnEglA6K 的酶活进行检测,结果见图4。 AnEglA6K 的最适温度为75 ℃,最适pH 为5.0。 偏离最适条件时酶活逐步下降。
图4 AnEglA6K 在不同pH 和温度条件下的相对酶活Fig. 4 Relative activity of AnEglA6 in different pH and temperature
2.4.2 重组酶温度稳定性AnEglA6K 在低于65℃的条件下活性稳定, 保温6 h 酶活损失不超过20%。在70 ℃及以上保温一定时间后,AnEglA6K 剩余酶活力变化情况见图5。 在70 ℃和75 ℃下保温,AnEglA6K 有比较明显的失活, 但在相当长的时间内仍能保持较高酶活。 进一步检测显示,AnEglA6K在70 ℃和75 ℃下的酶活半衰期分别为5.4 h 和2.3 h。 在80 ℃下失活较快,保温1 h 后相对残余酶活54%, 实际测定其酶活半衰期为65.0 min, 可见AnEglA6K 能在一段时间内耐受80 ℃高温。AnEglA6K 在85 ℃下极易失活, 保温1 h 后相对残余酶活约为12%,酶活半衰期大约为15.0 min,可见AnEglA6K 能短时耐受85 ℃高温。 溶液pH 条件对AnEglA6K 影响不明显,在60 ℃及以下条件,pH 在2.0~8.0 时AnEglA6K 保温6 h 酶活损失均在10%以内。

图5 AnEglA6K 的热稳定性Fig. 5 Thermostability of AnEglA6K
2.4.3 基因eglA6在两种酵母中表达产物的性质差异将AnEglA6K 和AnEglA6 的酶学性质进行比较发现, 温度对两种酶酶活的影响基本相同,但pH 对两者的影响以及两者的温度稳定性有明显差异,两种重组酶的性质比较见图6~7。 由图6 可见,基因eglA6 在两种酵母中表达产物的pH 适应性有明显差异,AnEglA6 的最适pH 为4.0 而AnEglA6K的最适pH 为5.0。 比较发现在70 ℃以下温度时,AnEglA6 和AnEglA6K 的热稳定性比较接近, 但在75 ℃下两者的热稳定性表现出一定差异,由图7 可见,AnEglA6K 的热稳定性略高于AnEglA6。 在80℃下,AnEglA6K 的热稳定性显著高于AnEglA6,在保温1 h 后AnEglA6 的相对残余酶活约23%,而经同样处理的AnEglA6K 的相对残余酶活达到54%。进一步检测结果显示, 在80 ℃下,AnEglA6 的酶活半衰期为23.0 min 而AnEglA6K 为65.0 min。 可见AnEglA6K 在80 ℃下的热稳定性显著高于AnEglA6。 AnEglA6K 能短时耐受85 ℃高温,AnEglA6 在85 ℃下迅速失活,保温1 h 后基本检测不到酶活,其酶活半衰期在5 min 内。
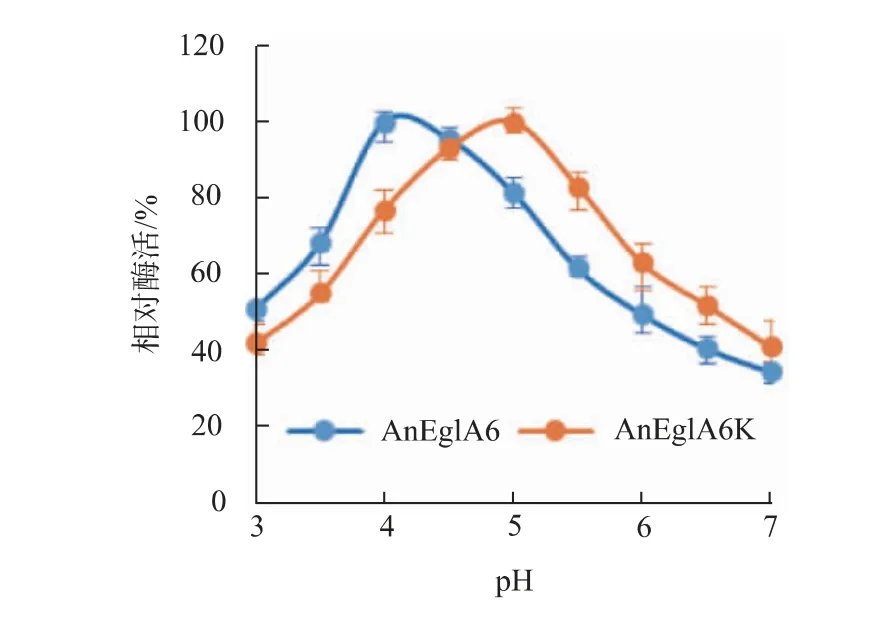
图6 pH 对AnEglA6K 和AnEglA6 酶活的影响Fig. 6 Effects of pH on the activity of AnEglA6K and AnEglA6
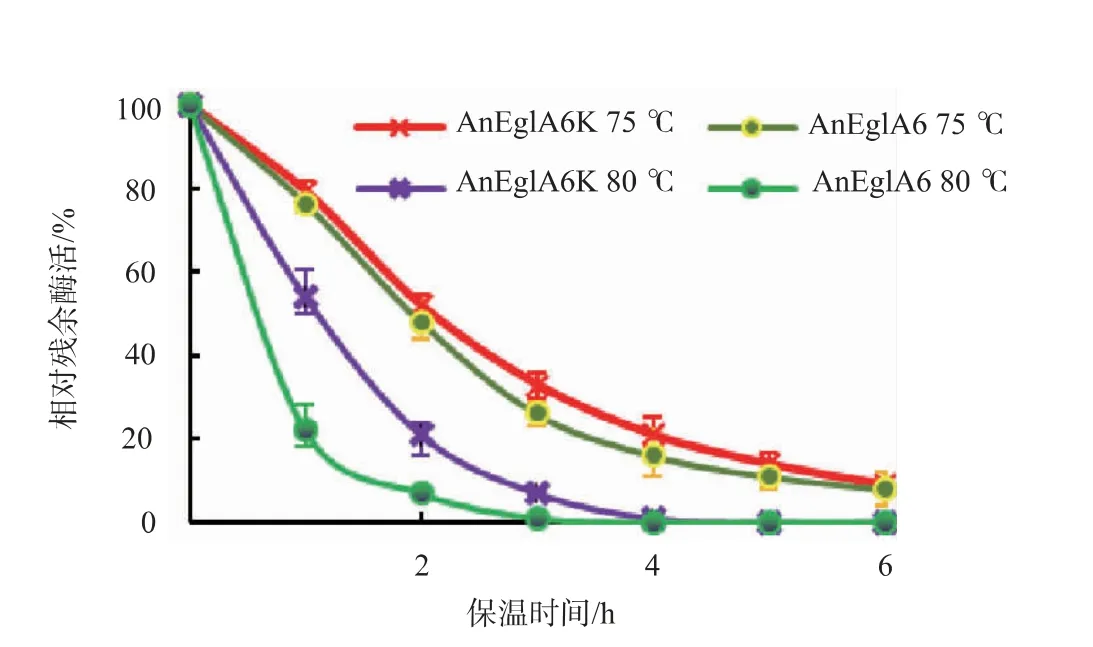
图7 AnEglA6K 和AnEglA6 的热稳定性比较Fig. 7 Comparison of thermostabiligy of AnEglA6K and AnEglA6
2.4.4 金属离子对重组酶活力的影响常见金属离子对AnEglA6K 的影响见表1。 大部分常见金属离子以及EDTA 均对AnEglA6 酶活性影响不大。 在常见金属离子中只有高浓度的Cu2+对酶活性有比较明显的促进作用, 但过量Cu2+对人和动物都有潜在的伤害, 因此在葡聚糖酶的应用环境中很少出现,这个结果对酶的实际应用帮助不大。与AnEglA6 相比,AnEglA6K 对金属离子更加不敏感。 Co2+、Mn2+对AnEglA6 的酶活有明显促进作用, 高浓度的Fe3+则有显著的抑制作用[9]。 而上述几种离子对AnEglA6K的酶活影响都比较小。 高浓度的Cu2+是惟一一种能明显促进AnEglA6K 活性的金属离子, 但这种离子对AnEglA6 却有轻微的抑制作用[9]。
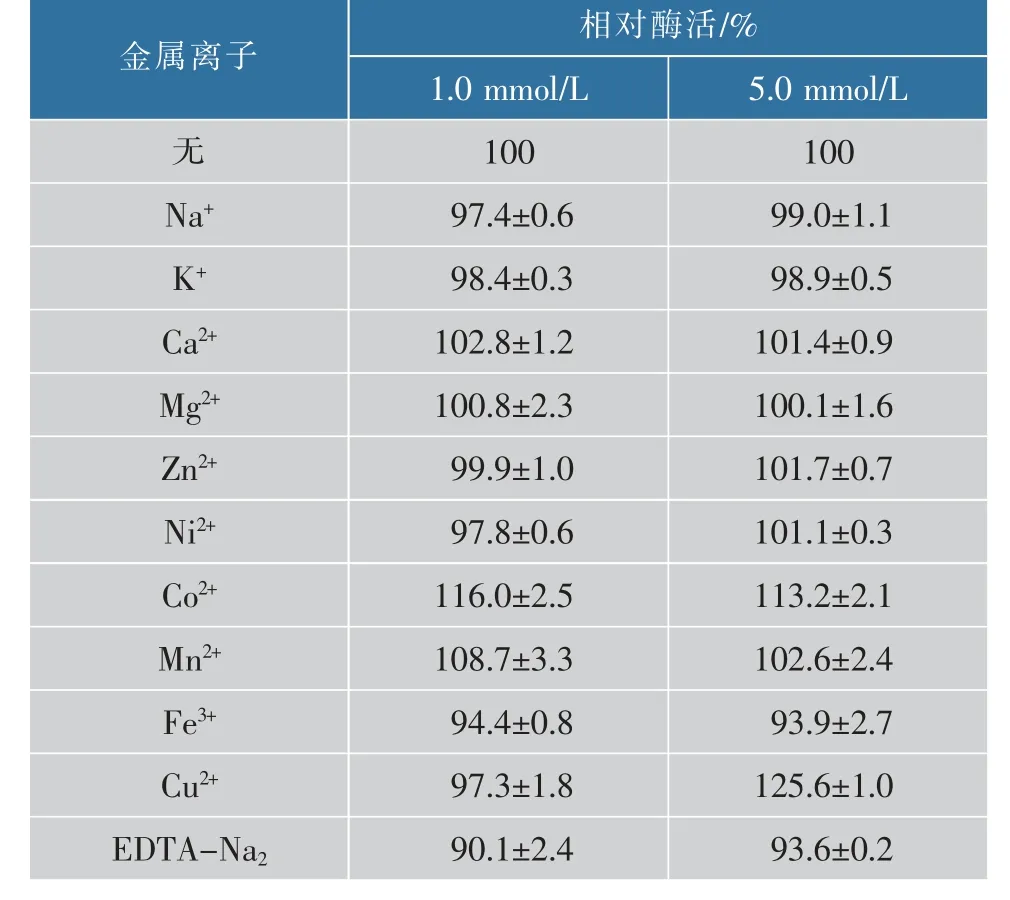
表1 常见金属离子对AnEglA6K 催化活力的影响Table 1 Effects of metal ions on AnEglA6K catalytic activity
2.5 重组酶AnEglA6K 的底物特异性
如表2 所示,以大麦葡聚糖和地衣多糖为底物时,AnEglA6K 酶活最高,比酶活分别为12 221.5 U/mg和17 824.1 U/mg。以CMC-Na 为底物时,AnEglA6K表现出较低的酶活, 为1 255.1 U/mg。 以酵母葡聚糖、凝结多糖等4 种以β-1,3-糖苷键为主的多糖为底物时,AnEglA6K 均未表现出明显的酶活。 可见,AnEglA6K 不能降解β-1,3-糖苷键。 这个特点上AnEglA6K 和AnEglA6 完全一致, 但与黑曲霉来源的其他葡聚糖酶有明显的差异。 根据文献报道,黑曲霉来源的葡聚糖酶EglB[16]和葡聚糖酶En3gA、En3gB 和En3gC[2]都对凝结多糖或昆布多糖有一定的降解能力,只是活性都不高。 AnEglA6K 对表2 中前6 种底物降解活性的特点与AnEglA6 基本一致,可以推断两种酶均为内切型β-1,4-葡聚糖酶[9]。

表2 AnEglA6K 与AnEglA6 的底物特异性Table 2 Substrate specificity of AnEglA6K and AnEglA6
AnEglA6K 纯酶与微晶纤维素在经过20 min 的反应后,在反应液中能检测到明显的还原糖,这说明AnEglA6K 对结晶型纤维素也有降解能力。AnEglA6K 的这一特点可能与AnEglA6K 分子羧基端的纤维素结合结构域有一定的关系。 用Blast 软件将eglA6 基因表达产物(为便于与两种酵母表达的经糖基化修饰的产物相区别,图中标注为AnEglA的氨基酸序列) 与美国国家生物技术信息中心(NCBI)储存的黑曲霉CBS513.88 基因组序列[8]中其他蛋白质分子进行氨基酸序列比对, 结果见图8。AnEglA 与葡聚糖酶EglB 显示出最高同源性, 同源性为50.63%。
在黑曲霉来源的葡聚糖酶基因中,Eng1 是最早被克隆的基因,其表达产物具有很高的耐热性[17]。不同的文献对黑曲霉葡聚糖酶的命名不完全一致,但对文献所提供的基因序列以及引物序列等进行分析可以发现,一些文献[1,4,5,17-19]报道的黑曲霉葡聚糖酶的基因序列与Eng1 一致或基本一致。 在黑曲霉基因组中一段cDNA 基因 (GenBanK 登录号:XM_001391932.2) 表达的内切-β-葡萄糖酶B(EgIB) 的氨基酸序列与Eng1 的表达产物几乎完全一致, 为便于叙述将这些基因的表达产物统称为EglB。研究者对EglB 的结构功能已经进行了深入研究[16,18]。 根据前人[16]报道,图8 中星号标注的两个Glu 残基(E142 和E248)很可能是EglB 的催化活性基团。在催化活性基团附近,AnEglA 和EglB 的氨基酸序列高度保守,由此可以推断两种酶可能有相似的催化机理。 另外一个值得注意的现象是,与EglB相比,AnEglA 在C-端多出一段81 个氨基酸残基的区域。将这81 个氨基酸的序列提交NCBI 网站进行Blast 搜索比对, 结果显示其最后36 个氨基酸残基(图8 方框部分) 的区域与真菌纤维素酶的纤维素结合结构域I 高度同源, 这个结构域与结晶型纤维素的降解有关[20]。 这一结构域的差异可能是AnEglA6K 具有微晶纤维素降解能力而EglB 不具有这一能力的原因[16]。 分析表2 的数据还可以发现,AnEglA6 与AnEglA6K 对结晶纤维素的降解能力有显著差异,前者完全不水解微晶纤维素。 这是一个比较意外的结果,因为AnEglA6 与AnEglA6K 的氨基酸序列完全一致, 前者同样具有上述36 个氨基酸残基组成的纤维素结合结构域。 为了防止纯化不完全对检测结果的影响, 将含空质粒的对照菌K.lactis GG799/pKLAC1 的发酵液以及对照菌发酵液与AnEglA6 的混合液分别同微晶纤维素反应,结果均未检测到明显的还原糖, 可见AnEglA6K 与AnEglA6 对微晶纤维素降解能力的差异只可能源于两者本身,从上述结果看,两者糖基化方式或程度的不同最有可能导致这一差异。 糖基化对真菌纤维素酶的性质有复杂的影响[21],Chen 等发现,里氏木霉(Trichoderma reesei)纤维素酶纤维素结合结构域某些位点的连接糖基化能提高蛋白质分子的纤维素结合活性[22],这与结晶纤维素的降解有着密切的关系。

图8 AnEglA 与EglB 氨基酸序列比对Fig. 8 Sequence alignment of AnEglA and EglB
2.6 重组酶AnEglA6K 的水解产物
AnEglA6K 过度水解大麦葡聚糖(见图9),主要产物是相对分子质量介于麦芽五糖和二糖之间的小分子寡糖,大于五糖的产物几乎未见,没有明显的高相对分子质量葡聚糖,这一特点与前人从黑曲霉中得到的另外3 种内切型β-葡聚糖酶一致[2]。 内切型β-葡聚糖酶的一个重要特点是对葡聚糖分子内部的β-1,4-糖苷键进行随机水解,但优先水解与β-1,3-糖苷键临近的β-1,4-糖苷键[1],产生大量相对分子质量较小的寡糖。外切型β-葡聚糖酶降解大麦葡聚糖一般首先产生大量的二糖,水解过程被β-1,3-糖苷键阻挡而无法继续进行,从而留下大量的高相对分子质量葡聚糖。 从水解产物可见,AnEglA6K 是一种内切型β-葡聚糖酶, 这与根据其底物特异性推测的结果一致, 也与前文报道的AnEglA6 特性一致[9]。
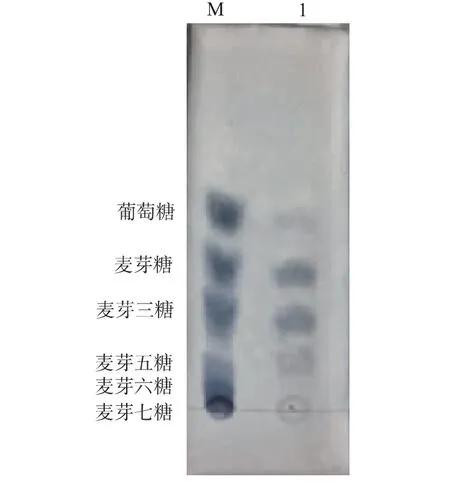
图9 AnEglA6K 降解大麦葡聚糖的产物分析Fig. 9 Products of AnEglA6K decomposition of barley glucan
3 结 语
黑曲霉是工业用葡聚糖酶的生产菌种之一,多年来人们对黑曲霉来源的葡聚糖酶进行了大量的研究并克隆表达了多条β-葡聚糖酶编码基因。研究发现,黑曲霉来源的葡聚糖酶基因的异源表达产物大多具有较好的耐热性和耐酸性[2-7,17-19]。 韩冰等[9]研究者对这些基因的异源表达产物进行了比较,结果显示, 黑曲霉来源的葡聚糖酶中, 以Eng1 基因和eglA6 基因在巴斯德毕赤酵母中的异源表达产物的耐热性最高。 其中Eng1 基因的表达产物最适温度为70 ℃,eglA6 基因的表达产物AnEglA6 最适温度为75 ℃, 后者是黑曲霉来源的葡聚糖酶基因异源表达产物中热稳定性最高的重组酶[9]。 作者以乳酸克鲁维酵母为宿主表达eglA6 基因, 获得了比AnEglA6 耐热性更高的表达产物AnEglA6K。 关于黑曲霉耐热性葡聚糖酶的研究中,有一个有趣的现象是黑曲霉本身并未发现耐热性很高的葡聚糖酶。Li 等研究发现, 黑曲霉本身表达野生型EglB 的最适温度只有60 ℃, 该基因在毕赤酵母中的表达产物最适温度为70 ℃, 而后者的相对分子质量明显高于前者,由此推测,酵母宿主对产物的过度糖基化很可能是其耐热性提高的原因[16]。 作者以乳酸克鲁维酵母表达eglA6 基因, 表达产物AnEglA6K 的相对分子质量为5.6×104,而同一基因在巴斯德毕赤酵母中的表达产物AnEglA6 的相对分子质量为5.2×104,前者比后者高出7.7%。酶学性质分析显示,AnEglA6K 的热稳定性明显高于AnEglA6, 前者在80 ℃下的酶活半衰期为65.0 min 而后者只有23.0 min。 从实验数据看, 糖基化程度的提高与eglA6 基因表达产物耐热性提高存在明显的相关性,这与Li 等的推测一致[16]。 耐热型葡聚糖酶的一个重要应用方向是用作饲料添加剂。 饲料生产的造粒工段的温度一般在75~90 ℃。 AnEglA6K 在80 ℃左右明显比AnEglA6 具有更高的稳定性, 可见eglA6 基因在乳酸克鲁维酵母中的表达产物在应用上有明显的优势。
在项目前期研究中发现,eglA6 基因在巴斯德毕赤酵母中的表达产物AnEglA6 能高效降解葡聚糖及地衣多糖,但不降解结晶型纤维素。 而该研究却发现,eglA6 基因在乳酸克鲁维酵母中的表达产物AnEglA6K 具有明显水解结晶型纤维素的能力。蛋白质序列分析显示,AnEglA6K 的C-端具有明显的纤维素结合区域 (cellulose bingding domain,CBD)。 CBD 有助于纤维素酶分子吸附在结晶型纤维素表面从而有利于底物的降解[23]。 李相前等将海栖热袍菌(Thermotoga maritima)的内切型葡聚糖酶Cel12B 与木聚糖酶的CBD 编码基因进行融合表达获得嵌合体酶,结果显示嵌合体酶对微晶纤维素有明显水解功能而Cel12B 则完全不水解微晶纤维素[20]。 从结果看,eglA6 基因表达产物水解纤维素的功能与其糖基化的情况有着复杂的关系,因此要准确揭示eglA6 在原宿主中的功能, 最可靠的方法是在黑曲霉中高效表达该基因,再分析表达产物的性质。
作者采用乳酸克鲁维酵母表达系统对eglA6 基因进行异源表达,获得的重组酶最适温度75 ℃,最适pH 为5.0,在80 ℃下酶活半衰期为65.0 min,能短时耐受85 ℃高温,是一种高耐热葡聚糖酶,在饲料加工中有较好的应用前景。
