基于Caco-2 细胞模型对DPP-IV抑制肽IPQVS 的活性评价研究
2022-01-07徐斐然徐宝才鞠兴荣
徐斐然, 徐宝才, 鞠兴荣
(1. 合肥工业大学食品与生物工程学院, 安徽合肥 230601;2. 合肥工业大学农产品生物化工教育部工程研究中心,安徽合肥 230601;3. 江南大学食品学院,江苏无锡 214122)
当前,基于反应底物甘氨酰-脯氨酰-对硝基苯(Gly-Pro-p-nitroanilide) 的体外酶促法测定IPQVS的活性存在不足与局限性。 其主要体现在肠道中的若干环境因素可能会限制寡肽对DPP-IV 的抑制活性,例如,小肠消化酶的水解作用会破坏寡肽的一级序列结构,寡肽在小肠上皮细胞中的渗透率会影响DPP-IV 抑制反应的进行[1-2],此外,大多体外实验使用的DPP-IV 源自猪胰腺, 与人类DPP-IV 存在少许差异。
文献报道,分化的人类结肠癌细胞系(Caco-2细胞)中DPP-IV 的mRNA 表达水平较高,接近于正常人体小肠细胞的表达水平,重要的是该细胞系分化后还可以形成拥有紧密连接蛋白的致密单层与小肠细胞肠腔侧刷状缘绒毛结构[3]。 此外,Caco-2细胞分化为极化的肠上皮细胞后可以表达与人肠上皮细胞相同的刷状边缘酶、肽酶、碱性磷酸酶和二糖酶等[4]。因此,Caco-2 细胞单层模型是一种成熟的包括抑制剂在内的众多口服药物的筛选工具,通过它可以研究药物的吸收率、降解和转化[5-6]。 近年来,有大量关于活性寡肽的小肠吸收与转运机制的研究, 其中就包括利用Caco-2 细胞单层模型鉴定并研究鸡蛋蛋白源DPP-IV 抑制肽IRDLLER、YAEERYP 和IRNVLQPS[7];鳙鱼蛋白源DPP-IV 抑制肽IADHFL[8]。
在先前研究中[9],菜籽蛋白源IPQVS 被证实具有出色的DPP-IV 抑制活性 (IC50=(52.16±5.91)μmol/L)。 基于分化的Caco-2 细胞模型对IPQVS 的DPP-IV 抑制活性进行测定, 阐明其在模拟小肠上皮细胞中的吸收与降解机制,使用分子对接方法揭示小肠吸收、肠肽酶降解作用对IPQVS 活性的影响及规律。 这项研究的创新之处在于使用了体外Caco-2 细胞单层模型,该模型不仅更准确地测定了IPQVS 的活性,还提供了其在小肠中吸收、降解的相关参数。
1 材料与方法
1.1 材料与试剂
氢氧化钠、盐酸、Tris-HCl:中国国药集团公司产品;人体结肠癌细胞系Caco-2 细胞株:中国科学院上海生命科学研究院细胞资源中心产品;胎牛血清(FBS)、胰蛋白酶(含体积分数0.25%的EDTA)、DMEM 1x(Dulbecco’s Modified Eagle’s Medium)高糖(4.5 g/L D-葡萄糖)培养基:美国Gibco 公司产品;重组人类DPP-IV(EC 3.4.14.5)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、TRIzol试剂、Diprotin A (Ile-Pro-Ile, 纯度≥95%): 美国Sigma 公司产品;三氟乙酸(TFA)、乙腈、甲醇均为色谱级:德国Merck 公司产品;无RNA 酶水:国药集团化学试剂有限公司产品;FMOC 固相合成的IPQVS 及其降解产物PQVS、QVS、VS: 合肥国肽生物有限公司产品;DPP-IV GloTM 测定试剂盒、siRNA (DPP-IV)、Lipofectamine 2000 转染试剂、普通细胞培养板、离心管(50、15、2 mL):美国Thermo Fisher 公司产品;12 孔Transwell®培养板(聚酯膜,孔径0.4 μm,膜面积1.12 cm2)、25 cm2密封盖细胞培养皿、0.22 μm 有机微孔滤膜:美国康宁公司产品。
Beckman Coulter J6 冷冻离心机:贝克曼库尔特有限公司产品;SX-500 快速自动高压灭菌锅:日本Tomy Digital Biology 公司产品;FE20K 精密pH 计:梅特勒仪器公司产品;SpectraMax M2e 多功能酶标仪: 美国Molecular Devices 公司产品;7500 实时荧光定量PCR 仪: 美国AB SCIEX 公司产品;Class II Type B2 生物安全柜、3701 型二氧化碳恒温培养箱、超低温冰箱:美国Thermo Fisher 公司产品;凝胶成像系统:美国UVP imagaing 公司产品;LSM700 激光共聚焦显微镜:德国Zeiss 公司产品。
1.2 实验方法
1.2.1 Caco-2 细胞吸收实验 将Caco-2 细胞以5×104个/cm2的密度接种在Transwell®细胞培养平板的插入物(上室,AP 侧,即基底内侧)上,在12 孔细胞培养板的上下室的每个孔中加入0.5 mL DMEM, 每隔1 d 更换细胞培养基。 培养21 d 后,Caco-2 细胞完全分化为致密单层结构。在进行跨细胞转运实验测定之前,通过用Millicell ERS-2 测量跨上皮电阻(TEER)来评估Transwell®上室中细胞单层的完整性与致密性。 跨膜电阻值TEER 高于400 Ω 的Caco-2 细胞单层可以被用于模拟小肠上皮细胞吸收、转运实验。 丢弃完全分化的细胞单层中的培养基,使用PBS 洗涤细胞单层两次。 随后,将0.5 mL 含IPQVS 或其降解产物的HBSS 溶液(最终浓度为5 mmol/L)添加到AP 侧,并将1.5 mL 不含测试样品的HBSS 溶液添加到BL 侧 (基底外侧)。Caco-2 细胞单层模拟小肠上皮细胞吸收、转运实验共进行120 min,在90 min 时从Caco-2 细胞单层的AP 侧回收培养液, 在120 min 时从Caco-2 细胞单层的BL 侧回收培养液,进行液质联用(HPLC-MS)分析。 为了确定IPQVS 及其降解产物经Caco-2 细胞吸收的机制, 在Caco-2 细胞单层中添加了降低细胞间紧密连接的松弛素D(0.5 μg/mL)、转胞吞抑制剂渥曼青霉素 (500 nmol/L) 和肽转运蛋白1(PepT1)竞争抑制剂Gly-Pro(10 mmol/L)。以上试剂与Caco-2 细胞单层培养1 h 后, 在AP 侧添加5 mmol/L IPQVS 或其降解产物。 Papp 计算公式如下:

式中:Papp 为表观渗透系数,cm/s;Cd0是Transwell®小室AP 侧的初始肽浓度,mmol/L;MR是Transwell®小室BL 侧转运后寡肽的浓度,mmol/L;t 是时间,s;A 是Transwell®小室AP 侧细胞单层的表面积,cm2。
1.2.2 细胞培养与毒性实验复苏一瓶Caco-2 细胞(2.0 mL),将其置于型号为T75 的细胞培养瓶中,培养液为含有FBS(体积分数10%)、青霉素(100 U/mL)和链霉素(100 μg/mL)的DMEM,每2 d 更换一次培养液。 将Caco-2 细胞在体积分数为5%的CO2及37 ℃的细胞培养箱中孵育。当细胞生长至瓶底面积的80%~90%,使用胰蛋白酶(含体积分数0.25%的EDTA) 以1∶2 或1∶3 的分流比对细胞进行传代,每次传代的密度限定为1×105个/cm2。 使用的Caco-2细胞均在第10 至25 代。 通过MTT 比色分析法[10]对Caco-2 细胞相对活力进行了测定。 将Caco-2 细胞以每孔5×104个的密度接种在96 孔板中,并在体积分数5%的CO2及37 ℃环境中孵育。 培养21 d 后,移出培养基, 分别用200 μL 含有不同浓度(0.5、2.0、5.0 mmol/L) 的IPQVS 及其降解产物, 以及Diprotin A 培养基替换,进一步孵育2 h 或24 h。 仅加入DMEM 的孔作为对照组。 再将200 μL MTT(5.0 mg/mL) 加入每个孔,Caco-2 细胞在37 ℃下继续孵育4 h。 接着除去含有MTT 的培养基,并向每个孔中加入150 μL 的DMSO 溶液。 将96 孔板放置在台式振荡器上振荡0.5 h。 最后,在酶标仪中于570 nm处测量96 孔板吸光度。 与对照相比,细胞相对活力降低超过10%的肽样品浓度被认为具有细胞毒性。
1.2.3 DPP-IV 抑制活性测定参照文献[11]进行DPP-IV 抑制率的测定。整个实验在37 °C 恒温条件下进行,使用Diprotin A 作为阳性对照物。实验组为50 μL 含有反应底物Gly-Pro-p-nitroanilide 的测试样品,底物最终浓度0.2 mmol/L。阴性对照包含100 mmol/L Tris-HCl 缓冲液(pH 8.0,50 μL)和反应底物。 通过添加DPP-IV(质量浓度0.002 5 mg/mL)来引发反应,反应1 h 后立即加入1 mol/L 的醋酸-醋酸钠缓冲液(pH 4.0)中止反应。 所有试剂和样品均在100 mmol/L Tris-HCl 缓冲液(pH 8.0)中稀释。 使用酶标仪在405 nm 下读取96 孔板的吸光度。 不同样品中DPP-IV 的IC50通过测试样品浓度对数值-相对活性的函数作图, 计算50%DPP-IV 被抑制所需的测试样品浓度。 参考已有的对体外DPP-IV 活性的研究[9],使用DPP-IV GloTM 测定试剂盒评估IPQVS 的抑制活性。 将Caco-2 细胞以5×104个/cm2的密度接种到12 孔Transwell®板中,用25~250μmol/L IPQVS 或其降解产物处理Caco-2 细胞24 h。 然后使用BCA 蛋白质分析试剂盒评估每个样品的蛋白质质量浓度,使用Tris-HCl 缓冲液(pH 8.0)调节最终体积, 将Caco-2 细胞提取物和上清液中的蛋白质质量浓度归一化。 使用上层培养液和细胞裂解液的混合物测量DPP-IV 的含量。 使用酶标仪在10 min内测量吸光度,该吸光度与DPP-IV 活性成正比。将处理样品与对照样品进行比较,对照组样品中仅含有加入DMEM 的细胞裂解物和细胞上清液。
1.2.4 DPP-IV 基因表达分析使用Lipofectamine 2000 和不含血清的优化DMEM 培养基配置得到混合物(siRNA(DPP-IV)浓度为40 pmol/L)。取出接种了Caco-2 细胞的6 孔板,用PBS 清洗两次,再用不含血清的优化DMEM 培养基清洗一次。 吸弃清洗液,每孔加入不含血清的优化DMEM 培养基,再加0.5 mL 含siRNA(DPP-IV)的混合液。 轻轻摇匀,放入细胞培养箱孵育6 h (体积分数5% CO2,37 ℃)。6 h 后吸弃孔板中液体, 换入正常的含血清培养液继续孵育24 h,再用不同浓度的IPQVS 处理Caco-2细胞24 h,随后Caco-2 细胞可用于后续实验。 通过蛋白质印迹法结果可以表征siRNA 对DPP-IV 基因的沉默效率[12]。
1.2.5 免疫荧光实验用250 μmol/L IPQVS 和50 μmol/L Diprotin A 处理Caco-2 细胞单层, 再用DPBS 洗涤3 次, 用体积分数4%的多聚甲醛水溶液固定10 min, 用体积分数0.5%Triton X-100 在25℃下放置5 min。 在25 ℃下用体积分数5%的牛血清白蛋白(BSA)封闭1 h 后,将Caco-2 细胞单层与一抗(浓度比1∶50,在体积分数5%BSA 中稀释)在4℃下孵育过夜。 接下来,将一抗吸弃,用PBST 溶液洗涤Caco-2 细胞3 次,将山羊抗鼠FITC 二抗的稀释液加入,25 ℃下避光孵育2 h。 二抗孵育完毕以后,以PBST 洗涤Caco-2 细胞3 次,将DAPI 染色液加入,25 ℃下避光孵育10 min。 最后用PBST 洗涤Caco-2 细胞3 次, 使用激光共聚焦显微镜获取Caco-2 细胞单层图像。
1.2.6 模拟分子对接使用分子对接软件(MOE)对IPQVS 及其代谢物进行分子对接并优化到DPPIV(PDB ID:1X70)的结合位点。 对接口袋与已发表的文章一致[13-15]。 DPP-IV 的3D 结构可从RCSB 蛋白质数据库 (www.rcsb.org) 下载。 使用Accelrys Discovery Studio 1.1.2 版软件来去除水分子并优化肽的空间结构。 选择产生的具有最小结合能的构象进行分析,并使用PyMOL 软件生成分子结构。 根据一级配体的位置, 确定DPP-IV 活性位点的坐标为center_x =-10.733,center_y =12.416 和 center_z =68.829,其中size_x=20,size_y=20,size_z=20。使用活性位点和底物之间的总相互作用能评估最终稳定肽-底物复合物的分数。
1.3 数据处理
所有实验至少重复3 次, 采用SPSS 21.0 软件对数据进行统计分析,两组间比较应用t 检验,多组间比较应用单因素方差分析。
表格中结果以平均数±标准偏差(SD)表示,图中数据以平均数±标准误差表示。 以P<0.05 作为具有统计学意义的差异判定。
2 结果与分析
2.1 IPQVS 及其降解产物在Caco-2 细胞模型中的吸收
IPQVS 在Caco-2 细胞单层(经过21 d 培养)上孵育90 min 后,52%的IPQVS 在Transwell®的上室AP 侧保持结构完整,然而转运至下室BL 侧并保留其原始结构的只占初始量的2.7%, 见图1 (a)~(c)。 Transwell®小室的AP 侧和BL 侧发现了IPQVS 的3 个主要降解片段, 经HPLC-MS 鉴定IPQVS(保留时间为12.90 min)降解的3 个肽片段分别是PQVS(保留时间为11.07 min)、QVS(保留时间为13.99 min)和VS(保留时间为17.10 min)。表1为IPQVS 及其降解产物跨小肠上皮细胞转运的相关数据,IPQVS 的Papp 为(1.35±0.09)×10-6cm/s,降解肽PQVS、QVS、VS 的Papp 分别为(1.46±0.18)×10-6、(0.95±0.08)×10-6、(3.01±0.15)×10-6cm/s。 不难发现,氨基酸残基数越少的寡肽在小肠吸收上更具优势。如图1(d)所示,细胞松弛素D 显著增加了IPQVS及其降解产物的吸收量(P<0.05),表明细胞旁路均是4 条肽的吸收方式。其中疏水性最强的IPQVS 与二肽VS 的吸收量在渥曼青霉素预处理的情况下被显著抑制,表明转胞吞作用可能也是它们的吸收方式。值得注意的是,VS 存在3 种可能的吸收途径(细胞旁路、胞吞转运和PepT1 转运),这主要因为其氨基酸残基数小于3,且为疏水性氨基酸。

图1 IPQVS 跨Caco-2 细胞单层膜吸收作用的分析Fig. 1 Analysis of the transepithelial transport of IPQVS across Caco-2 cell monolayer
2.2 IPQVS 及其降解产物对Caco-2 单层细胞的毒性
用不同浓度(0.5、2.0、5.0 mmol/L)的IPQVS 处理单层Caco-2 细胞后, 使用MTT 法确定单层Caco-2 细胞相对活力。 如图2(a)所示,浓度为5.0 mmol/L 的PQVS、QVS、VS 持续作用24 h 会显著降低Caco-2 细胞的相对活力 (P<0.05); 浓度为2.0 mmol/L 及以上的Diprotin A 作用24 h 对单层Caco-2 细胞有毒性,细胞相对活力均低于90%。 但是, 同样浓度的上述寡肽作用于Caco-2 细胞2 h,细胞相对活力没有显著降低(见图2(b),P>0.05)。因此,使用浓度为5.0 mmol/L 的寡肽IPQVS 及其降解产物进行2 h 的模拟小肠上皮细胞吸收实验是安全且无生物毒性的。 鸡蛋蛋白源降血压肽LKP 和IQW 模拟小肠上皮细胞吸收、转运实验的结果与上述相似,Caco-2 细胞与目标肽 (浓度为2.0、5.0 mmol/L)的短时间共同孵育(2h)不会诱导细胞毒性[16]。

图2 MTT 法检测IPQVS 及其降解产物在Caco-2 细胞中的细胞毒性Fig. 2 Cytotoxicity of IPQVS and its degradation products in Caco-2 cells by MTT assay
2.3 基于Caco-2 细胞单层对IPQVS 的DPP-IV抑制活性
如图3(a)及表1 所示,IPQVS 以剂量依赖型方式抑制Caco-2 细胞单层中的DPP-IV 活性,IC50为(101.66±6.02) μmol/L,数值高于体外化学底物法测量值。 Diprotin A 的IC50也从(3.62±0.37) μmol/L 增加至 (12.18±0.36) μmol/L。 当IPQVS 的浓度超过250 μmol/L 时,抑制率曲线趋于平缓。 图3(d)表明浓度为250 μmol/L 的IPQVS 在Caco-2 细胞单层中孵育60、90、180、360 min 后, 细胞内DPP-IV 的相对活性分别降低了36.49%、42.37%、62.71%和64.70%。 IPQVS 调节DPP-IV 基因表达的能力亦在Caco-2 细胞单层上进行了测试。 如图3(b)所示,蛋白质印迹法结果表明siRNA(DPP-IV)显著降低了Caco-2 细胞中DPP-IV 的表达。 与对照组相比,siRNA(DPP-IV)组DPP-IV 的mRNA 表达水平下降了50%以上,并具有统计学意义(P<0.01)。 不难发现,IPQVS 不会影响Caco-2 细胞单层中DPP-IV的mRNA 表达。

图3 IPQVS 对体外Caco-2 细胞中DPP-IV 活性的影响Fig. 3 Effects of IPQVS on DPP-IV activity in vitro in Caco-2 cell
IPQVS 及其降解产物在体外对DPP-IV 的IC50如表1 所示, 其中PQVS 和VS 的IC50分别为(120.74±8.60) μmol/L 和 (68.59±4.28) μmol/L,均高于IPQVS,QVS 的体外IC50甚至超过了500 μmol/L。Caco-2 细胞实验中,PQVS (IC50=(195.69±6.37)μmol/L)和QVS(IC50>500 μmol/L)对DPP-IV 的抑制活性显著低于IPQVS。 VS 在Caco-2 细胞单层模型测定中的IC50小于IPQVS, 但由于VS 含量是IPQVS 降解产物中最低的,所以并不能改变IPQVS在Caco-2 细胞单层模型中DPP-IV 抑制率降低的结果。 免疫荧光是研究细胞内源蛋白酶表达的一种有效方法[17]。 如图4 所示,与对照组相比,浓度为250 μmol/L 的IPQVS 和50 μmol/L Diprotin A 能够使Caco-2 细胞单层的DPP-IV 对应的荧光强度下降60%以上(P<0.01)。 此外,两者处理后的Caco-2细胞边缘和培养空隙中的绿色荧光亮度大幅降低(见图4(a))。

图4 激光共聚焦扫描显微镜的二维荧光检测与定量分析Fig. 4 Confocal laser scanning microscopy depicting two-dimensional fluorescence detection and quantification
结合表1 中IPQVS 及其降解产物对DPP-IV的IC50,推测IPQVS 在Caco-2 细胞模型中对DPPIV 抑制活性降低的原因是在小肠吸收过程中发生了降解作用, 新产生的肽段碎片PQVS 和QVS 的DPP-IV 抑制活性较IPQVS 发生了不同程度的降低。 同样, 有研究者发现乳源DPP-IV 抑制肽LPYPY 在Caco-2 细胞单层模型中的降解产物YPY、LP、YP 的抑制活性均不如IPQVS,其中抑制活性最强的二肽YP 的酶抑制率相较于IPQVS 也下降了63%[18]。 当然,也有特殊的肽被发现,来自鳙鱼蛋白的DPP-IV 抑制肽IADHFL 产生了相反的现象,其片段IADHF 不仅具有更好的DPP-IV 抑制活性,而且还具有减弱DPP-IV 基因表达的能力[8]。

表1 IPQVS 及其降解产物的鉴定、抑制活性及PappTable 1 Amino acid reside sequence, IPQVS activity, and Papp value of IPQVS and its degradation products
2.4 IPQVS 及其降解产物与DPP-IV 的分子对接
分子对接实验结果揭示了IPQVS 及其降解产物与DPP-IV 之间的相互作用和关键结合位点信息。 表2 中详细列出了4 条寡肽(IPQVS、PQVS、QVS 和VS)的分子建模参数与对接信息。 IPQVS 和DPP-IV 相互作用并形成的复合物具有最高的亲和力绝对值。 4 条肽的结合能分别为-8.95、-7.99、-6.87、-8.24 kJ/mol。Pymol 3D 图上标记了分子间能量低于-2.0 kJ/mol 的结合位点(见图5)。 IQPVS 与DPP-IV 的氨基酸残基位点Arg125、Tyr631、His740、Glu205 和Glu206 形成了5 个氢键;此外,IPQVS 的N 端与Glu205 形成了离子键。IPQVS 的3 种降解产物和DPP-IV 之间的氨基酸残基相互作用位点的数量相对于IPQVS 发生了减少, 特别是对于QVS,其氨基酸作用位点的数量最少(仅Glu205 和Glu206),见图5(c)。IPQVS 活性在小肠细胞中衰减的现象与先前报道的DPP-IV 抑制肽ELHQEEPL 一致[19]。
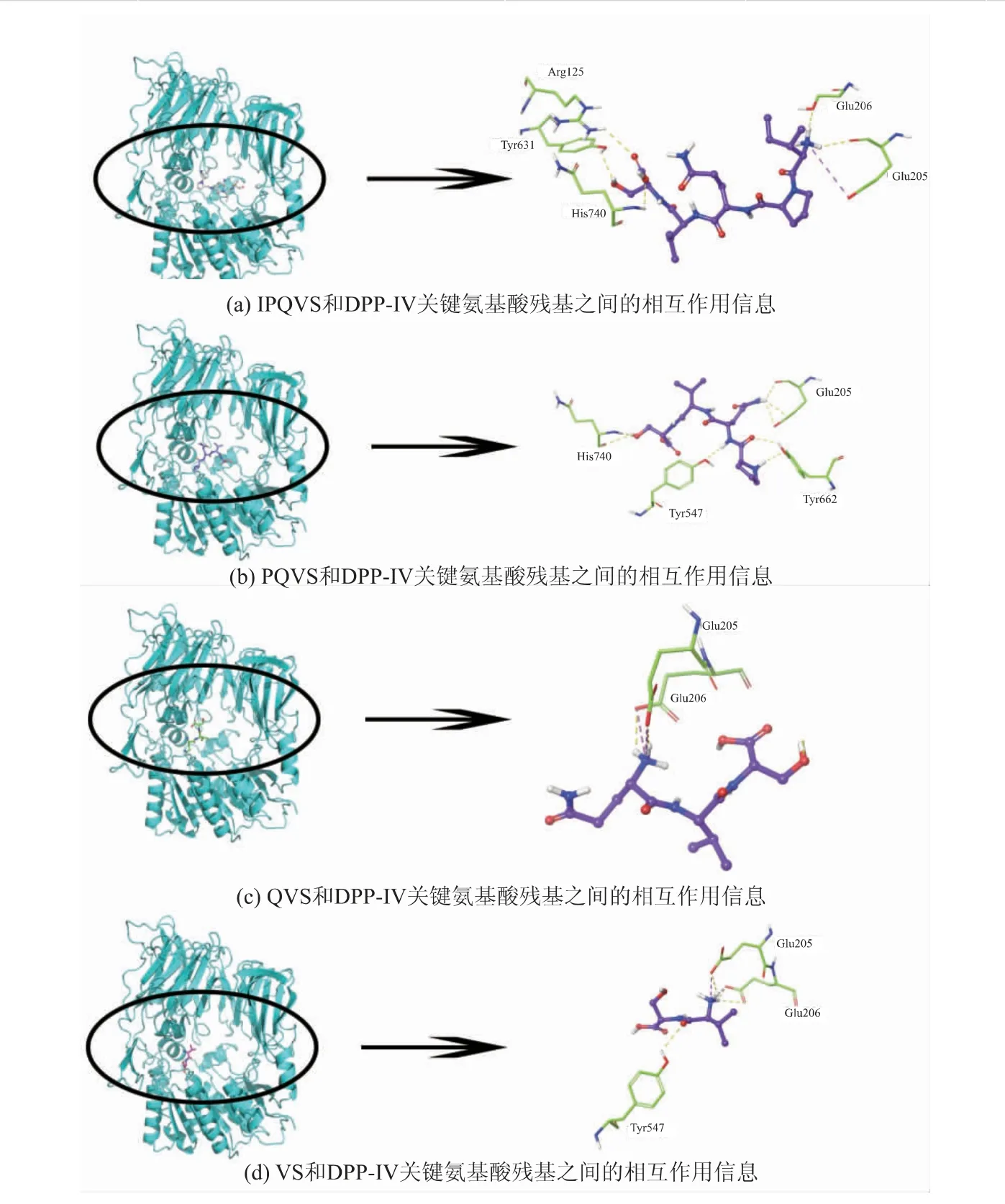
图5 分子对接结果的Pymol 3D 图Fig. 5 Pymol 3D graphs for the information of molecular docking

表2 计算模型对接能量得分和相互作用结果Table 2 Computational-modeling energy scores and interaction results
IPQVS 的降解产物PQVS、QVS 与DPP-IV 相互作用中的氢键、π-Cation(阳离子和芳香性体系之间的相互作用)数量减少,进而导致它们与DPP-IV之间结合能的绝对值降低。说明IPQVS 在肠道吸收过程中无法维持其体外原有的DPP-IV 抑制活性,原因可能是Caco-2 细胞中包括二肽基肽酶在内的氨基肽酶、内肽酶等肠肽酶会破坏其原有结构[20-21]。
另外, 前文涉及的Caco-2 细胞实验与分子对接实验相结合的方法对DPP-IV 的筛选与鉴定具有快速、简便且精准的优势[15]。尽管模拟分子对接技术已作为标准化计算工具广泛应用于DPP-IV 抑制肽的筛选与研究中,但仍需通过体内实验验证预测[22]。
3 结 语
基于Caco-2 细胞研究了DPP-IV 抑制肽IPQVS 的活性与小肠吸收机制, 主要从IPQVS 在Caco-2 细胞单层中的DPP-IV 抑制活性较体外化学底物法的测定结果显著降低这一现象入手,揭示了其小肠吸收途径、表观渗透系数,评价了其降解肽片段对DPP-IV 抑制活性的影响。 总体来说,Caco-2 细胞模型可被作为一种全面评价IPQVS 活性的有效生物技术与工具。
