鸭IFN-β mRNA SYBR Green Ⅰ荧光定量RT-PCR检测方法的建立
2022-01-07方铁辉肖世峰程晓霞林锋强朱小丽陈秀琴陈仕龙陈少莺
方铁辉,董 慧,2,肖世峰,2,王 劭,2,程晓霞,2,林锋强,2,朱小丽,2,陈秀琴,2,郑 敏,2,陈仕龙,2 ,陈少莺,2
(1. 福建省农业科学院畜牧兽医研究所,福建 福州 350013;2. 福建省畜禽疫病防治工程技术研究中心,福建 福州 350013)
0 引言
【研究意义】干扰素(Interferon,IFN)是宿主细胞分泌的一类广谱的抗病毒细胞因子,在抗病毒感染的天然免疫反应中发挥重要作用。IFN根据其结合的受体不同分为Ⅰ、Ⅱ、Ⅲ型3种基本类型,其中Ⅰ、Ⅲ型干扰素与天然免疫密切相关,Ⅰ型干扰素来源广泛,几乎所有的细胞均能产生,主要包括IFN-α和IFN-β[1]。宿主为了抵御病毒的入侵,上调表达IFN-β等Ⅰ型、Ⅲ型干扰素,迅速启动抗病毒天然免疫应答;而病毒为了能够持续感染和致病,往往进化出拮抗或逃逸宿主天然免疫的功能[2]。检测宿主细胞干扰素的表达水平能反应宿主的天然免疫状态,为评价宿主的抗病毒水平及研究病毒拮抗宿主天然免疫的功能提供依据。【前人研究进展】国内外对鸭IFN-α的克隆、表达、检测及功能研究有较多报道[3-5],而鸭IFN-β的克隆、表达及抗病毒活性研究较少。高全新等[6]建立了基于荧光素酶双报告基因系统测定鸭IFN-β的表达水平的检测方法,一些学者用qPCR检测了禽坦布苏病毒等水禽病毒感染宿主后IFN-β及天然免疫相关基因mRNA相对转录水平[7-8]。【本研究切入点】实时荧光定量RT-PCR常用于基因的mRNA表达水平的检测,不仅能够准确对表达量进行定量,而且操作简便、快速[9-10]。准确定量测定鸭IFN-β mRNA表达水平的荧光定量PCR方法目前仍少有报道。【拟解决的关键问题】本研究旨在建立一种用于检测鸭IFN-β mRNA表达水平的SYBR Green Ⅰ实时荧光定量RT-PCR方法,为检测鸭体内和细胞中IFN-β mRNA转录水平提供一种有效的检测手段,也为研究病毒感染与宿主天然免疫应答的互作研究奠定基础。
1 材料与方法
1.1 试验材料
无菌采集7日龄健康樱桃谷鸭脾脏、肝脏及胰腺,无菌Hank’s液研磨成匀浆,-70 ℃保存备用;原核表达载体pET-30a由本实验室保存;DH5α购自北京全式金生物技术有限公司(全式金);鸭胚成纤维细胞传代细胞系(DEFs)购自美国ATCC细胞库。
1.2 主要试剂与仪器
CFX 96荧 光 定 量PCR仪(Bio-Rad)、梯度PCR仪(Bio-Rad),RT-PCR反转录试剂盒、SYBR Green Ⅰ qPCR MIX、RNA提取试剂盒及RNA纯化试剂盒(全式金),DNAase(TIANGEN)、BamHⅠ和HindⅢ限制性内切酶(Takara),Phanta Max Super-Fidelity DNA Polymerase、胶回收试剂盒(诺维赞),T4 DNA连接酶(NEB),质粒小提试剂盒(QIAGEN)。2×DreamTaqGreen PCR Master Mix(Thermo Scientific)。
1.3 引物合成
据GenBank公 布 的 鸭IFN-β(KT428159)的cDNA序列,采用Oligo 7软件合成鸭IFN-β全长引物,并在其上、下游分别引入BamH Ⅰ、HindⅢ酶切位点,在其保守序列区设计荧光定量PCR特异性引物,将扩增的IFN-β全长片段用于构建重组表达质粒,并作为荧光定量PCR阳性标准品;设计一条能特异扩增鸭IFN-β的qPCR引物,以上引物均由白鲸生物技术有限公司合成,引物序列见表1。
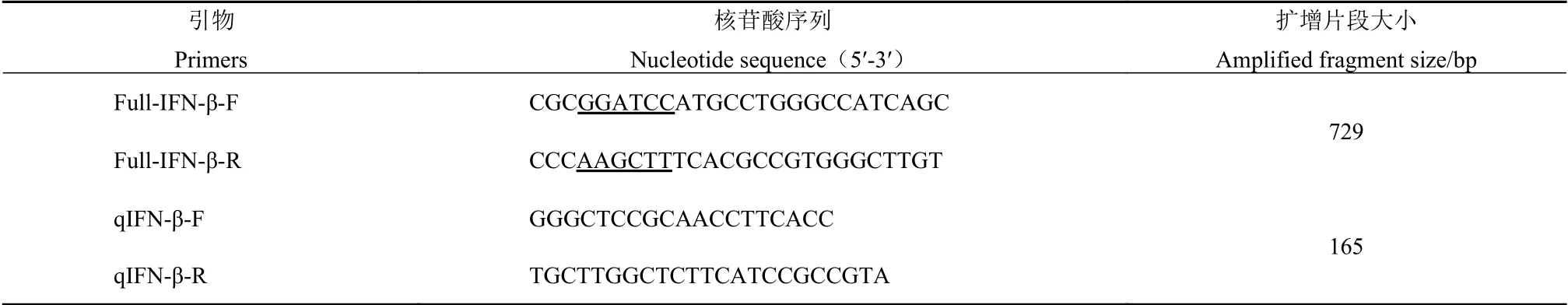
表1 引物核苷酸序列及扩增片段大小Table 1 Primer sequences and amplified fragment sizes
1.4 组织RNA提取及cDNA合成
用总RNA提取试剂盒按操作说明书分别提取鸭脾脏、肝脏、胰腺及DEFs细胞的总RNA,提取的RNA经DNAase消化后,用RNA纯化试剂盒纯化,溶于35 μL DEPC水,用于合成cDNA。按20 μL反应体系:总RNA 1 μg,5×Super Mix 4 μL,gDNA Remove 1 μL,加水补至20 μL,按说明书反应程序50 ℃ 15 min,85 ℃ 5 s合成cDNA。合成的cDNA于-20 ℃保存备用,用于常规PCR扩增IFN-β全长及荧光定量PCR检测。
1.5 鸭IFN-β重组表达质粒的制备
用表1的Full-IFN-β-F、Full-IFN-β-R为上下游引物,脾脏组织获得cDNA作为模板,用高保真酶做常规PCR扩增目的基因。反应体系50 μL:cDNA 1 μL,上、下游引物各2 μL,2×Phanta Max Buffer 25 μL,dNTP MIX 1 μL,DNA Polymerase 1 μL,加DEPC水补至50 μL;反应程序:95 ℃预变性3 min,95 ℃变 性40 s,61.5 ℃退 火40 s,72 ℃延 伸40 s,72 ℃终延伸5 min,共进行33个循环。用凝胶回收试剂盒回收目的条带。对回收的PCR产物及表达载体pET-30a分别用BamH Ⅰ和HindⅢ限制性内切酶进行双酶切,回收纯化的双酶切产物,并用T4 DNA连接酶将目的基因同表达载体pET-30a进行重组连接。将连接产物转化至DH5α感受态细胞,卡那抗性的LB培养基上涂板,挑单菌落摇菌扩大培养,提取质粒。提取的质粒用于PCR和测序验证,将测序验证阳性的重组克隆质粒作为阳性标准品,用核酸浓度测定仪测定DNA浓度后,按公式copies=6.02×1023×(质量/分子质量),计算重组质粒的拷贝数,并以10倍比稀释至下限为10-1copies·μL-1。
1.6 常规PCR及荧光定量PCR
以表1所设计的qIFNβ-F、qIFNβ-R作为引物,常规PCR反应体系:2×PCR Mix 10 μL,上、下游各1 μL,模板cDNA 1 μL,DEPC水7 μL,反应程序:95 ℃预变性3 min,95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,72 ℃终延伸5 min,共进行33个循环。qPCR反应体系20 μL:上、下游各0.5 μL,2×qPCR Super Mix 10 μL,模板cDNA 1 μL,DNA/RNA free水8 μL,反应程序:94 ℃预变性30 s,94 ℃变性5 s,60 ℃ 30 s进行退火和延伸,共进行40个循环,而后进行荧光信号采集。
1.7 标准曲线的建立
以倍比稀释的阳性标准质粒1×101~1×108copies·μL-1作 为 模 板,以qIFN-β-F、qIFN-β-R作为qPCR上下游引物,在荧光定量PCR仪上进行扩增及分析,并计算Ct值用于绘制标准曲线。
1.8 特异性及敏感性试验
分别用常规PCR和荧光定量PCR验证所设计的IFN-β qPCR引物的特异性,分析产物的熔解曲线及对产物进行核酸凝胶电泳分析,将10-1~103copies·μL-1的阳性标准质粒作为模板,用于检测qPCR反应的检出下限。
1.9 重复性试验
分别用所建立的qPCR检测方法检测鸭脾脏、肝脏、胰腺3种不同的组织样品mRNA表达水平,组间组内各进行3次重复性试验,并计算变异系数。
2 结果与分析
2.1 鸭IFN-β重组质粒的构建
用Full-IFN-β-F、Full-IFN-β-R引物从鸭脾脏组织样品中扩增出732 bp鸭IFN-β的完整基因片段(图1-A)。构建的pET-30a-IFN-β重组表达质粒也能扩增出732 bp的目的条带(图1-B),重组质粒经BamH Ⅰ和HindⅢ双酶切后出现732 bp的目的片段和5.4 kb左右的载体条带(图1-C);将阳性克隆质粒送生工测序,测序结果与GenBank中的鸭IFN-β(KM035791)和(KT428159)核苷酸同源性分别为100%和99.77%,表明鸭IFN-β成功导入pET-30a。
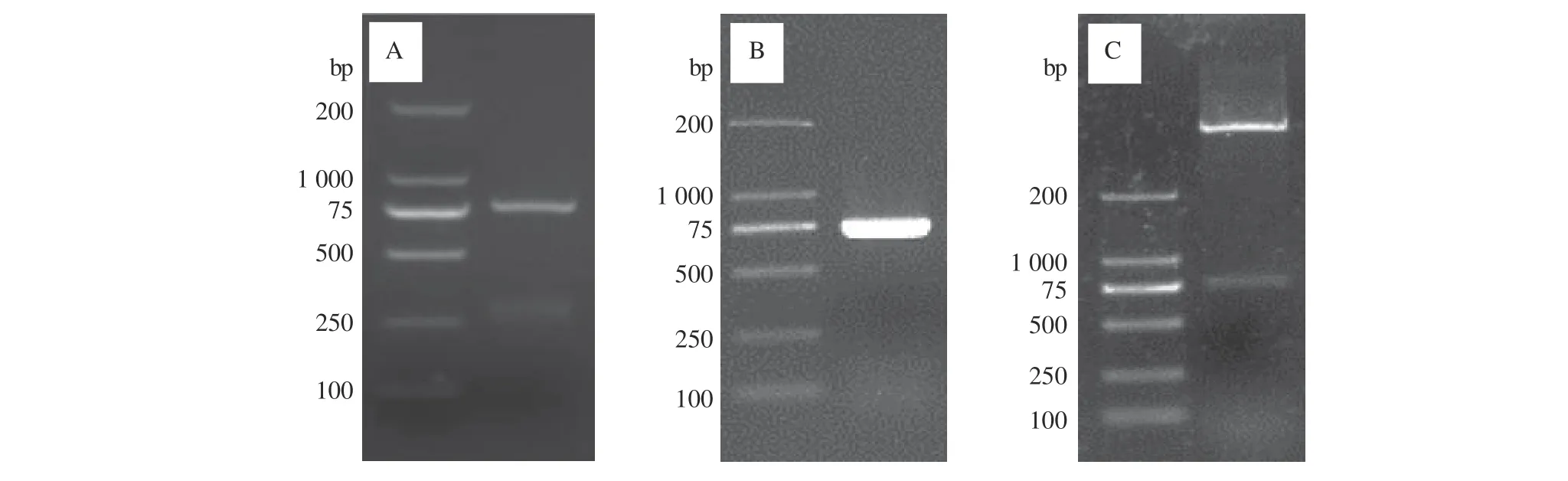
图1 鸭IFN-β全基因的PCR扩增及重组质粒的构建Fig. 1 PCR amplification of duck IFN-β and construction of recombinant plasmid
2.2 荧光定量PCR检测
以qIFN-β-F、qIFN-β-R为引物,不同组织来源的cDNA作为模板(肝、脾、胰和DEFs),分别进行qPCR和常规PCR检测。结果显示,qPCR和常规PCR均能扩增出特异的165 bp预期目的片段(图2),且qPCR产物熔解曲线单峰,熔解温度为87.94±0.16 ℃(图3),PCR产物序列与鸭IFN-β序列一致,证明所设计的qPCR引物特异性强,无引物二聚体及非特异扩增。
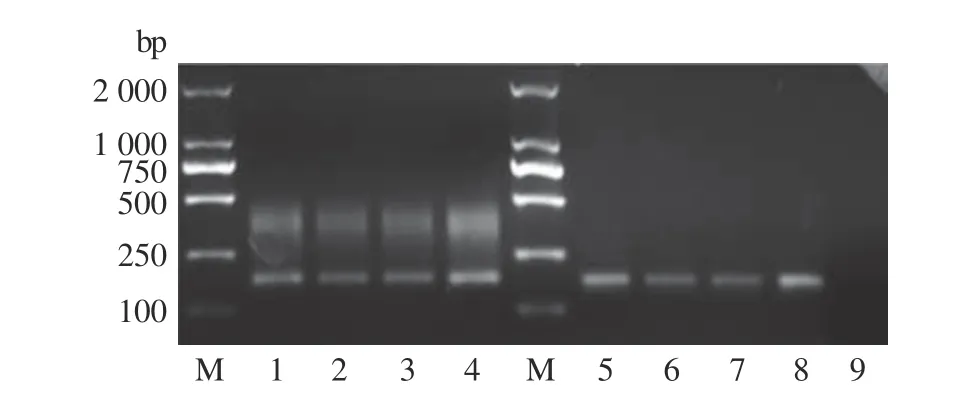
图2 不同组织IFN-β的常规RT-PCR和荧光定量RT-PCRFig. 2 Conventional RT-PCR and qRT-PCR amplification of IFN-β in different tissues

图3 鸭4种组织(肝、脾、胰和DEFs)IFN-β 荧光定量RTPCR熔解曲线Fig. 3 qRT-PCR melting curve of duck IFN-β
2.3 标准曲线的建立
将所构建的 pET-30a-IFN-β重组质粒按10倍比梯度稀释,取8个梯度的(2.84×101~2.84×108copies·μL-1)的重组质粒作为阳性标准品进行qPCR检测,计算Ct值并建立标准曲线。由图4可见,Ct值与标准质粒浓度间呈现良好的线性关系,相关系数R2= 0.9951,鸭IFN-β标准曲线方程为y=-3.5444x+38.195,扩增效率E=92%(图5),图4为IFN-β的扩增曲线。
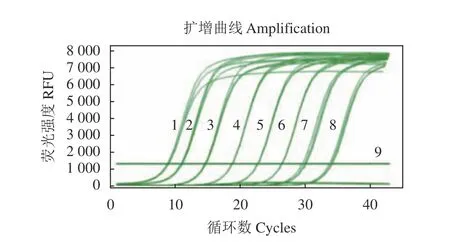
图4 IFN-β 荧光定量RT-PCR扩增曲线Fig. 4 Amplification curve of qRT-PCR for IFN-β

图5 IFN-β 荧光定量RT-PCR扩增的标准曲线Fig. 5 Standard curve of qRT-PCR for IFN-β
2.4 灵敏度检验
取含量为2.84×10-1~2.84×103copies·μL-1阳性标准重组质粒作为模板,每个样品组内重复3次,进行qPCR检测,各不同浓度样品的Ct值(X±SD)见表2。所建立鸭IFN-β SYBR Green Ⅰ实时荧光定量RT-PCR方法可检出下限为2.84 copies·μL-1,且在28.4 copies·μL-1以上的模板含量有良好的重复性。

表2 实时荧光定量RT-PCR敏感性检测Table 2 Sensitivity of qRT-PCR assay
2.5 重复性检验
将所采集自雏鸭的肝、脾、胰3种不同组织样品,以所建立的IFN-β 实时荧光定量RT-PCR检测方法分别进行3次重复,进行组间及组内重复性检测。结果显示,3种不同组织样品检测的组内Ct值变异系数为0.11%~0.13%,组间Ct值变异系数均不超过1%(表3)。表明所建立的检测方法重复性良好。
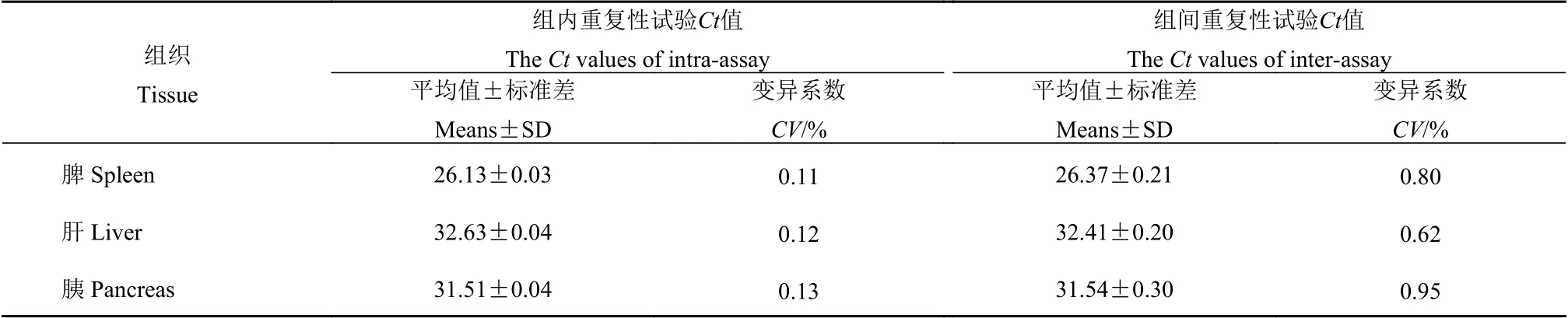
表3 实时荧光定量PCR方法的批内与批间重复性评价结果Table 3 Reproducibility of intra- and inter-qRT-PCR assays
3 讨论与结论
宿主体内的多种细胞能够分泌IFN-β,如淋巴细胞、成纤维细胞、内皮细胞等。当病毒感染后,宿主细胞分泌的IFN-β等干扰素并不直接杀伤或抑制病毒,而是与细胞表明的干扰素受体结合,通过JAKSTAT途径激活下游多种干扰素刺激基因(ISGs)的表达,这些ISGs分泌的抗病毒蛋白发挥抗病毒、抗肿瘤和抗炎等免疫调节反应[11-12]。Li Ning等[13]发现鸭MAVS蛋白能够激活鸭IFN-β表达,进而抑制感染早期时病毒的复制;Zhang Huihui等[14]、Li Ning等[15]发现宿主过表达鸭DDX1和DDX3X基因能够激活鸭IFN-β等天然免疫信号通路,抑制病毒的复制;He Tianqiong等[16]发现鸭病毒性肠炎病毒的pUL47蛋白能够抑制体内IFN-β及下游抗病毒蛋白的表达;DTMUV NS2A蛋白通过与duSTING结合,抑制鸭IFN-β转录,破坏STING介导的抗病毒天然免疫[17]。因此,IFN-β等Ⅰ型干扰素的转录水平是机体天然免疫的重要评价指标。
SYBR Green Ⅰ实时荧光定量PCR技术无需设计探针、灵敏度高、操作方便,自动化程度高,减少了常规PCR的上样电泳步骤,有效缩短了检测时间,但对引物的设计要求较高。本研究设计的IFN-β引物,常规PCR扩增出现165 bp目的片段,荧光定量PCR扩增产物为单峰,均具有良好的特异性,适合用于建立鸭IFN-β SYBR Green Ⅰ实时荧光定量PCR检测方法。
本研究构建了pET-30a-IFN-β重组质粒作为阳性标准品,通过绘制的标准曲线,y=-3.5444x+38.195,相关系数R2>99.5%,表明线性拟合程度好,该方法灵敏度高,检测下限为2.84 copies·μL-1,重复性良好,不同组织样品的组内变异系数为0.11%~0.13%,组间变异系数不超过1%,可以直接用于样品IFN-β mRNA表达量的准确定量检测。本研究建立的SYBR Green Ⅰ实时荧光定量RT-PCR检测方法还可以利用GAPDH或β-Actin等管家基因作为内参,荧光定量PCR仪上同时进行IFN-β和管家基因的检测,得到IFN-β mRNA表达水平的相对定量,明确IFN-β mRNA在不同组织和细胞中的表达差异,为从mRNA水平上研究鸭应答病原微生物感染的免疫调控机制奠定基础。
