一株鸭肝炎病毒的基因组序列及其VP1基因的多克隆抗体制备
2022-01-07杨世丽黄雅贞陈仕龙马燕梅
杨世丽,常 巍,袁 梦,黄雅贞,陈仕龙,马燕梅
[1. 福建农林大学动物科学学院(蜂学学院),福建 福州 350002;2. 福建省农业科学院畜牧兽医研究所,福建 福州 350013]
0 引言
【研究意义】鸭病毒性肝炎(Duck viral hepatitis,DVH)是由鸭病毒性肝炎病毒(Duck hepatitis virus,DHV)引起的一种发病急、传播快、病程短和死亡率高的急性传染病[1-2]。DHV主要感染3周龄内的雏鸭,以1周龄内雏鸭最为易感[3]。病鸭的临床症状主要表现为抽搐和角弓反张,典型的病理特征为肝脏肿大和瘀斑样出血[4-5]。DHV的3个血清型在抗原上互不交叉,可分别引起I型、II型和III型DVH[6]。然而,DVH的变异株层出不穷,现有的相关研究并不充足,生产上存在较大的防治缺口,因此,临床上开展DVH的深入研究,了解DVH的病原性特点和流行规律,并研究有效的防治技术,对减少DHV对鸭养殖业的影响十分必要。【前人研究进展】I型鸭肝炎病毒(Duck hepatitis virus type I,DHV-I)基因组为7700 nt的单股正链RNA,编码一个约6750 nt的开放阅读框(Open reading frame,ORF)和约626 nt的非编码区(Untranslated region,UTR)5′UTR、3′UTR[7-8]。ORF区编码多聚蛋白,多聚蛋白在翻译过程中不断被自身编码的蛋白酶水解为结构蛋白P1和非结构蛋白P2、P3[9]。结构蛋白P1包括VP0、VP1和VP3,位于病毒核衣壳,可决定病毒的抗原性和血清型[7,10]。目前在世界各地发生和流行的主要是DHV-Ⅰ。黄均建于1963年首次报道了本病在中国的发生[11],王平等于1980年在北京首次分离得到DHV-I[12]。【本研究切入点】VP1蛋白基因编码的主要抗原位点,对DHV的致病性、进化和毒力起至关重要的作用[13],而关于全长VP1蛋白的兔多抗制备和应用方面的研究相对较少。2015年福建某鸭场出现疑似鸭肝炎病死鸭,病死鸭出现头部上仰、脚部后翻的角弓反张的症状,肝脏出现肿大且有密集出血点,胆囊出现肿大充血,脾脏和胰腺也出现明显的肿大。其病原有待进一步分离鉴定。【拟解决的关键问题】本研究取病死鸭肝脏组织进行病毒分离鉴定,为确定该病毒的基因型进行了全基因测序,并利用pGEX-4T-1载体构建VP1的高效表达系统,制备兔多克隆抗体,用Westernblotting检测验证其特异性,为补充DHV的基因库及研究和控制DVH的发生和流行与I型DHV的临床快速检测提供参考依据。
1 材料与方法
1.1 病毒株、试验动物、载体和菌株
试验鸭取自福建某鸭场疑似鸭肝炎病死鸭,2015年采集并进行病毒分离,分离后的病毒于-80 ℃保存,进行后续试验。非免疫樱桃谷鸭的鸭胚及健康樱桃谷雏鸭购自漳州昌龙农牧有限公司和福州创新农牧有限公司。H9N2、DHV-I型标准毒株和pGEX-4T-1为实验室原有保存。感受态细胞E.coilDH5α和E.coilBL21(DE3)购自北京全式金生物技术有限公司。
1.2 工具酶及试剂
Trizol 购自碧云天生物技术研究所,胶回收试剂盒购自全式金生物公司,TRYPTONE、YEAST EXTRACT、Agar购自OXOID公司,核酸限制性内切酶BamH I-HF和SalI-HF购自NEB公司,T4DNA连接酶、Pyrobest、Primer STAR高保真DNA聚合酶、Taq酶、Oligo(dT)18 Primer、Recombinant Dnase I、核酸Marker DL2000等购自TaKaRa公司,DNA纯化回收、质粒小提试剂盒购自TIANGEN公司。
1.3 病料的采集和处理
无菌采集0.05 g有明显病症的雏鸭肝脏,置于2 mL EP管中,加1 mL无菌双抗生理盐水和两颗灭菌钢珠,置于高容量组织研磨器70 Hz研磨80 s,制成匀浆后冻融3次。置于离心机4 ℃、3000 r·min-1离心30 min,吸取上清于1.5 mL EP管中,4 ℃、12000 r·min-1再离心30 min,取出上清液,用0.22 μm 滤膜过滤,滤液放入-80 ℃冰箱备用。
1.4 病毒分离
取20枚9~10日龄的非免疫樱桃谷鸭胚,分2组,每组10枚,分别用0.2 mL病料和0.2 mL生理盐水接种尿囊腔,接种后置于37 ℃恒温箱中孵化,去除24 h内死亡的鸭胚,收集24~120 h死亡鸭胚的尿囊液并观察鸭胚胎的变化。收集的尿囊液进行连续传代。观察雏鸭致死率。
1.5 血凝试验
分别采取鸭、鸡、小鼠和兔的血液检测病毒尿囊液血凝性,H9N2为阳性对照。血凝试验参照文献[14]的方法。
1.6 动物感染试验
选择非免疫樱桃谷鸭胚孵化的1 d的樱桃谷鸭20只,分为2组,每组10只。一组肌肉注射分离的病毒,每只0.5 mL,另一组肌肉注射生理盐水,每只0.5 mL,分开饲养,观察发病情况。
1.7 病毒RT- PCR鉴定及基因序列测定
1.7.1 引物设计 参照 GenBank 上已发布的DHVI的基因组序列,根据保守序列区设计1对引物,扩增目的片段,预期长度为992 bp。F:5′-TCTGCC ATTTACATCAACCAC- 3′,R:5′-TGCCAACAAC TAAGATAGGTC- 3′,由上海英潍捷基贸易有限公司合成。
1.7.2 病毒RNA提取及反转录 取0.05 g病变肝脏,加入1 mL Trizol及两颗钢珠于2 mL EP管中,置于高通量组织研磨器70 Hz,研磨80 s。取出钢珠,加入200 μL氯仿,振荡15~20 s。4 ℃、12000 r·min-1离心12 min后,吸取上清液至1.5 mL EP管。加入200 μL异丙醇至EP管中,温和颠倒数次后冰上静置20 min,4 ℃、12000 r·min-1离 心10 min,去 除 上清。加75%乙醇(DEPC 配制)1 mL清洗沉淀,4 ℃、7500 r·min-1离心5 min,清洗两次,去除乙醇后,晾干3~5 min,加30~50 μL DEPC水溶解提取物。
反转录采用50 μL体系,即先加入RNA 4 μg、Oligo(dT) 181 μL、DEPC水补至10 μL,反应条件为70 ℃ 5 min,后 加 入10 mmol·L-1dNTP 1.5 μL、5×buffer 10 μL、RRI 1 μL、M-MLV 1 μL、DEPC水26.5 μL,反应条件为42 ℃ 1 h,72 ℃ 15 min。
1.7.3 PCR扩增 以制备好的cDNA 1 μL,加入相应的上、下游引物各1 μL,ddH2O 32.5 μL,5×buffer 10 μL,dNTP(2.5 mmol·L-1) 4 μL,Primer STAR酶0.5 μL,反应体系50 μL。扩增条件为:95 ℃ 5 min,95 ℃ 30 s,Tm-5 ℃ 30 s,72 ℃ 1 kb·min-1,35个循环,72 ℃ 10 min。取PCR产物10 μL,混匀后进行琼脂糖凝胶电泳,使用凝胶成像仪观察目的条带。
1.7.4 全基因测序及同源性分析 将提取的分离病毒的RNA 委托生工生物工程(上海)股份有限公司进行全基因序列测序,将测序结果与GenBank中12株亚洲地区报道的已知DHV-I毒株进行比较分析。
1.8 重组质粒pGEX-4T-1-VP1的构建
1.8.1 引物设计 参照Fujian2015株VP1蛋白基因序列设计引物,并在上游和下游引物分别引入BamH I和SalI酶切位点,预期扩增片段大小为714 bp。具体引物序列如下:F5′-CGCGGATCCATGGGT GATTCCAACCAGTTGGGGGATGATGAG- 3′,R:5′-ACGCGTCGACTCATTCAATTTCCAGATTGAG TTCAAATGCTAG- 3′,由北京擎科新业生物技术有限公司合成。
1.8.2 重组质粒pGEX-4T-1-VP1的构建与鉴定 使用上述引物PCR扩增目的片段并纯化回收,反应体系 为DNA 30 μL,BamH I 1 μL,SalI 1 μL,10×Buffer 5 μL,ddH2O 13 μL的体系,载体DNA≤ 2 μg,BamH I 1 μL,SalI 1 μL,10×Buffer 4 μL,ddH2O 加至40 μL的体系,用BamH I和SalI进行双酶切,混匀后置37 ℃水浴1 h,目的DNA用DNA纯化回收试剂盒进行纯化。将双酶切并纯化后的目的片段和载体按照下述体系进行连接,轻轻混匀后在16 ℃金属浴中连接12~16 h:目的片段8 μL,载体DNA 2 μL,T4 DNA Ligase 1 μL,10×T4 DNA Ligase Buffer 1.5 μL,ddH2O 2.5 μL。将连接产物转化至感受态DH5α后摇菌培养,菌液PCR验证阳性的菌液提取质粒后进行双酶切鉴定,并送北京擎科新业生物技术有限公司进行测序。
1.9 重组蛋白诱导表达、SDS-PAGE电泳鉴定及Western-blotting检测
空载体pGEX-4T-1和重组阳性质粒pGEX-4T-1-VP1转化至感受态BL21(DE3)中,涂板并37 ℃过夜。在含氨苄抗性的LB培养液中接种挑取的单菌落,37 ℃、200 r·min-1培养12 h。将菌液以1∶100的比例接于氨苄抗性的LB液体培养液中,37 ℃培养2~3 h至OD600nm值约0.5时加入终浓度为0.5 mmol·L-1的诱导剂异丙基硫代-B-D-半乳糖苷(IPTG)。4 ℃、8000 r·min-1离心3 min,收集菌体沉淀,用PBS重悬,加入2×loading buffer,煮沸5 min,分别取20 μL样品进行SDS-PAGE电泳观察是否有目的条带,并进行Western-blotting检测。
1.10 重组蛋白抗血清的制备
将重组质粒pGEX-4T-1-VP1经诱导表达后得到重组蛋白GST-VP1,分别进行SDS-PAGE电泳后,切下对应大小位置的目的条带,用于免疫兔子,多克隆抗体的制备由北京金牧阳实验动物养殖有限责任公司协助完成。
2 结果与分析
2.1 病毒分离
注射病料滤液的鸭胚,9枚死亡,1枚活力很微弱。注射生理盐水的鸭胚均存活,且发育正常。正常胚体无出血点(图1-A),肝脏呈黄色,肝细胞排列规则有序,未见明显异常(图1-B);死亡的胚体全身充血,肝脏质地脆、肿大及出血(图1-C)。与正常肝细胞对比,病死鸭胚肝脏出现肝细胞肿大、变性,细胞结构紊乱;炎性细胞(淋巴细胞和中性粒细胞为主)散在浸润(图1-D)。该分离病毒在鸭胚连续传6代后对雏鸭致死率约为70%。

图1 鸭胚肝脏及其HE染色(×200)Fig. 1 Liver tissues with and without HE-staining from duck embryo
2.2 血凝试验
分离病毒在鸭、鸡、小鼠和兔4种血液中均未出现血凝现象,而阳性对照H9N2在鸭、鸡血液中出现血凝现象(图2),表明该分离病毒无血凝性。

图2 分离病毒的血凝性检测Fig. 2 Hemagglutination detection on isolated viruses
2.3 动物感染试验
注射病料研磨液的雏鸭,48 h内死亡率为100%,出现角弓反张,肝脏肿大、质地脆、有明显出血点等病理特征(图3)。

图3 动物感染及其剖检特征Fig. 3 Infection and dissection on animals
2.4 RT-PCR 检测
用设计的DHV-I的引物,对DHV-I标准株和Fujian2015通过RT-PCR进行目的片段扩增。Fujian2015的扩增片段经测序后与NCBI上的DHV-I标准株进行序列对比,证实Fujian2015的扩增片段为DHV-I中的一段基因(图4),根据此结果进行病毒的全基因测序。
图4 DHV-I的PCR鉴定Fig. 4 PCR identification on DHV-I
2.5 DHV-I全基因测序及分析
全基因序列测序后获得该病毒的基因全长为7654 bp,将扩增的病毒全基因序列与NCBI中的DHV序列比对,发现仅能与DHV-I型全基因组序列重合,不能与DHV-Ⅱ型和DHV-Ⅲ型重合,因此确定为I型DHV。将其与12株亚洲地区报道的已知DHV-I毒的进行核苷酸同源性分析,结果如图5所示,该分离病毒核苷酸与毒株DQ226541.1有很高的同源性,高达99.4%。VP1氨基酸序列进化树分析如图6所示,该分离病毒VP1氨基酸序列与其他DHVI的VP1氨基酸序列比较,与毒株DQ226541.1和HQ232303.1亲缘关系较近。运用SnapGene软件将该病毒与12株已知DHV-Ⅰ型病毒的VP1氨基酸序列进行比对分析显示,该毒株的VP1氨基酸序列有3个位点与其他大多数毒株具有一定差异性(表1)。
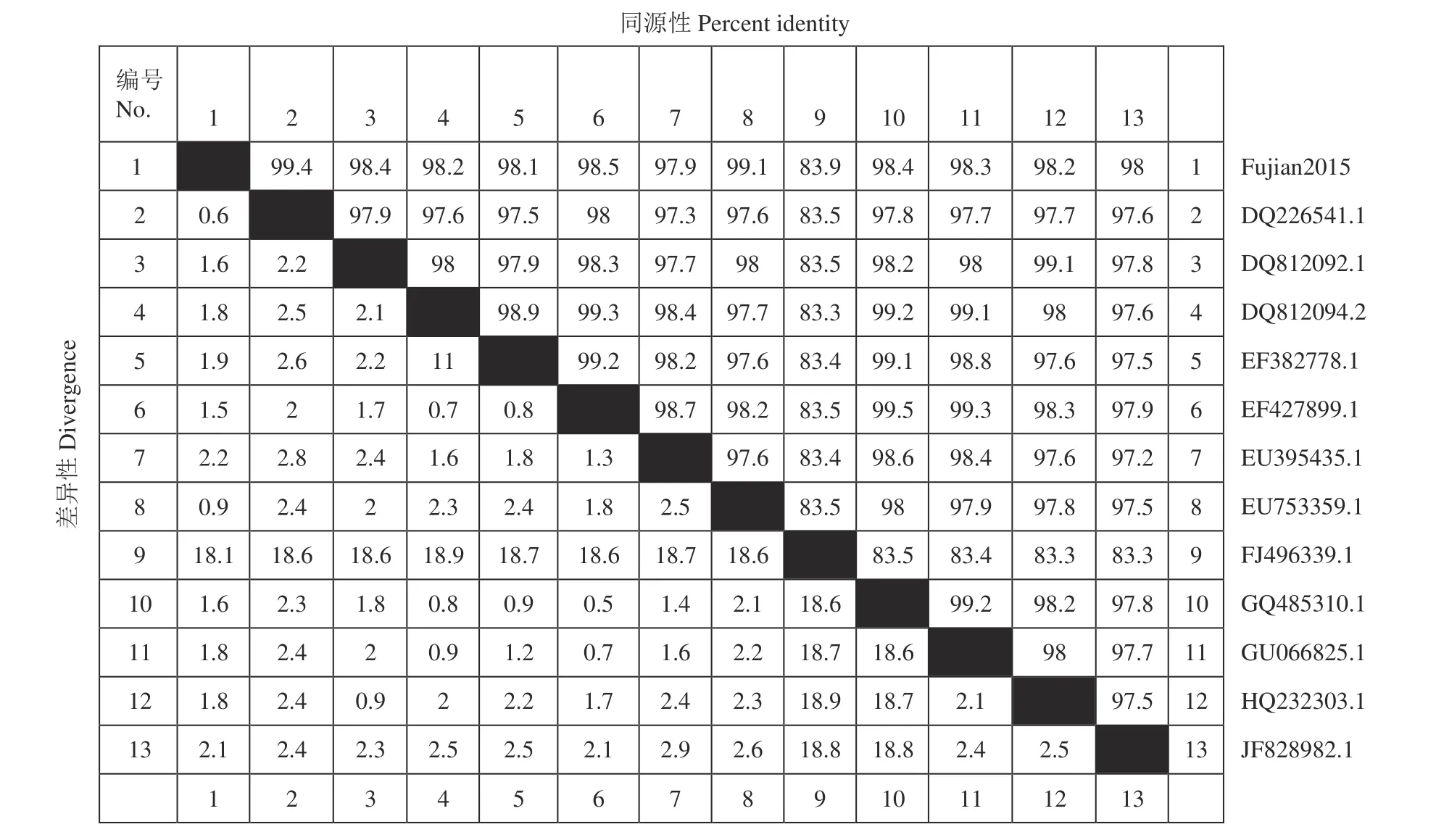
图5 病毒全基因组序列同源性分析Fig. 5 Homology of genome-wide sequences of isolated virus
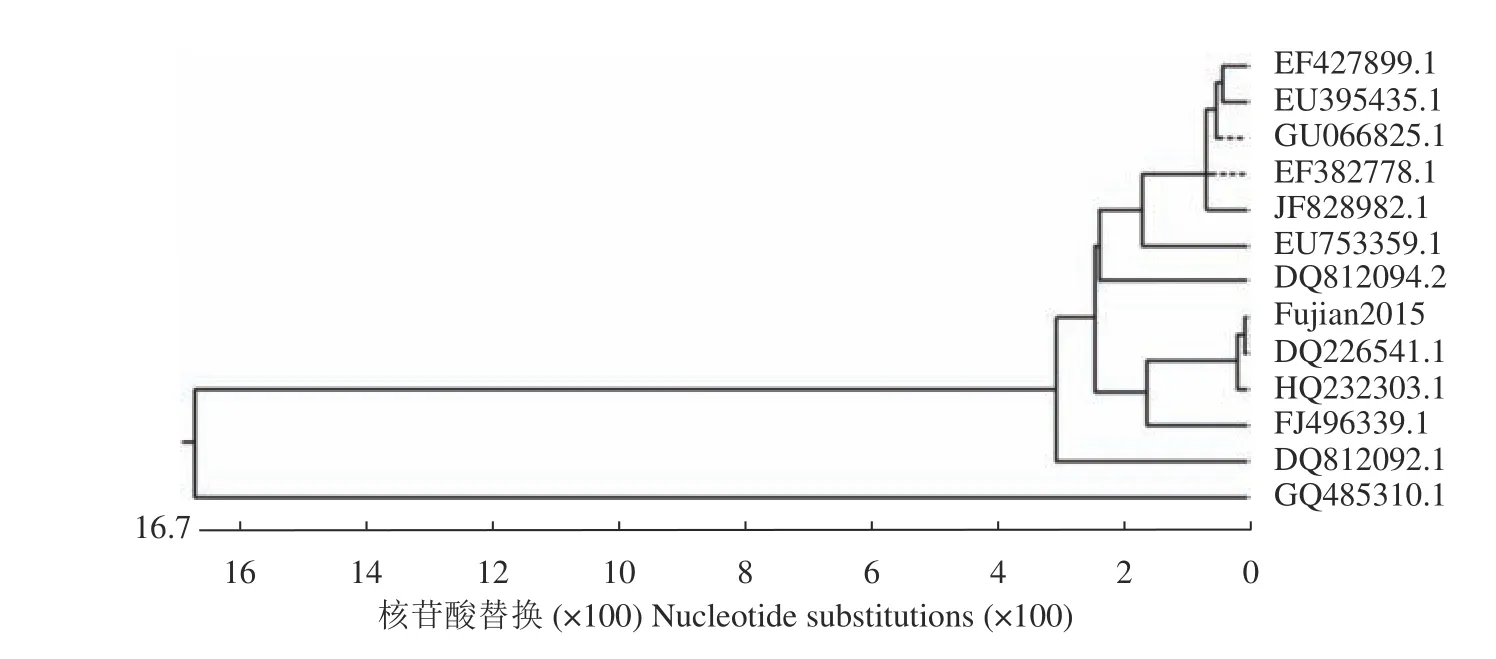
图6 VP1氨基酸序列进化树分析Fig. 6 VP1 amino acid sequence evolutionary trees

表1 分离的病毒与部分DHV毒株的VP1氨基酸序列比对Table 1 VP1 amino acid sequences of isolated and partial DHV viruses
2.6 VP1基因的克隆
用设计的特异性引物进行目的基因的扩增,并通过琼脂糖凝胶电泳检测。在图7中,扩增片段约为700 bp(VP1基因为714 bp),与预期的片段相符。

图7 VP1基因PCR扩增Fig. 7 PCR amplification of VP1
2.7 重组质粒pGEX-4T-1-VP1的构建与酶切鉴定
使用限制性内切酶BamH I和SalI对重组质粒进行双酶切,结果表明重组质粒pGEX-4T-1-VP1构建成功。图8为重组质粒pGEX-4T-1-VP1的双酶切鉴定结果,双酶切后目的片段大小与预期相符(714 bp)。鉴定正确的重组质粒送擎科公司测序。
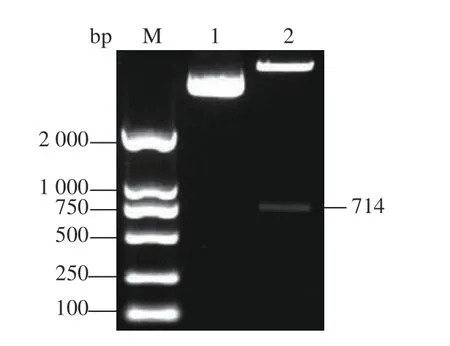
图8 重组质粒pGEX-4T-1-VP1的酶切鉴定Fig. 8 Restriction digestion on recombinant plasmid pGEX-4T-1-VP1
2.8 重组蛋白GST-VP1的诱导表达
重组质粒pGEX-4T-1-VP1表达产物即融合蛋白GST-VP1,是在37 ℃、0.5 mmol·L-1IPTG、180 r·min-1的条件下诱导6 h后获得的。图9中,用SDS-PAGE检测相同条件下空载体pGEX-4T-1诱导前后的表达产物和重组质粒pGEX-4T-1-VP1诱导前后的表达产物,结果显示pGEX-4T-1-VP1诱导后的表达产物出现约52 kDa的条带,与预期相符,融合蛋白GSTVP1诱导表达成功。
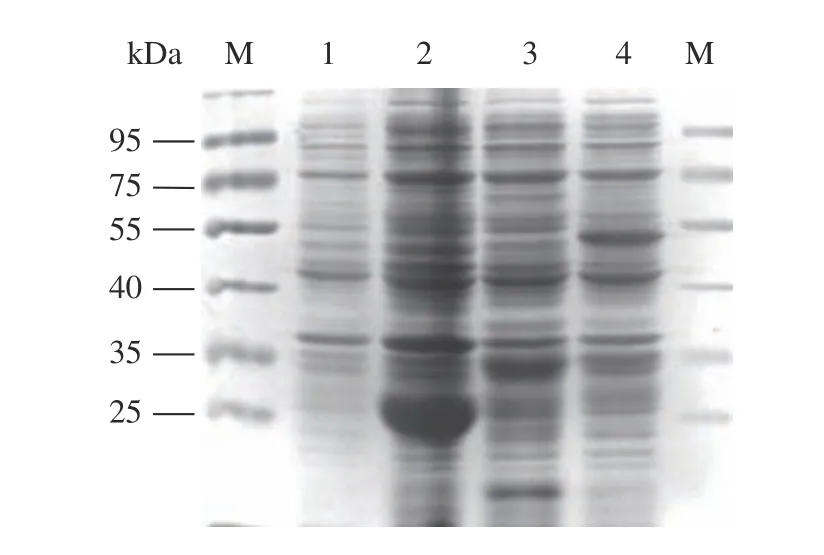
图9 融合蛋白GST-VP1的SDS-PAGE分析Fig. 9 Fusion protein GST-VP1 by SDS-PAGE
2.9 重组蛋白的Western-blotting分析
将诱导后的空载体pGEX-4T-1和重组蛋白GSTVP1进行SDS-PAGE电泳后,转移至NC膜上进行Western-blotting分析,结果(图10)显示融合蛋白GST-VP1可与抗GST标签鼠单克隆抗体发生反应,特异性条带大小约52 kDa,而诱导后的空载体pGEX-4T-1与抗GST标签鼠单克隆抗体发生反应,特异性条带大小约25 kDa,与预期相符。该结果再次验证了融合蛋白GST-VP1表达正确。

图10 融合蛋白GST-VP1的Western-blotting分析Fig. 10 Western-blotting on fusion protein GST-VP1
2.10 制备的VP0和VP1多抗血清的Western-blotting分析
用重组质粒pGEX-4T-1-VP1的表达产物即融合蛋白GST-VP1作为抗原制备兔源多抗血清,将获取的血清稀释后作为一抗与感染鸭肝脏组织蛋白样品和H9N2感染的A549细胞反应,结果表明,多抗血清不与H9N2感染的A549细胞反应,仅与DHV感染的鸭肝脏反应,特异性条带大小约为26 kDa,用NP抗体与相同样本反应,结果显示NP蛋白可与H9N2感染的A549细胞反应(图11),与预期相符,说明制备的VP1多抗血清可特异性识别感染鸭肝脏中DHV表面的VP1抗原。
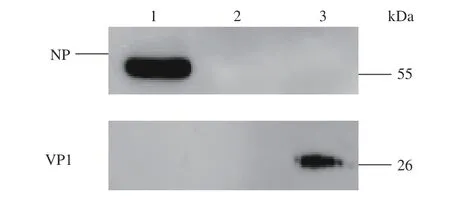
图11 VP1多抗血清的Western-blotting分析Fig. 11 Western-blotting on poly-antiserum against VP1
3 讨论与结论
DVH在我国许多养鸭地区均有不同程度的发生和流行,一旦发病,传播速度快,死亡率高,给我国养殖业造成巨大的经济损失[14]。近年来快速发展的鸭只养殖行业,不断增大的集约化密集养殖力度,DHV-I型暴发日龄的提前和疫情规模的增大等多种因素促使生产上急需有效的防治技术,因此了解DHV-I型的病原性特点和流行规律,研究相应有效的防治技术十分必要[15]。
由于DHV-I型结构蛋白P1位于暴露在外部环境的衣壳表面,易被宿主作为免疫应答靶向蛋白,而其VP1蛋白基因编码了主要的抗原位点,在决定病毒抗原性中发挥重要作用,因此VP1蛋白基因是预防DVH的基因工程苗的重要基因之一[16]。VP1包含多个刺激B和T淋巴细胞诱导反应的中和抗原表位,并诱导体内保护性抗体的产生,可用作检测病毒感染的可靠指标。针对这一特性,可通过检测抗VP1蛋白的血清抗体来监测DHV-I的中和抗体水平[17]。
本试验对一养殖场发生的疑似DVH的病鸭进行了病毒分离鉴定、全基因测序并分析了其血清型,为补充DHV的基因库及研究DVH的流行规律提供一定的理论依据。目前针对DHV-I的检测方法主要有RT-PCR、酶联免疫吸附试验和中和试验。本研究使用的检测方法为RT-PCR扩增基因序列,与酶联免疫吸附试验和中和试验相比,本试验采用的方法更加稳定,而且可以确定毒株来源。本研究成功构建了重组质粒pGEX- 4T-1-VP1,并建立了融合蛋白GST-VP1的高效表达体系。经SDS-PAGE和Westernblotting检测,表达的融合蛋白GST-VP1以包涵体的形式存在,蛋白分子量约为52 kDa。用该蛋白制备兔源多抗血清,Western-blotting检测结果显示VP1多抗血清能够特异性地识别病毒的VP1蛋白,证实了VP1蛋白具有良好的抗原性,说明了VP1多抗血清可用于VP1蛋白表达的特异性检测,可作为病原学诊断的有效补充,为鸭肝炎疫病的防控提供参考[18]。
