酶水解法在大曲淀粉检测上的应用研究
2022-01-07王军凯王卫东代利平黄祖耀
王军凯,王卫东,蒋 明,代利平,黄祖耀
(江苏洋河酒厂股份有限公司,江苏宿迁 223700)
淀粉是一种高分子碳水化合物,是由葡萄糖聚合而成的多糖。在酿酒生产中,淀粉质粮食是重要的酿酒原料。作为酿酒生产的糖化发酵剂,大曲以大麦、小麦等为原料,粉碎后由人工控制适当的水分、温度、疏松度等条件来选择、富集有益微生物培育而成[1]。大曲的淀粉含量反映了大曲发酵的成熟程度,是评判大曲质量好坏的一个重要指标[2]。传统的淀粉含量检测方法为酸水解法。酸水解法检测淀粉含量需用强酸作催化剂,检测过程中还需用强碱中和多余的酸。在水解过程中,强酸会使半纤维素等一些非淀粉多糖水解为还原糖。因此,酸水解法更适用于淀粉含量较高的样品[3]。
糖化酶,又称葡萄糖淀粉酶,是一种单链酸性糖苷键水解酶,在发酵过程中通过水解糖苷键将淀粉逐步降解为葡萄糖,具有性能稳定、水解安全的优点[4-6]。根据糖化酶的水解原理,本研究通过对比大曲淀粉经酸水解和酶水解后的结果发现,酶水解法检测大曲淀粉含量操作简单,结果可靠,避免了强碱强酸的使用,可应用于大曲淀粉的日常检测。
1 材料与方法
1.1 材料、试剂及仪器
原料:大曲为酿酒车间使用曲,糖化酶(10万U/g)由无锡市雪酶酶制剂科技有限公司提供。
试剂及耗材:斐林氏甲液、乙液、1 g/L 葡萄糖标准溶液、20 %(V/V)盐酸溶液、20 %(W/V)氢氧化钠溶液、可溶性淀粉。所用化学药品均为分析纯,均由国药集团化学试剂有限公司提供。
仪器设备:TCS-100 型标准COD 消解器、分析天平、三角瓶、容量瓶、量筒、电炉、酸式滴定管。
1.2 酸水解法
1.2.1 检测原理
淀粉在强酸和高温作用下,葡萄糖苷链裂解,生成不同分子量的糖类聚合物,最终生成葡萄糖。酸水解后的溶液用碱中和至微酸性,按斐林氏法测定还原糖含量,最后折算为淀粉含量。
1.2.2 检测步骤
1.2.2.1 试样酸水解
准确称取大曲样品5.0 g 于250 mL 三角瓶中,加入20 %盐酸溶液100 mL,将三角瓶放于消解器中高温消解2 h。消解完成后取出三角瓶并冷却,用20 %的氢氧化钠溶液中和至微酸性(pH 试纸验证),脱脂棉过滤至500 mL 容量瓶,滤液摇匀并定容。
1.2.2.2 试样测定
空白试验:准确吸取斐林氏甲液、乙液各5.0 mL于100 mL 三角瓶中,预先向三角瓶内加入葡萄糖标准溶液9.0 mL左右,混合均匀后将三角瓶放于电炉上加热,沸腾后,缓慢滴入葡萄糖标准溶液,待三角瓶内蓝色消失,记录空白试验消耗葡萄糖标准溶液量。
样品试验:样品预滴定:准确吸取甲液、乙液各5.0 mL 以及1.0 mL 样品滤液于100 mL 三角瓶中,混合均匀后将三角瓶放于电炉上加热,沸腾后,缓慢滴入葡萄糖标准溶液,待三角瓶内蓝色消失,记录葡萄糖标准溶液消耗量;样品滴定:准确吸取甲液、乙液各5.0 mL 以及1.0 mL 样品滤液于100 mL三角瓶中,预先加入比预滴定少1.0 mL左右的葡萄糖标准溶液,混合均匀后将三角瓶放于电炉上加热,沸腾后,缓慢滴入葡萄糖标准溶液,待三角瓶内蓝色消失,记录样品试验消耗葡萄糖标准溶液量。计算:
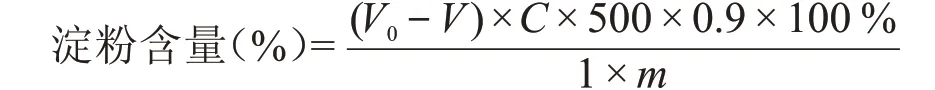
式中:V0——空白试验消耗葡萄糖标准溶液量,mL;
V——样品试验消耗葡萄糖标准溶液量,mL;
C——葡萄糖标准溶液的浓度,g/L;
500——样品滤液定容体积,mL;
1——滴定时溶液的取样量,mL;
0.9——葡萄糖换算成淀粉的系数;
m——试样质量,g。
1.3 酶水解法
1.3.1 检测原理
糖化酶为糖苷键水解酶,在其最适反应条件下,促使淀粉中的糖苷键断裂,最终生成葡萄糖。本试验所使用的糖化酶由黑曲霉优良菌种经深层发酵精制而成,在其最适反应条件下,能将淀粉逐步水解转化为葡萄糖,糖化效率高。为加速淀粉糖化,首先对淀粉进行加热糊化,当淀粉糊化完全时,淀粉天然的半结晶结构完全转变为无定型结构,此时淀粉更易被糖化酶水解。酶水解完成后,按斐林氏法测定还原糖含量,最后折算为淀粉含量。
1.3.2 检测步骤
1.3.2.1 试样酶水解
准确称取大曲样品5.0 g 于250 mL 三角瓶中,加入蒸馏水100 mL。样品前处理采用高温加热,加快淀粉降解。待大曲溶液冷却后,加入适量糖化酶(使用量按产品使用说明添加),将三角瓶放于恒温水浴锅中,调节水温至糖化酶的最适反应温度进行糖化(大曲溶液pH 值接近于糖化酶的反应pH 值)。糖化完成后(碘液验证),脱脂棉过滤至500 mL容量瓶,滤液摇匀并定容。
1.3.2.2 试样测定
操作步骤同1.2.2.2。
2 结果与分析
为了比较两种方法检测大曲淀粉结果的精密度和准确度,将大曲样品平均分成6 份,即为样品1、样品2……样品6。采用两种方法分别检测,每个样品检测2 次,并以各组数据的算术平均值作为样品的真实值。检测结果如表1所示。

表1 大曲淀粉检测结果对比表 (%)
2.1 精密度的比较
精密度反映了重复检测样品时检测结果的重现性,常用相对标准偏差来反映精密度的高低。相对标准偏差越小,说明重复检测结果间的误差越小。两种方法检测6 个样品结果的绝对偏差如图1所示。
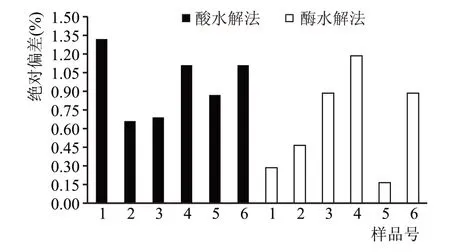
图1 大曲淀粉检测结果绝对偏差对比图
由图1 可以看出,酶水解法检测结果的绝对偏差低于酸水解法。其中酸水解法的相对标准偏差为1.83 %,酶水解法的相对标准偏差为1.38 %,说明酶水解法的精密度高于酸水解法。
2.2 准确度的比较
准确度是反映检测结果接近于真实值的程度,常用相对误差来表示准确度的高低。相对误差越小,说明检测结果越接近于真实值。两种方法检测6个样品结果的相对误差如图2所示。
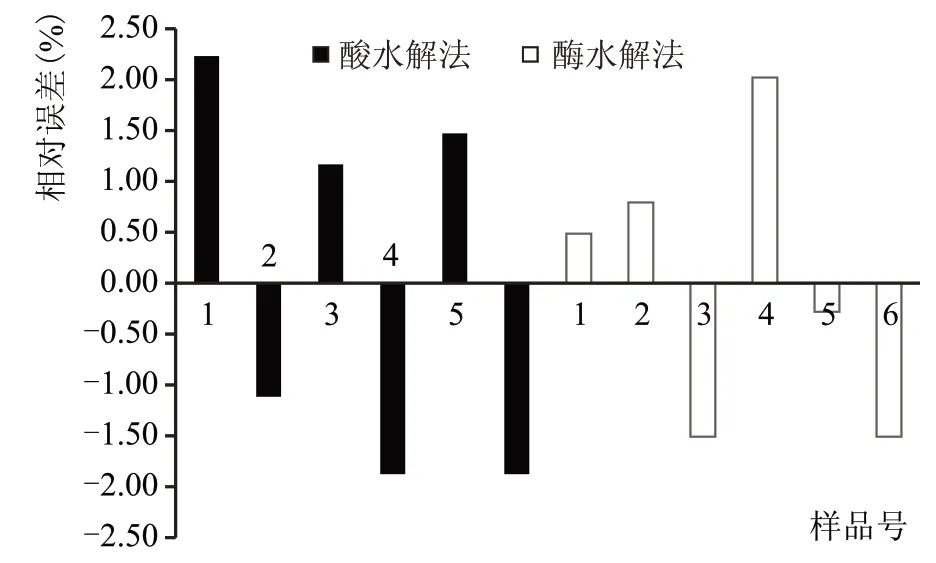
图2 大曲淀粉检测结果相对误差对比图
由图2 可以看出,酶水解法检测的6 组数据的相对误差比酸水解法低,说明酶水解法的准确度要高于酸水解法。
2.3 加标回收试验验证
为进一步考察酶水解法的准确性,随机选取3个大曲样品,分别加入不等量的可溶性淀粉(烘干至恒重)做加标回收试验。试验结果如表2所示。
由表2 可以看出,酶水解法检测结果的平均回收率为93.94%±1.12%,表明此方法检测大曲淀粉含量的准确性较高。

表2 大曲淀粉回收结果对比表
2.4 实用性验证
由表1 可知,酸水解法测定的淀粉含量为59.16 %±1.08 %,酶水解法测定的淀粉含量为58.67 %±0.81 %,相差为0.49 %。为分析酶水解法与酸水解法在检测时产生的误差是由偶然因素引起或是系统因素引起的,随机选取10 个样品,采用两种方法分别检测,检测结果如图3所示。
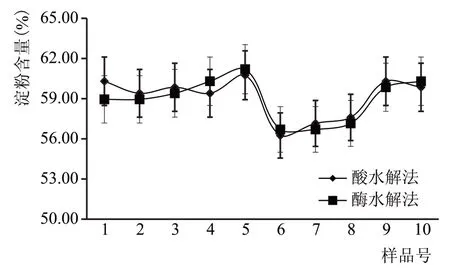
图3 大曲淀粉检测结果对比图
由图3 可以看出,酶水解法检测结果与酸水解法检测结果的误差没有规律性。为考察两种方法检测结果之间误差的显著性,采用MINITAB 软件对10 组数据进行差异显著性分析。结果如表3所示。
从表3 可以看出,在0.05 水平上,两种方法差值的显著性结果P 值为0.541,大于0.05,表明两种方法检测结果的差异性并不显著,产生的误差不是由方法本身带来的。说明酶水解法检测大曲淀粉含量可以用于实际生产上的检测应用。
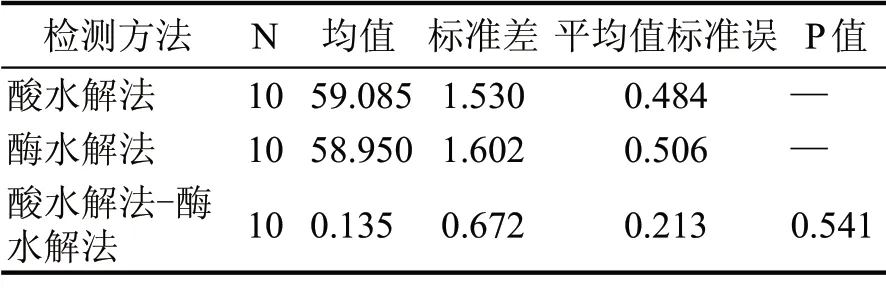
表3 差异显著性分析结果
3 结论
通过对酸水解法和酶水解法在大曲淀粉检测结果对比可以看出,在检测精密度上,酶水解法的相对标准偏差小于酸水解法,检测结果再现性更好;在检测准确度上,酶水解法相对误差小于酸水解法。两种方法检测结果的差异性并不显著,酶水解法不存在系统误差。在实际生产中,酶水解法避免了强酸强碱的使用,符合现代环保检测的要求,在检测大曲淀粉含量应用上具有重要的实用意义。
