银镜反应和后续处理的实验改进
2015-06-18王秀阁
王秀阁
摘要:针对银镜反应水浴加热温度不易掌控、装置较复杂、银单质在试管内壁上附着不均匀、实验结束后用硝酸清洗银单质易产生有毒气体等缺点,进行了实验探究。改进实验采用正交试验法得到不需要加热的银镜反应实验最佳条件,以及用氯化铁溶液或双氧水处理银镜的新方法,具有方便快捷,操作安全,产物无毒害等优点。
关键词:银镜反应;实验改进;优化;后处理
文章编号:1005–6629(2015)4–0057–04 中图分类号:G633.8 文献标识码:B
银镜反应是醛类有机物的典型性质,把它作为演示实验用于课堂教学可激发学生学习化学的激情,加深对醛基性质的理解。如何控制银镜反应的实验条件,使之在短短的1分钟之内无需加热而显现实验现象,以及绿色化处理反应后残留在试管内壁上的银等问题,应引起我们一线教师与学生重视。
1 银镜实验的最佳反应条件探讨
1.1 实验原理
2%硝酸银溶液:用天平称取1g AgNO3粉末并加49mL蒸馏水溶解,转入试剂瓶中保存。
2%氨水:取10mL浓氨水于烧杯中,加入130mL蒸馏水稀释得到2%氨水溶液,转入试剂瓶中保存。
20%氢氧化钠溶液:称取10g NaOH固体,加40mL蒸馏水溶解,转入试剂瓶中保存。
4%葡萄糖溶液:称取2g葡萄糖粉末,加48mL蒸馏水溶解,转入试剂瓶中保存。
1.3 实验过程
从制约银镜反应实验的条件出发[1],针对银镜反应的主要影响因素,设置不同水平,采用三因素三水平进行试验,见表1。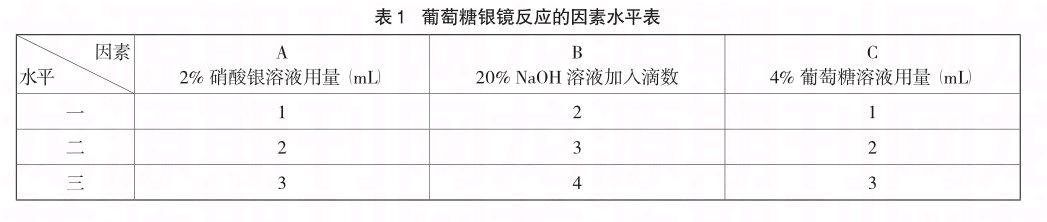
设置三因素三水平的正交试验表进行实验。实验时,先在洁净的试管里加入正交试验表中所需用量的2%硝酸银溶液,同时滴加2%的稀氨水,边滴边振荡试管,直到析出的沉淀恰好溶解(制得澄清的银氨溶液),向盛有银氨溶液的试管中滴入正交试验所需用量的4%葡萄糖溶液和NaOH溶液,迅速用pH试纸测量此时溶液的pH并记录。塞上胶塞,剧烈振荡试管1min,观察到试管内壁有光亮的银镜产生,对银镜进行评分并记录。
生成银镜的外观评分标准说明如下。生成大量银,银镜均匀,银层较厚致密,效果最佳,记录90~100分;生成较多的银,银镜较均匀,效果较好,记录80~90分;生成较少的银,且不均匀,有部分斑点或浑浊,效果较差,记录70~80分;生成极少的银,且非常不均匀,大部分黑点或浑浊,效果差,记录60~70分。银镜反应的正交试验及结果见表2。
1.4 实验效果描述
根据正交试验表进行9组实验,实验过程中观察到的实验效果描述如表3。
1.5 实验结论
传统方法采用水浴加热时保持试管静置,生成的银镜仅能覆盖溶液浸润的部分(约为试管高度的1/5),并且需要使用控温水浴装置,装置繁琐,不适于课堂演示实验。改进方法不需要加热,只需适量氨水、2%硝酸银溶液3mL、20% NaOH溶液4滴、4%葡萄糖溶液1mL,通过快速上下垂直振荡橡胶塞塞紧的试管,以便增加反应熵变化,加快反应速度,达到水浴加热的作用,同时由于垂直振荡还可以使溶液浸润整个试管内壁,整个试管均有光亮的银镜产生,实验效果更为直观,更能激发学生学习兴趣,增强学习效果。
2 银镜实验后试管清洗的探究
2.1 H2O2处理法
H2O2是常见的氧化剂,且生成的还原产物无污染,查标准电极电势表[2]可知,H2O2在酸性条件下氧化性比Ag+强,猜测可以用双氧水处理试管内壁上的银单质,反应后产物是什么?带着这样的疑问进行下列实验。
取15mL 10%的双氧水倒入附着银单质的试管中,试管壁上的银单质与双氧水剧烈反应并逐渐溶解,产生大量气泡,反应一会儿,将带火星的木条置于试管口,带火星的木条复燃。
为了说明反应产物,取上述反应后的反应液1mL装入干净试管并稀释到3mL,向试管中加入稀盐酸酸化的KI溶液,发现溶液呈现黄色,无黄色沉淀产生;再加入1mL苯,振荡后静置,出现分层现象且上层为紫红色,下层为灰黑色浑浊,过滤下层液体可得到银单质,做完银镜实验的试管被洗刷干净。查阅资料可知[3],其反应按两步进行:2Ag+H2O2=Ag2O+H2O;Ag2O+H2O2=2Ag+H2O+ O2,由此实验可知银在H2O2分解反应中起催化剂的作用。
双氧水和硝酸均可将附着有银单质的试管洗涤干净,洗涤效果有没有区别呢?取上述正交法中形成的较为致密的银的7、8、9组实验的试管,分别向三只试管中加入10mL 10%的双氧水,10mL 3 mol/L的稀硝酸溶液和10mL 6 mol/L的稀硝酸溶液。振荡试管,发现将银镜清洗干净所用的时间不同,双氧水明显快于3 mol/L稀硝酸,但比6 mol/L稀硝酸所需时间长一些;用硝酸清洗过程中会有刺激性气味的气体放出,实验者的实验体验不佳,影响实验情绪。
2.2 FeCl3处理法
将新配制的6 mol/L FeCl3溶液约2mL加入附着有银的试管中,振荡试管,发现美丽光亮的银镜快速变暗成灰色并逐渐溶解,溶液中出现许多脱落下来的灰黑色悬浊物,氯化铁溶液的黄色逐渐变浅,只需将试管振荡3~5次,银镜迅速被清洗干净。
用氯化铁溶液清洗附着有银单质的试管可知,金属活动性顺序得到的氧化性强弱是根据金属与其在水溶液中形成低价态离子构成电极反应的标准电极电势由小到大排列,即Ag+/Ag的标准电极电势0.80V,Fe3+/Fe2+是0.77V,仅从热力学的角度指出了标准状态下氧化还原反应进行的可能性及趋势大小,而实际的金属活泼性会因浓度、介质、气体的分压、产物的溶解度、氧化膜等因素而改变。
2.3 结论
用H2O2或者氯化铁都可以快速处理银镜实验后附着有银单质的试管,并且反应过程中只产生氧气无其他有毒气体产生,不会损害实验者的身体健康,也不会造成环境污染。过氧化氢溶液处理银镜的过程中银扮演了催化剂的角色,生成了细碎的银单质而从试管壁上脱落,易集中回收利用,节约资源。氯化铁溶液处理银镜还有利于学生发散性思维能力的培养和激发学生探究知识的好奇心。
3 实验成功的关键
银镜实验成败的关键操作有三:试管要洁净,否则,只得到黑色疏松的银沉淀,没有银镜产生或产生的银镜不光亮;溶液混合后,振荡要充分,特别是加入最后一种溶液后,振荡要快,否则会出现黑斑或产生银镜不均匀;加入的氨水要适量,氨水的浓度不能太大,滴加氨水的速度一定要缓慢,否则氨水容易过量降低试剂的灵敏度。另外,如果滴加氢氧化钠过量,反应速率太快,产生的银镜会发黑。
参考文献:
[1]刘云忠,刘学柱.也谈银镜反应实验成败的关键[J].化学教学,1991,(6):23.
[2]汪小兰等.基础化学[M].北京:高等教育出版社,2008:498.
[3]陈寿椿.重要无机化学反应[M].上海:上海科技出版社,2011:47.
