人参皂苷CK 对肺动脉平滑肌细胞迁移和胶原沉积的作用
2022-01-06刘桃朱路李刚贾鹏谢亮刘瀚旻刘斌
刘桃,朱路,李刚,贾鹏,谢亮,刘瀚旻,刘斌
肺动脉高压( PAH)是一种以进行性肺血管压力逐渐升高为特征,最终导致右心衰竭的致死性疾病[1-2]。PAH 以肺血管重构为主要的病理特征,包括肺小动脉中膜层的肺动脉平滑肌细胞(PASMC)的广泛增生、迁移和细胞外胶原蛋白的过度沉积[3]。血小板衍生生长因子-BB ( PDGF-BB)作为一种在PAH 进展中发挥关键作用的生长因子,在促进PASMC 增殖、迁移和胶原沉积中起着重要作用[4-5]。同时Wnt/β-连环蛋白(β-catenin)信号通路广泛参与了PDGF-BB 的诱导平滑肌细胞增殖、迁移以及胶原沉积的过程[6]。
人参皂苷CK (ginsenoside compound K, CK)是从人参中提取和分解出来的一种活性物质。在增殖性疾病等研究中发现,CK 在抑制肿瘤增殖和迁移中发挥着显著的作用[7-8]。近年来研究认为,PAH是一种血管壁准恶性生长的疾病,PASMC 的生长呈现类肿瘤化的特点[9-10]。然而CK 是否存在对PASMC 的增殖和迁移作用目前尚不可知。本实验采用PDGF-BB 诱导的体外PASMC 增殖、迁移以及细胞外胶原沉积,用CK 作为干预药物进行干预,来探讨CK 在PAH 中可能存在的相关作用以及相应的机制。以此为PAH 疾病在治疗方面提供新的研究基础。
1 材料与方法
1.1 材料
SD 大鼠(成都达硕生物科技有限公司);胎牛血清(FBS)、DMEM 培养基、F12 培养基、胰蛋白酶、青/链霉素(美国Gibco 公司);PDGF-BB(美国R&D 公司);CK(美国sigma 公司);CCK-8 试剂盒(日本同仁化学);大鼠Ⅰ型胶原蛋白(COL Ⅰ)和Ⅲ型胶原蛋白(COL Ⅲ)α1 链酶联免疫吸附(ELISA)试剂盒(武汉科鹿生物科技有限公司);COL Ⅰ、COL Ⅲ和甘油醛-3-磷酸脱氢酶(GAPDH)引物(成都生工生物工程有限公司);Trizol(美国Thermo 公司);互补DNA(cDNA)合成试剂盒(美国Roche 公司);GoTaq®qPCR Master Mix 荧光定量试剂盒(美国Promega 公司);兔抗大鼠COL Ⅰ、β-catenin、GAPDH 单克隆抗体,小鼠抗大鼠COL Ⅲ单克隆抗体(美国Abcam 公司);RIPA 裂解液、BCA 蛋白浓度试剂盒(上海碧云天生物技术有限公司)。
1.2 实验方法
1.2.1 SD 大鼠PASMC 的原代培养、鉴定和分组
大鼠PASMC 的原代细胞培养与鉴定方法参考罗燕等[11]的文献。取5 周龄、体重150~180 g 的健康雄性SD 大鼠,通过颈椎脱臼方法处死,无菌环境下分离肺动脉中膜层,并剪碎成1 mm3左右的组织块平铺于培养瓶瓶底,采用组织块贴壁法培养PASMC,培养基为20%FBS 的DMEM/F12 培养液,置于37℃、5%二氧化碳(CO2)的培养箱中。随后传代换用含10%FBS 的培养液。根据细胞学形态以及免疫荧光检测血管平滑肌特异性细胞表型标志基因α-肌动蛋白(α-SMA)来对第二代细胞进行鉴定。实验用鉴定合格且生长较好的3~6 代细胞。实验共分为三组:对照组(仅加基础培养基)、模型组(给予PDGF-BB 20 mg/L)和干预组(给予PDGF-BB 20 mg/L 和CK 5 μmol/L),每个实验独立重复3 次即n=3。PDGF-BB 的剂量参考以往文献以及前期预实验[6,12],CK 剂量见下文1.2.2 实验结果,选择无细胞毒性且抑制增殖效果最佳的5 μmol/L 浓度。
1.2.2 CCK-8 法检测PASMC 增殖情况
细胞增殖情况采用CCK-8 法。将PASMC 密度调整为3×104/ml,接种于96 孔板中(每孔100 μl),每组设5 个复孔。待细胞密度至70%时,换成无血清DMEM/F12 培养液培养24 h。按照分组进行培养24 h 后,每孔加入10 μl 的CCK-8 溶液,于培养箱内孵育2 h。用酶标仪测量450 nm 处的吸光度(OD)值。
1.2.3 细胞划痕实验检测PASMC 迁移情况
细胞迁移情况采用细胞划痕实验。预先准备6 孔板,底部直线标记。将PASMC 密度调整为5×104/ml,接种于6 孔板(每孔2 ml),每组设3 个复孔。待细胞生长至70%,用1 ml 枪头于每孔底部进行划痕,保证每孔划痕宽度一致,用磷酸盐缓冲液(PBS)轻柔冲刷划痕处脱落细胞。按照分组进行培养,分别在0 h、12 h 和24 h 时倒置相差显微镜下观察划痕宽度、采集图像,并计算迁移率:

1.2.4 ELISA 法检测PASMC 培养液中COL Ⅰ和COLⅢ的含量
细胞培养液中胶原含量检测采用ELISA 法。将PASMC 密度调整为3×104/ml,接种于96 孔板中(每孔100 μl),每组设3 个复孔。待细胞密度至70%时,按照分组进行培养24 h。收集各组细胞培养液,于4℃下2 000 g 离心10 min,取上清液进行实验。参照大鼠COL Ⅰ和COL Ⅲ α1 链ELISA 试剂盒操作说明进行。用酶标仪测量450 nm 处的OD 值,所测得的OD 值间接代表培养液中胶原蛋白含量。
1.2.5 实时荧光定量PCR (RT-qPCR)检测PASMC 中COL Ⅰ和COL Ⅲ基因转录水平
细胞基因转录水平采用RT-qPCR 法。将PASMC以密度5×104/ml 接种在6 孔板中(每孔2 ml)。待细胞生长至70%融合,按照实验分组培养,每组设3个复孔。用TRIzol 法提取总RNA,用cDNA 合成试剂盒逆合成为cDNA。使用GoTaq®qPCR Master Mix荧光定量试剂盒和CFX96 TouchTM Detection System仪器(Bio-Rad,美国)检测信使RNA的相对表达水平。自行设计引物序列见表1,扩增基因包括COL Ⅰ α1(NM_031004)、COL Ⅲ α1(NM_032085)和内参基因GAPDH(NM_0177008)。反应条件:预变性95℃,3 min;循环40 次,变性95℃ 10 s,退火58℃ 30 s,延伸72℃ 30 s。结果用2-ΔΔCt法计算mRNA 的相对表达量。

表1 引物序列
1.2.6 蛋白免疫印迹(Western blot)检测PASMC 中COL Ⅰ、COL Ⅲ和β-catenin 蛋白的相对表达
细胞蛋白合成水平采用western blot 法。将PASMC 以密度5×104/ml 接种在6 孔板中。待密度达70%,按照实验分组培养。用RIPA 裂解液提取总蛋白。BCA 试剂盒测定蛋白浓度后,取40 μg的蛋白样品进行凝胶电泳分离。电泳完成后,将蛋白转膜至聚偏氟乙烯膜。用5%脱脂牛奶封闭1 h,于4℃过夜孵育相应抗体:COL Ⅰ (1 ∶500)、COLⅢ (1 ∶500)、β-catenin (1 ∶2 000) 和GAPDH(1 ∶500)。洗膜后室温孵育相应荧光二抗,稀释比例均为1 ∶10 000。孵育完毕后双色红外激光成像系统(odyeesy 公司,美国)进行检测,Image J 软件测定各条带的灰度值。结果以各条带灰度值与GAPDH 灰度值的比值表示。
1.3 统计学方法
统计分析采用SPSS 22.0 统计软件进行。符合正态分布的数据以均数±标准差(±s)表示,采用单因素方差分析,应用SNK-q 检验来进行组间两两比较,P<0.05 为差异有统计学意义。
2 结果
2.1 SD 大鼠PASMC 原代细胞培养及鉴定(图1A、1B)
培养至7 d 左右可见大量细胞从组织块边缘萌出呈放射状。传代后细胞形态呈长梭形(图1A)。免疫荧光进行α-SMA 染色,可见阳性染色呈束状,与细胞长轴平行(图1B)。阳性染色细胞达95%以上,表明该细胞为PASMC。

图1 传代细胞镜下观察(1A,×100)及免疫荧光α-肌动蛋白染色鉴定(1B,×200)
2.2 三组PASMC 增殖情况
细胞增殖情况采用CCK-8 法进行检测。OD值:与对照组比较,模型组显著升高(1.288±0.192 vs. 0.776±0.201,P<0.01),与 模 型 组 比 较,干预组(0.989±0.231)显著降低,三组比较差异均有 统 计 学 意 义(F=550.262,P均<0.01)。且 当CK 以5 μmol/L 浓度单独处理PASMC 时其OD 值(0.758±0.147),与对照组比较差异无统计学意义(P>0.05)。提示PDGF-BB 能明显诱导PASMC 的增殖,而CK 能以非细胞毒性浓度显著抑制PDGFBB 的诱导作用。
2.3 三组PASMC 迁移情况(图2、图3)

图2 细胞划痕实验观察肺动脉平滑肌细胞迁移情况(n=3,×40)

图3 三组PASMC12 h 和24 h 迁移率比较 (x±s, n=3)
细胞迁移情况采用细胞划痕实验检测。与对照组比较,模型组PASMC 在12 h、24 h 的迁移率[(37% vs. 26%)、(68% vs. 51%)]均呈显著升高,差异有统计学意义(P<0.01);与模型组比较,干预组PASMC 在12 h、24 h 的迁移率降低[(16% vs.37%)、(48% vs. 68%)],细胞迁移明显受到抑制,差异均有统计学意义(P均<0.01)。这说明,CK 能显著抑制PDGF-BB 诱导的PASMC 的迁移。
2.4 三组PASMC 培养液中COL Ⅰ和COL Ⅲ的蛋白含量(图4)
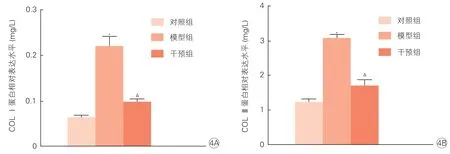
图4 三组COL Ⅰ (4A)和COL Ⅲ (4B)蛋白含量比较 (x±s, n=3)
与对照组比较,模型组中COL Ⅰ蛋白含量升高约3.5 倍,COL Ⅲ蛋白含量升高2.5 倍,差异有统计学意义(P<0.01);与模型组比较,干预组中COL Ⅰ蛋白含量减少了45%,COL Ⅲ 减少了56%,差异均有统计学意义(P<0.01)。这表明CK 能抑制PASMC分泌COL Ⅰ和COL Ⅲ。
2.5 三组PASMC 中COL Ⅰ和COL Ⅲ的信使RNA 相对表达量(图5)

图5 三组COL Ⅰ和COL Ⅲ 信使RNA 相对表达水平比较 (x±s, n=3)
与对照组比较,模型组中COL Ⅰ和COL Ⅲ信使RNA 表达水平明显升高(P<0.01);与模型组比较,干预组中COL Ⅰ和COL Ⅲ信使RNA 表达明显降低(P均<0.01),差异均有统计学意义。
2.6 三组PASMC 中COL Ⅰ、COL Ⅲ和β-catenin蛋白相对表达量(图6)
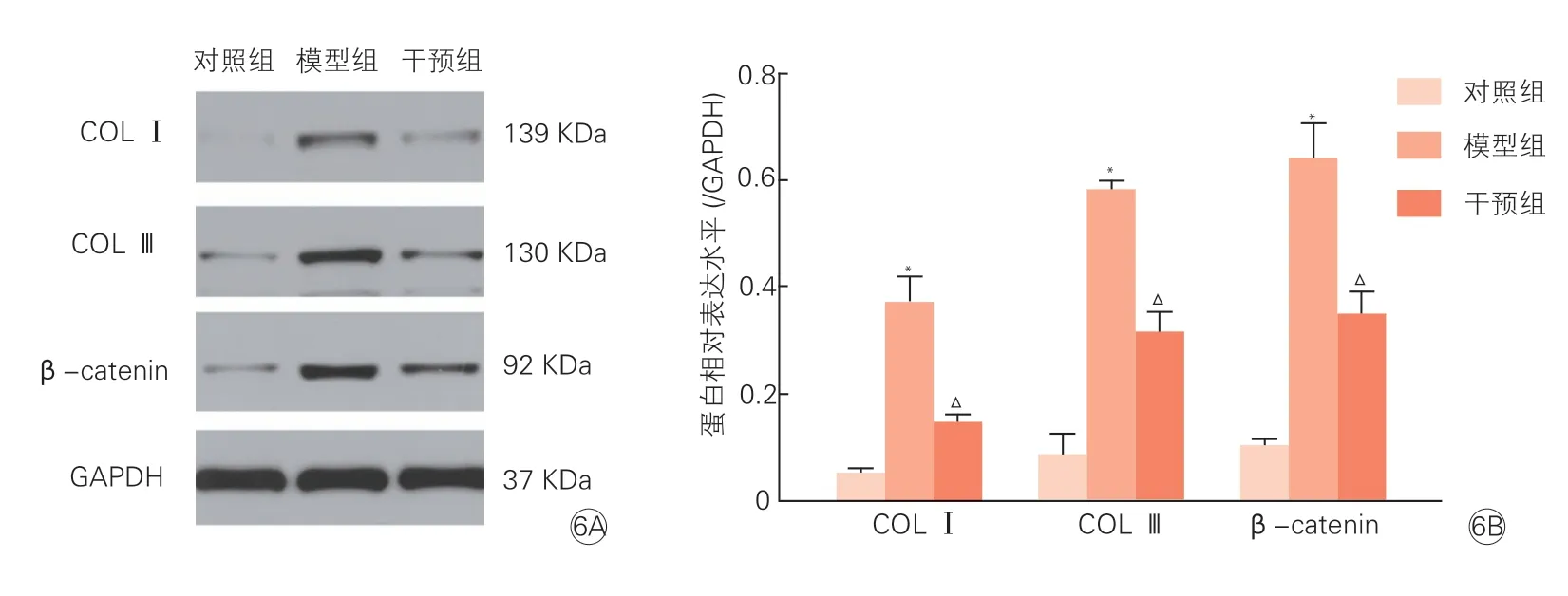
图6 三组COL Ⅰ、COL Ⅲ和β-catenin 蛋白电泳图(6A)及其相对表达水平(6B)比较 (x±s, n=3)
与对照组比较,模型组中COL Ⅰ、COL Ⅲ和β-catenin 蛋白相对表达量均显著升高(P<0.01);与模型组比较,干预组中COL Ⅰ、COL Ⅲ和β-catenin蛋白相对表达量均显著降低(P均<0.01)。
3 讨论
CK 是从人参中提取经过细菌代谢转化而来的一种活性物质[13]。在一系列体内体外研究中发现,CK 可通过多种信号途径对增殖性疾病有积极作用,尤其是对各种肿瘤细胞的增殖、凋亡以及迁移产生显著的影响[8,14-15]。然而CK 是否存在对PASMC 增殖和迁移的作用尚不可知。
PAH 是一种以肺血管重构为病理特征的难治性疾病。各种因素导致的肺血管重构从而引起肺动脉进行性缩窄和压力增高,以远端的肺小动脉为主。肺小动脉壁的所有血管层(包括内膜、中膜和外膜)均会受到影响,但以中膜层PASMC 的广泛增生和迁移为主,远端肺小动脉平滑肌细胞向外周以及正常无梗阻的肺细小动脉扩展是PAH 的标志之一[16]。同时PASMC 从血管中膜向内膜下迁移形成新生内膜往往标志着肺血管严重损失和血管重构出现不可逆状态[17]。因此寻找PASMC 的增殖和迁移的机制和抑制其作用的药物对阻止和逆转PAH 进展具有十分重要的意义。本研究从大鼠中分离出肺动脉中膜,采用贴壁法进行原代培养,经α-SMA 免疫荧光鉴定为PASMC,因此用于后续PASMC 相关的细胞实验[18]。众所周知,PDGF-BB 作为一种生长因子,在PAH 进程中促进PASMC 增殖和迁移发挥着不可或缺的重要作用[19]。因此,PDGF-BB 是干预PASMC 增殖和迁移重要靶标之一。本研究中,根据以往文献选择PDGF-BB 以20 mg/L 的浓度作为诱导剂来诱导PASMC 的增殖和迁移[6,12],与对照组比较,模型组的PASMC 增殖活性和迁移率均显著提升,这提示本实验成功诱导了PASMC 的增殖和迁移状态。同时实验发现浓度为5 μmol/L 的CK 来进行干预,与对照组比较,差异无统计学意义,故后续实验用5 μmol/L 的CK 来干预。干预组PASMC 的增殖能力与迁移能力明显降低;与对照组比较,单独用5 μmol/L 的CK 与PASMC 孵育增殖结果无差异。结果表明CK 具有抑制PDGF-BB 诱导PASMC 增殖和迁移的能力,而且这种作用是非细胞毒性的。
细胞外基质沉积同样是肺血管重构的重要因素。细胞外基质作为PASMC 的支持物和细胞间的连接物,在调节PASMC 生物学活性中具有重要作用,如果过度合成不仅会引起血管壁增厚还会刺激PASMC 增殖和迁移,进一步加重血管重构[20]。细胞外基质主要成分为COL Ⅰ和COL Ⅲ等,COL Ⅰ和COL Ⅲ与维持血管壁韧性和弹性有关,在维持血管壁完整性和和生理功能上起着重要作用[21]。然而COL Ⅰ和COL Ⅲ合成失控导致过度沉积则会造成血管重构[22-23]。因此减少COL Ⅰ和COL Ⅲ的产生从而抑制胶原沉积同样是防治PAH 的一个关键因素。本研究发现,与对照组比较,20 mg/L 的PDGF-BB诱导24 h 后模型组中COL Ⅰ、COL Ⅲ 信使RNA 和蛋白合成,以及培养液中蛋白均显著上升。这结果不仅表明本实验成功诱导PASMC 外胶原沉积现象,同样在细胞层面证实PDGF-BB 作为生长因子在胶原沉积中发挥了一定的作用[24]。通过以上结果可以推断PDGF-BB 还通过参与促进细胞外基质沉积来促进血管重构。因此,通过干预PDGF-BB 信号通路来减少胶原沉积,对治疗PAH 同样具有潜在的价值。本研究表明,对比模型组,在5 μmol/L 的CK同时干预下干预组中COL Ⅰ、COL Ⅲ 信使RNA 和蛋白合成以及培养液中蛋白均明显下降。这表明CK具有抑制PDGF-BB 诱导的细胞外胶原沉积的作用。
为进一步探讨CK 在PDGF-BB 诱导下PASMC增殖、迁移以及胶原沉积中的作用机制,本实验观察了Wnt/β-catenin 信号通路在其中的作用。Wnt/β-catenin 信号通路是一条古老且进化保守的信号通路,在参与PASMC 增殖、迁移、分化等病理相关过程,在PAH 的病理进程中发挥重要调控作用[25]。并且研究发现Wnt/β-catenin 信号通路也可通过促进平滑肌细胞中COL Ⅰ、COL Ⅲ合成和分泌中发挥着调控血管壁的作用[26]。β-catenin 是Wnt/β-catenin 信号通路的核心,当通路激活时β-catenin 将上调并转移至细胞核中发挥调节转录作用[27]。本研究发现,与对照组比较,模型组中β-catenin 蛋白表达明显升高。表明PDGF-BB 成功诱导该信号通路过表达。对比模型组,在CK 干预下干预组β-catenin 蛋白表达明显下降。提示CK可能通过抑制Wnt/β-catenin 信号通路,来发挥抑制PDGF-BB 的诱导PASMC 增殖、迁移以及胶原沉积能力。
综上所述,本研究揭示了CK 对PDGF-BB 诱导PASMC 增殖、迁移以及胶原沉积具有显著的抑制作用,该作用可能是通过抑制Wnt/β-catenin 信号通路激活来发挥作用。并在细胞层面发现CK 具有改善胶原沉积的作用。但本研究局限于相关信号通路观察较少,接下来还需进一步完善具体机制。
利益冲突:所有作者均声明不存在利益冲突
