间氨基苯甲酸乙酯甲磺酸盐在大菱鲆模拟保活运输中的作用效果
2022-01-06曹杰,谢晶,2,3,*
曹 杰,谢 晶,2,3,*
(1.上海海洋大学食品学院,上海 201306;2.食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306;3.上海水产品加工及贮藏工程技术研究中心(上海海洋大学),上海 201306)
我国渔业资源丰富,种类多样。2019年我国水产品总产量为6 480万 t[1]。为保障水产品的流通和满足人们对于鲜活水产品的需求,保活运输技术起到了重要作用。目前国内外开发出的保活方法包括增氧保活、低温保活、麻醉保活、冰温无水保活等[2]。麻醉保活通过抑制鱼类神经系统的敏感性,减少鱼体对运输环境的应激反应,降低鱼体代谢速率和呼吸频率,从而减少鱼体的运输损伤、提高运输存活率[3]。许多国家(如美国、巴西、日本等)已广泛使用麻醉剂进行活鱼运输,并对麻醉剂种类和剂量有着严格要求。而我国渔用麻醉剂仍处于研究阶段,国内目前尚未建立水产品运输中使用渔用麻醉剂的限量标准或法律法规[4]。近年来,渔用麻醉剂种类剧增,应用于鱼类运输的就有30多种,其中使用较多的有间氨基苯甲酸乙酯甲磺酸盐(3-aminobenzoic acid ethyl ester methanesulfonate,MS-222)、丁香油和二氧化碳等。MS-222有较好的麻醉效果,且没有富集作用,在肌肉中的残留量少、安全高效,缺点是价格贵、使用成本高[5]。丁香油价格低廉,在水产品中消除速度快,缺点是有挥发性,在长距离运输过程中麻醉效果逐渐减弱[6]。二氧化碳与其他麻醉剂相比优点在于不需要休药期[7],但是其麻醉剂量难以控制,麻醉效果不稳定且只对部分鱼起作用,在保活运输中的应用受到限制。目前国内已有研究使用MS-222进行黄颡鱼[8]、鳊鱼[9]、草鱼[10]等的麻醉运输,但使用MS-222进行大菱鲆等海水鱼的麻醉运输研究却少有报道。
大菱鲆(Scophthalmus maximus)隶属鲽形目、鲆科、菱鲆属,原产于欧洲,1992年引进山东沿海地区,经过数十年的发展,已成为我国北方沿海地区主要的海水鱼养殖品种,年产量达8.5万 t,销售价值超过40亿 元人民币[11]。在实际生活中,将大菱鲆销至内陆,常常需要长距离或长时间运输。刘伟东[12]对大菱鲆在静水且不考虑运输振动的情况下的低温有水保活进行了初步研究,研究表明,在3 ℃、鱼水质量比(简称鱼水比)1∶5的条件下,大菱鲆可以存活72 h,在该条件下,大菱鲆呼吸频率降低、活动量减少,保持静止,从而保证大菱鲆较长的存活时间;但在运输条件下,鱼体受振动、温度、氨氮胁迫影响产生的应激反应,会使存活率大大降低,然而,目前有关提高大菱鲆保活运输存活率的研究还较少。国际上已普遍使用麻醉剂来进行大规模的活鱼运输,渔用麻醉剂在国内水产品流通中的应用也是越来越多。本实验研究MS-222在静水及模拟运输条件下对大菱鲆的麻醉效果,通过检测运输水中氨氮和溶解氧水平变化,测定大菱鲆生理生化指标,筛选出大菱鲆麻醉保活运输的最优条件,以期为大菱鲆及其他海水鱼麻醉保活运输的应用提供参考。
1 材料与方法
1.1 材料与试剂
大菱鲆购于上海市浦东新区芦潮港海鲜市场,体长30~35 cm,平均体质量500~600 g。
谷草转氨酶、葡萄糖、尿素、乳酸脱氢酶、肌酐、乳酸、糖原试剂盒 南京建成生物工程研究所;鱼类Cortisol酶联免疫分析试剂盒 上海泛柯实业有限公司;MS-222 上海麦克林生化科技有限公司。
1.2 仪器与设备
LX-100VTR模拟运输振动台 上海鲁轩仪器设备厂;Multiskan FC型酶标仪 赛默飞世尔(上海)仪器有限公司;N4S型紫外-可见分光光度计、JPSJ-605F溶解氧测定仪 上海仪电科学仪器股份有限公司;LP-20水族箱三合一曝气机 深圳市兴日生实业有限公司;F2640型多点温度采集仪 美国Fluke公司;GL-200氨氮检测仪 山东格林凯瑞精密仪器有限公司;5810R高速冷冻离心机 上海艾测电子科技有限公司;CK-201海鲜鱼缸制冷机 广州诚科电子科技有限公司。
1.3 方法
1.3.1 大菱鲆的麻醉处理
用CK-201海鲜鱼缸制冷机使水温维持在13 ℃,分别取10 条暂养24 h的大菱鲆从暂养池中放入盛有不同质量浓度MS-222(20、40、60、80、100、120 mg/L)海水的水槽中,观察大菱鲆行动变化,记录其进入不同麻醉阶段的时间、复苏时间、呼吸频率(测定呼吸频率时以不添加MS-222海水中的大菱鲆为对照)。按下式计算存活率;呼吸频率以1 min内大菱鲆鳃盖张合次数来计算。

在MS-222的作用下,大菱鲆在麻醉和复苏阶段表现出一系列不同的行为变化,参考Cooke[13]和刘长琳[14]等的分期标准,结合大菱鲆麻醉和复苏阶段的行为特征,将其麻醉过程分为6个时期(表1),复苏过程分为4个时期(表2)。

表1 麻醉程度分期及鱼类行为特征Table 1 Behavior characteristics of fish at various anesthetic stages

表2 鱼体复苏过程分期及行为特征Table 2 Behavior characteristics of fish at various recovery stages
1.3.2 大菱鲆临界温度的测定
采用梯度降温的方式,以13 ℃为暂养温度,当水温为10~20 ℃时,降温速度为2 ℃/h;水温低于10 ℃时,降温速度为1 ℃/h,观察不同温度下鱼体呼吸规律,将鱼体出现咧鳃现象(未死亡状态)的水温作为其临界温度。
1.3.3 模拟运输处理的条件
设定运输振动台的转速100 r/min,模拟车速25~40 km/h,运输0、6、12、18、24 h。运输后观察大菱鲆的存活率,测定生理生化指标。对照组为相同条件下不加麻醉剂运输的鱼。
1.3.3.1 MS-222质量浓度的影响
选取40 条呼吸频率一致的大菱鲆,在13 ℃、鱼水比1∶3条件下,置于MS-222质量浓度20、40、60、80 mg/L海水中进行模拟运输,记录第6、12、18、24小时的存活率。
1.3.3.2 水温的影响
选取40 条呼吸频率一致的大菱鲆,在鱼水比1∶3,温度2、8、13、20 ℃条件下进行模拟运输(使用不添加MS-222的海水),记录第6、12、18、24小时的存活率。
1.3.3.3 鱼水比的影响
在13 ℃和MS-222质量浓度40 mg/L的条件下,分别选择鱼水比为2∶1、1∶1、1∶3、1∶5进行模拟运输,记录大菱鲆存活率保持100%的时间,即大菱鲆的保活时间。
1.3.4 模拟运输过程中各指标的测定
根据1.3.3节结果最适温度、MS-222质量浓度和鱼水比的条件下进行后续模拟运输实验。
1.3.4.1 水体指标的测定
在模拟运输的第6、12、18、24小时,从运输箱中取50 mL水,使用JPSJ-605F溶解氧测定仪测定水中溶解氧的质量浓度;使用GL-200氨氮检测仪测定水体氨氮质量浓度。
1.3.4.2 鱼体生理生化指标的测定
在模拟运输过程中的第6、12、18、24小时对麻醉组和对照组的鱼随机取3 条鱼,测定理化指标。
大菱鲆肌肉中乳酸、糖原含量的测定:取鱼背部和腹部的肌肉搅碎匀浆,参考试剂盒说明书测定大菱鲆肌肉中乳酸、糖原含量。
鱼肉pH值的测定:准确称量2 g鱼肉于烧杯中,加质量分数0.85%生理盐水18 mL,均质后5 000 r/min离心2 min,取上清液并用pH计测定鱼肉pH值。
血清生化指标的测定:从尾静脉取血,全血不加抗凝剂,于4 ℃静置2 h,血液明显分层后以3 000 r/min离心20 min,分别收集每尾鱼的血清于2 mL的离心管中[15]。鱼血清皮质醇质量浓度采用鱼类Cortisol酶联免疫分析试剂盒测定;血清中谷草转氨酶、葡萄糖、尿素、乳酸脱氢酶和肌酐水平分别参考试剂盒说明书进行测定。
1.4 数据处理与分析
实验结果以平均值±标准差表示。采用Excel 2007软件和SPSS 26.0软件对数据进行统计分析。采用Duncan多重比较进行单因素方差分析,P<0.05表示差异显著。采用Excel 2007软件绘图。
2 结果与分析
2.1 不同质量浓度MS-222对大菱鲆的麻醉效果
由表3、4可知,大菱鲆进入同一麻醉阶段的时间随MS-222质量浓度的提高而缩短,大菱鲆的复苏时间则随麻醉剂质量浓度的增加而延长。大菱鲆在20、40 mg/L的MS-222麻醉液中最终处于深度镇静期。当MS-222质量浓度为60 mg/L和80 mg/L时,大菱鲆分别能达到麻醉第IV期和V期,时间分别约为671 s和618 s,不能进入第VI期;当MS-222质量浓度为100 mg/L和120 mg/L时,鱼体复苏至第IV期的时间较长,这可能是由于鱼已进入深度麻醉期,需要较长时间恢复,且复苏后鱼体状态差,复苏24 h后存活率分别为70%和40%。

表3 不同质量浓度MS-222对大菱鲆的麻醉效果Table 3 Anesthetic effect of MS-222 at different concentrations in turbot
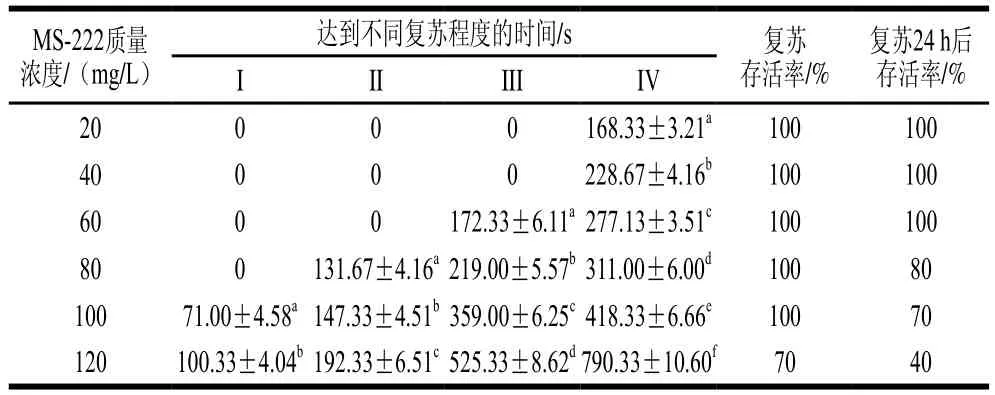
表4 大菱鲆经不同质量浓度MS-222麻醉后的复苏情况Table 4 Resuscitation status of turbot anesthetized with MS-222 at different concentrations
2.2 不同质量浓度MS-222对大菱鲆呼吸频率的影响
图1反映出大菱鲆在不同质量浓度的MS-222麻醉液中呼吸频率的变化。除了在前1 min内呼吸频率略微上升外,随着MS-222质量浓度的增加,呼吸频率呈下降趋势,这与郭丰红等[16]所得研究结果相近。在质量浓度为40~60 mg/L的麻醉液中,大菱鲆未出现咧鳃现象,随着时间的延长其呼吸频率不断下降;麻醉液质量提高至100、120 mg/L时,在7 min内大菱鲆呼吸频率分别从57、56 次/min快速降至23、17 次/min。
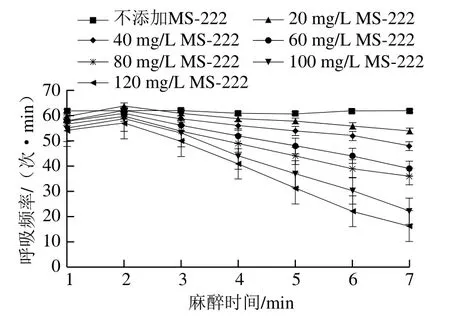
图1 在MS-222麻醉液中大菱鲆呼吸频率的变化Fig. 1 Changes in respiratory rate of turbot exposed to MS-222 solutions
2.3 大菱鲆保活的临界温度
当水温在15~20 ℃时,大菱鲆游动正常,呼吸频率稳定。水温降低,其呼吸频率逐渐下降,当水温降到8 ℃时,大菱鲆基本停止游动,水温降至2 ℃时出现鳃盖张开现象,呼吸无规律,接近死亡,可以认为大菱鲆保活的临界温度为2 ℃。
2.4 不同质量浓度MS-222对大菱鲆模拟运输存活率的影响
麻醉剂质量浓度对大菱鲆运输存活率的影响如图2所示。随着运输时间延长,大菱鲆存活率逐渐降低,运输超过12 h后,20 mg/L MS-222处理组的大菱鲆出现死亡,模拟运输24 h后大菱鲆存活率降至60%,40 mg/L质量浓度下大菱鲆运输24 h后存活率仍为100%;60 mg/L质量浓度下大菱鲆存活率18 h前无变化,运输24 h后存活率降至80%,80 mg/L MS-222中大菱鲆于6 h时就出现死亡,24 h后存活率降至40%。因此选择40 mg/L MS-222进行保活运输更可行。
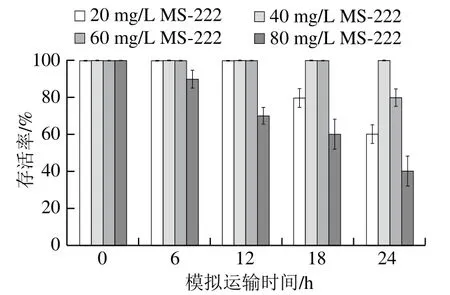
图2 MS-222质量浓度对大菱鲆运输存活率的影响Fig. 2 Effect of MS-222 concentration on the survival rate of turbot during live transportation
2.5 不同温度对大菱鲆保活运输存活率的影响
图3反映出温度对大菱鲆模拟运输过程中存活率的影响,20 ℃时大菱鲆运输12 h后存活率即降至70%,24 h后均全部死亡;13 ℃时大菱鲆运输12 h后的存活率为100%,24 h的存活率降至80%,在8 ℃时大菱鲆保活运输24 h后存活率仍为100%,2 ℃下大菱鲆运输6 h后存活率就降至80%,18 h后全部死亡。

图3 不同温度对大菱鲆运输存活率的影响Fig. 3 Effect of different water temperatures on the survival rate of turbot during transportation
2.6 不同鱼水比对大菱鲆保活时间的影响
在模拟运输实验中,大菱鲆的存活时间随鱼水比的减小而延长。在8 ℃和MS-222质量浓度40 mg/L条件下探究不同鱼水比对大菱鲆保活时间的影响。如图4所示,鱼水比从2∶1降至1∶1时,保活时间延长了9.5 h,自1∶3降至1∶5后,保活时间可延长至32 h。考虑到经济成本和实际运输时间,选择鱼水比1∶3进行保活运输更可行。
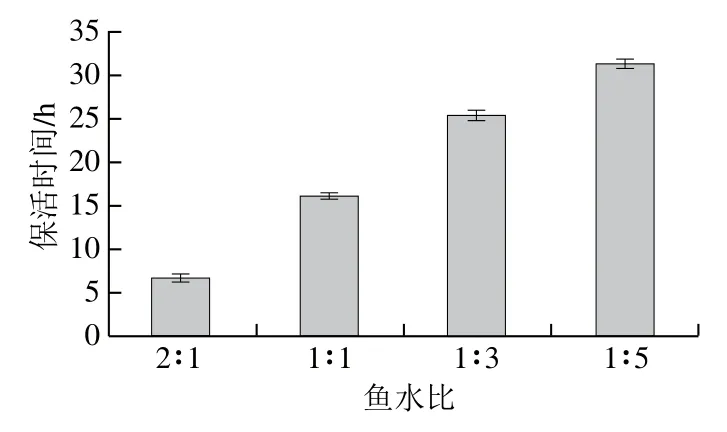
图4 不同鱼水比对大菱鲆保活时间的影响Fig. 4 Effect of different fish to water ratios on the survival rate of turbot during transportation
综上,水温为8 ℃、MS-222质量浓度为40 mg/L、鱼水比为1∶3时,大菱鲆保活运输时间长、成本低,选择此条件进行后续模拟运输实验。
2.7 大菱鲆模拟运输过程中氨氮、溶解氧质量浓度的变化
2.7.1 氨氮质量浓度的变化
如图5所示,模拟运输开始前,保活运输箱的水经充分曝气24 h后,氨氮质量浓度几乎为0,运输开始后,水中氨氮质量浓度先快速上升,而后缓慢增长,其中对照组中运输24 h后水中氨氮质量浓度升至4.17 mg/L,麻醉组运输24 h后水中氨氮质量浓度升至2.82 mg/L。

图5 大菱鲆模拟运输过程中水中氨氮质量浓度的变化Fig. 5 Changes in ammonia nitrogen concentration in water during simulated transportation of turbot
2.7.2 溶解氧质量浓度的变化
如图6所示,模拟运输开始前,水中溶解氧质量浓度均为6.80 mg/L,运输开始后,水中溶解氧水平呈下降趋势,12 h后麻醉组水体中溶解氧水平降至4.02 mg/L,对照组水体中溶解氧水平降至2.12 mg/L,继续运输,对照组中大菱鲆出现死亡,而麻醉组大菱鲆存活率仍为100%。运输24 h后麻醉组水体中溶解氧水平降至2.65 mg/L,对照组水体中溶解氧水平降至1.18 mg/L。
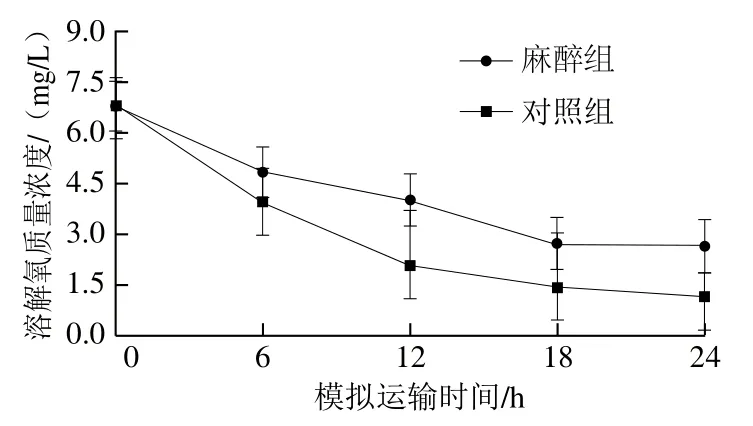
图6 大菱鲆模拟运输过程中水中溶解氧的变化Fig. 6 Changes in dissolved oxygen in water during simulated transportation of turbot
2.8 大菱鲆模拟运输过程中乳酸含量、糖原含量和pH值的变化
如图7所示,在模拟运输过程中,鱼体肌肉中糖原和乳酸含量变化呈负相关趋势。随运输时间的延长,鱼体肌肉中糖原含量下降,运输24 h后麻醉组大菱鲆肌肉中糖原含量降低了17.9%;随着运输时间的增长,鱼体肌肉中乳酸含量上升,运输24 h后麻醉组大菱鲆肌肉中乳酸含量上升了120.1%。随着运输时间的延长,麻醉组和对照组的大菱鲆肌肉pH值呈下降趋势,运输24 h后,麻醉组大菱鲆肌肉pH值降低0.36,且总体下降趋势与对照组相比更缓和。


图7 大菱鲆模拟运输过程中肌肉乳酸含量(A)、糖原含量(B)、pH值(C)的变化Fig. 7 Changes in muscle lactate content (A), glycogen content (B), and pH (C) during simulated transport of turbot
2.9 大菱鲆模拟运输过程中血清生化指标的变化
如表5所示,模拟运输至6 h时,麻醉组鱼体血清中谷草转氨酶活力变化不显著,运输至12 h时,麻醉组鱼体血清谷草转氨酶活力中与6 h时相比变化不显著,随着运输时间进一步延长,谷草转氨酶活力快速上升。大菱鲆被麻醉后,与对照组相比,其血清皮质醇质量浓度显著升高,运输12 h内,麻醉组大菱鲆血清皮质醇的质量浓度变化不显著,而对照组鱼体血清皮质醇质量浓度变化显著。模拟运输12 h后,麻醉组和对照组鱼体血清乳酸脱氢酶活力分别上升至831.33、1 142.00 U/L。运输12 h后,麻醉组鱼体血清尿素浓度与对照组相差不显著,随着运输时间的延长,两组的血清UR浓度均显著增加增长显著。在运输过程中,麻醉组鱼体血清葡萄糖浓度上升趋势明显小于对照组。

表5 大菱鲆模拟运输后血清生化指标的变化Table 5 Changes in serum biochemical indexes of turbot during simulated transportation
3 讨 论
3.1 MS-222质量浓度、水温及鱼水比对大菱鲆运输存活率的影响
MS-222质量浓度大于100 mg/L时,大菱鲆复苏存活率降低。这可能是麻醉剂浓度过高,使鱼呼吸系统和神经中枢深度麻痹,致使鱼体死亡[17]。大菱鲆呼吸频率随MS-222麻醉液质量浓度的升高而降低,MS-22质量浓度越高,下降速率加快。实验发现,MS-222质量浓度为20~40 mg/L时,大菱鲆产生的应激反应较小,当MS-222质量浓度为100~120mg/L时,大菱鲆在短时间出现鳃盖外翻、挣扎现象,表明鱼体对高质量浓度麻醉液产生了强烈的应激反应。本实验得出MS-222麻醉大菱鲆的有效麻醉质量浓度为40~60 mg/L,这与MS-222麻醉牙鲆[18](60 mg/L)、大黑口鲈幼鱼[19](70 mg/L)所得研究结果相近,与加州鲈鱼[20](20 mg/L)所得研究结果差别较大。这可能是因为不同种类的鱼有不同的代谢速率,因此MS-222对不同的鱼种的麻醉效果有一定的差异[21]。处于深度镇静期的鱼对外界刺激的应激反应小,代谢率低,仍然能够维持鱼体平衡,此状态下,最适合保活运输[22]。综合考虑质量浓度为40 mg/L的MS-222麻醉液更适于大菱鲆的麻醉运输。
水温的变化对鱼类的生理反应起决定性作用,在水温较高的条件下,鱼体代谢速率、呼吸频率提升,导致水中溶解氧降低,随着运输时间延长,鱼因缺氧而死亡[23];而水温降低可以减缓鱼的代谢速率,减少氧气消耗,从而减少氨的产生和毒性,减少溶解氧的消耗,从而提高运输存活率;当水温低于临界温度条件(2 ℃)时,鱼体呼吸几乎停止,无法满足鱼体用氧而致其死亡,表明临界温度附近不适于大菱鲆的保活运输。
降低鱼水比是保活运输需要考虑的重点经济,本研究结果表明,麻醉处理对大菱鲆运输降低鱼水比有积极影响,选择鱼水比1∶3麻醉条件进行保活运输,符合保活运输经济利益最大化。
3.2 模拟运输过程中水体指标变化对大菱鲆存活率的影响
氨氮是一种神经毒性物质,水中氨氮含量过高时,鱼体血液中的氨排出量就会减少,导致鱼体血液中氨含量升高,引起毒性反应[24]。实验结果表明,氨氮质量浓度影响大菱鲆的保活运输时间,麻醉操作能够降低大菱鲆代谢活动,减少鱼体氨的排出,提高大菱鲆的运输存活率。
水中溶解氧水平通过影响鱼类的鳃部运动和呼吸而造成鱼体麻醉效果的差异。实验结果表明,随着运输时间延长,水中溶解氧水平持续减少,鱼为满足代谢需求而提高呼吸频率,导致水体加速恶化,运输后死亡的鱼大多是因为缺氧和水质败坏[22]。麻醉减少了大菱鲆对溶解氧的消耗,延长了保活运输时间。
3.3 MS-222麻醉保活运输对大菱鲆肌肉及血清生化指标的影响
大菱鲆经停食暂养一段时间后再进行运输时,鱼体处于饥饿状态下,血液中的葡萄糖不能够满足鱼体的消耗,鱼体进行无氧代谢,分解肌糖原,糖原分解产生乳酸,乳酸在肌肉中积累导致肌肉pH值降低[24-25]。鱼体内肌肉、血液和肝脏3 种组织中乳酸、糖原和葡萄糖的含量水平有着相应的关系[26]。实验发现,模拟运输过程中,麻醉组大菱鲆肌肉中糖原的下降速率和乳酸上升速率均小于对照组,这是因为鱼被麻醉后,代谢速率降低,肌肉组织中乳酸积累少,故麻醉组大菱鲆鱼体糖原与pH值下降幅度低于对照组的下降幅度[27]。
鱼体血液中的皮质醇水平可以体现鱼体的应激程度,常被用作鱼体应激指标。当鱼体受到刺激时,其皮质醇水平会显著升高[28]。与对照组相比,麻醉后大菱鲆血清皮质醇质量浓度升高,这可能是鱼体被麻醉时产生了应激反应。但在运输过程中,与对照组相比,麻醉组鱼体的血清皮质醇质量浓度变化不明显,麻醉剂减少了鱼体对外界的应激反应,从而保持皮质醇水平稳定。
乳酸脱氢酶是糖代谢中催化丙酮酸转化成乳酸的酶,肝脏和肌肉损伤都会导致乳酸脱氢酶活力升高,模拟运输12 h后,麻醉组和对照组鱼体血清乳酸脱氢酶活力变化显著,随着运输时间的延长,水中溶解氧水平持续减少,鱼体进行无氧呼吸导致肝脏、心肌受损,乳酸脱氢酶活力上升,这也是鱼体在长距离运输过程中死亡的重要原因。运输过程中的各时间段,麻醉组大菱鲆乳酸脱氢酶活力的增长幅度低于对照组大菱鲆乳酸脱氢酶活力的增长幅度,表明麻醉组在模拟运输过程中肝脏所受损伤要小于对照组。
谷草转氨酶是肝脏连接糖、脂质、蛋白质代谢的重要酶,其活力是反映鱼体应激程度的重要指标。一般状态下,血液中谷草转氨酶的活力较低且稳定,当鱼体受到刺激时,谷草转氨酶活力升高,也表示组织受到一定程度的损伤[29]。运输过程的前12 h内,麻醉组大菱鲆的谷草转氨酶活力变化不显著,运输18 h后,其活力显著升高,这可能是因为大菱鲆供能不足,需要分解糖、脂质、蛋白质或肝脏受到了一定损伤,这也是运输过程中鱼死亡的原因之一。
鱼体血液中的葡萄糖浓度会在应激反应下升高,可作为相应的应激指标[30]。麻醉组的鱼体血清葡萄糖浓度增加幅度远低于对照组,这可能是麻醉操作降低了鱼在运输过程中的代谢活动,减缓了糖原的分解。
血液尿素、肌酐浓度的变化能够反映出鱼体肾脏的代谢情况,是反映鱼肾功能的指标。肾脏受损时,尿素和肌酐浓度升高[31]。运输过程中,麻醉组和对照组大菱鲆血清尿素和肌酐浓度变化显著,说明大菱鲆在模拟运输过程中肾功能收到一定程度的损伤,这也是鱼体在运输过程中出现死亡的重要原因。但麻醉组大菱鲆血清尿素、肌酐浓度的增幅均低于对照组,表明麻醉能在一定程度上减少在运输过程中鱼肾功能的损伤。
综上实验结果表明,当水温为8 ℃、MS-222质量浓度为40 mg/L、鱼水比为1∶3时,运输时间长,大菱鲆存活率高。随运输时间的延长,水体中氨氮质量浓度上升,溶解氧水平则下降,水质逐渐恶化,这是导致大菱鲆保活运输时间缩短和存活率降低的外部原因;随着运输时间的延长,大菱鲆肌肉中糖原含量、pH值下降,乳酸含量上升,血清生化指标中乳酸脱氢酶、谷草转氨酶、尿素、肌酐水平均有显著变化,皮质醇水平在前12 h保持稳定,说明振动运输影响了大菱鲆的生理机能。麻醉组相应指标的变化幅度均小于对照组,说明使用MS-222对大菱鲆进行麻醉运输能够降低其在运输过程中产生的应激反应,减少在运输过程中鱼体所受的损伤,延长保活运输时间,提高运输存活率。
