超声处理对类PSE鸡肉分离蛋白结构和乳化特性的影响
2022-01-06李三影杜曼婷王艳秋张俊霞白艳红
李 可,李三影,杜曼婷,王艳秋,张俊霞,白艳红
(郑州轻工业大学食品与生物工程学院,河南省冷链食品质量安全控制重点实验室,食品生产与安全河南省协同创新中心,河南 郑州 450001)
在过去的几十年,全球禽肉的生产和消费迅速增长[1]。值得注意的是,消费者的消费习惯已经发生了变化,对原料肉的品质与加工特性的要求越来越高。然而,类苍白松软渗水(pale, soft and exudative,PSE)鸡肉是一类颜色苍白、质地柔软、汁液渗出的劣质肉,其发生率较高,具有较低的pH值,加工过程中盐溶性蛋白难以提取[2],导致产品的出品率降低和质构劣变,给禽肉深加工业造成巨大经济损失。鸡肉中含20%~23%的蛋白质,从鸡胸肉中提取的肌肉蛋白是营养最丰富的蛋白种类之一。肌肉蛋白具有高消化性和低过敏性,富含人体所需的所有必需和非必需氨基酸,其功能特性对于肉制品的品质至关重要[3]。近几年国内外学者关注不同加工方式改善类PSE鸡肉蛋白质功能特性,包括打浆[4]、脉冲电场[5]、糖基化[6]、酸碱处理[7]等。与其他加工处理不同,酸碱处理原理是将畜禽/水产品肌肉蛋白溶于极性酸碱环境中,调节pH值至等电点以沉淀蛋白,从而获得分离蛋白,其中通过优化酸碱溶解与等电点沉淀时pH值提高蛋白回收率。Zhao Xue等[7-8]发现利用碱溶酸沉法回收在pH 5.5时得到的类PSE鸡肉分离蛋白(以下简称类PSE分离蛋白)回收率较高,然而其凝胶乳化功能特性却弱于其他回收pH组。因此,有必要进一步改善回收pH 5.5时类PSE分离蛋白功能特性。
超声处理是一种绿色的食品物理加工技术。高强度超声波(16~100 kHz、10~1 000 W/cm2)通过物理效应、机械效应、热效应等产生的物理和化学作用,改变食品组分的结构与功能性质[9]。最近有研究证明,超声波技术有潜力改性各种酸碱分离蛋白并改善其功能特性,如鳕鱼分离蛋白[10]、紫贻贝分离蛋白[11]、豌豆分离蛋白[12]等。在肉品加工中,超声处理主要应用于原料肉的速冻解冻、嫩化、腌制滚揉、畜禽副产物分离提取等[13-14],有效改善了肉品组分功能性质和品质,提高加工效率[15]。目前,超声处理应用于辅助提取畜禽副产物蛋白,提高了回收率,而关于超声处理对类PSE分离蛋白功能特性及其结构变化的影响研究鲜见报道。因此,本实验以类PSE分离蛋白为研究对象,采用超声对类PSE分离蛋白进行改性,探讨不同超声功率对类PSE分离蛋白结构和功能特性的影响,并进一步分析超声处理后类PSE分离蛋白结构与功能的相互联系,以期为类PSE分离蛋白的加工应用提供理论依据。
1 材料与方法
1.1 材料与试剂
去骨的鸡胸肉采集于郑州某加工厂去骨线。
金龙鱼大豆油 益海嘉里金龙鱼粮油食品有限公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 北京华迈科生物技术有限责任公司;二硫苏糖醇(DL-dithiothreitol,DTT)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上海源叶生物有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司;所有试剂均为分析纯。
1.2 仪器与设备
PH-STAR CPU胴体肌肉pH值测定仪 北京布拉德科技发展有限公司;CiX62便携式色度仪 美国爱色丽公司;SZ-22A绞肉机 广州旭众食品机械有限公司;T25高速均浆机 德国IKA公司;VC750超声波破碎仪 美国Sonic公司;PHS-3C pH计 上海雷磁仪器厂;AvantiJ-26S XPI 大容量高速冷冻离心机美国Beckman Coulter公司;TU-1810紫外-可见分光光度计 北京通用仪器有限公司;Nano-ZS90纳米激光粒度仪 英国马尔文仪器公司;凝胶成像仪 美国伯乐公司;圆二色谱仪 英国应用光学物理公司;F-7000荧光分光光度计、Regulus 8100冷场发射扫描电子显微镜日本日立有限公司。
1.3 方法
1.3.1 类PSE分离蛋白的提取和分离蛋白溶液质量浓度的测定
样品的选取参考Li Ke等[16]的方法。宰后24 h,测定所有样品的L*值和pH值(pH24h),选取类PSE鸡胸肉(L*>53,pH24h<5.7)。选取后,将所有肉眼可见的结缔组织,脂肪去除。然后将肉切成约1 cm3正方体小块,用真空包装袋包装,每袋约100 g,冷冻(-20 ℃),并在2 周内使用。
参考Zhao Xue等[17]的方法,取100 g样品于4 ℃下解冻12 h,肉块在预冷的绞肉机中以4 000 r/min 绞碎20 s(2 次)。然后将糊状物与预冷的去离子水以1∶6(m/V)混合,10 000 r/min均质1 min。使用2 mol/L NaOH溶液调节肉浆至pH 11,将浆液均质后在4 ℃下冷却10 min,以稳定系统。然后,肉浆在4 ℃下10 000×g离心15 min,浆状上清液使用2 mol/L HCl溶液将pH值调节至5.5(等电点附近),在4 ℃下放置10 min待蛋白质完全沉淀后将混合物10 000×g离心15 min,收集沉淀物,即为类PSE分离蛋白。将沉淀溶于去离子水中,用1 mol/L NaOH溶液调整溶液至中性得到类PSE分离蛋白溶液。参考文献[8],采用双缩脲法测定分离蛋白溶液的质量浓度,所有过程保持在4 ℃。
1.3.2 类PSE分离蛋白的超声处理
将1.3.1节得到的分离蛋白溶液稀释至20 mg/mL(用去离子水稀释,后同),取50 mL于100 mL的小烧杯中进行超声处理。13 mm的超声波探头放入液面下15 mm处,超声频率:20 kHz;超声功率:150、300、450 W;超声模式:超声2 s,停止4 s;此条件下处理5 min。整个样品处理过程中温度低于12 ℃,得到的对照组(未进行超声处理)、150 W组、300 W组、450 W组分离蛋白溶液在4 ℃下保存,48 h内进行后续分析。
1.3.3 类PSE分离蛋白溶液粒径和电位的测定
将1.3.2节得到的4 组分离蛋白溶液稀释至1 mg/mL。使用纳米激光粒度仪测定分离蛋白溶液的粒径和电位。
1.3.4 类PSE分离蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
根据Laemmli等[18]的方法进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析。将1.3.2节得到的分离蛋白溶液稀释至5 mg/mL,分别与等体积的还原缓冲液(0.5 mol/L Tris-HCl、20%(质量分数,后同)Gly、10% SDS、3.33% DTT和2%溴酚蓝)、非还原缓冲液(0.5 mol/L Tris-HCl、20% Gly、10% SDS、2%溴酚蓝)混合,然后在100 ℃的沸水中加热5 min。电泳凝胶由5%浓缩凝胶和10%分离凝胶组成,加样量为10 μL。在垂直电泳仪中以60 V电泳20 min,然后以110 V电泳约1.2 h。用考马斯亮蓝R-250染色30 min。然后,将其脱色直到背景清晰为止。使用凝胶成像仪成像,通过Quantity One软件对还原条件下肌球蛋白重链和肌动蛋白条带定量分析。
1.3.5 类PSE分离蛋白二级结构的测定
将1.3.2节得到的4 组分离蛋白溶液稀释至0.1 mg/mL。根据Dong Ming等[5]的方法,使用圆二色谱仪分析类PSE分离蛋白的二级结构。带宽设定为1 nm,在190~260 nm的波长范围内记录样品的平均残留椭圆度。去离子水作为空白组,每个样品重复3 次测定。然后用CDNN Pro软件计算α-螺旋、β-折叠、β-转角和无规卷曲的相对含量。
1.3.6 类PSE分离蛋白三级结构的测定
1.3.6.1 自由巯基含量的测定
参考Zhang Ziye等[19]的方法并稍作修改。将1.3.2节得到的4 组分离蛋白溶液稀释至5.0 mg/mL。然后,将1 mL蛋白溶液与4 mL含5 mmol/L EDTA的磷酸盐缓冲液(20 mmol/L Na2HPO4/NaH2PO4、pH 8.0)和100 μL 10 mmol/L DTNB溶液混合。将混合物在黑暗中保持30 min,用紫外-可见分光光度计测定412 nm波长处的吸光度,通过13 600 L/(mol·cm)的摩尔消光系数计算自由巯基含量,单位为μmol/g。
1.3.6.2 表面疏水性的测定
参考Ma Wuchao等[10]方法,使用ANS法测定类PSE分离蛋白的表面疏水性。用10 mmol/L磷酸盐缓冲液(pH 7.0)将1.3.2节得到的4 组分离蛋白溶液分别稀释至0.2、0.4、0.6、0.8、1.0 mg/mL。将50 μL 8 mmol/L ANS溶液(溶剂为pH 7.0、10 mmol/L磷酸盐缓冲液)与4 mL蛋白稀释样品混合,室温避光反应20 min。荧光强度(FI)通过荧光分光光度计在340 nm(激发)和470 nm(发射)的波长下测定。FI对蛋白质量浓度的初始斜率作为表面疏水性(H0)。
1.3.6.3 荧光强度的测定
参考Zhao Xue等[20]方法,测定类PSE分离蛋白的内源性荧光光谱,稍作修改。用去离子水将1.3.2节得到的4 组分离蛋白溶液稀释至0.1 mg/mL,在25 ℃下使用荧光分光光度计对溶液进行分析。使用光程为1 cm的石英比色皿,激发波长为280 nm,发射光谱范围为290~460 nm。激发和发射狭缝宽度为2.5 nm,扫描速率为12 000 nm/min。
1.3.7 类PSE分离蛋白微观结构观察
将1.3.2节得到的4 组分离蛋白溶液进行真空冷冻干燥,获得冷冻干燥后的蛋白样品。扫描电子显微镜加速电压为1.0 kV,在500 倍的放大倍数下观察喷金处理后不同样品的微观结构。
1.3.8 类PSE分离蛋白溶解度的测定
样品溶解度的测定参考Zou Ye等[21]方法,稍加修改。将1.3.2节得到的分离蛋白溶液稀释至10 mg/mL,取5 mL分离蛋白溶液于10 mL离心管中,在4 ℃、10 000×g下离心30 min,根据双缩脲法[8]测量上清液中的蛋白质量浓度(即去离子水中的溶解度);相似地,将1.3.2节得到的分离蛋白溶液稀释至10 mg/mL,然后按照2%的添加量加入NaCl,充分混合后取5 mL混合溶液于10 mL离心管进行上述离心操作,取上清液测定蛋白质量浓度(即2% NaCl中的溶解度)。蛋白溶解度按公式(1)计算。

1.3.9 类PSE分离蛋白乳化特性的测定
乳液制备参考Zhao Xue等[8]的方法。向1.3.2节得到的20 mL 20 mg/mL分离蛋白溶液中添加大豆油(200 g/L)和NaCl(2 g/100 g),为确保乳液体系完全混合,使用均质机以10 000 r/min 均质1 min后间歇1 min,再次均质1 min,保持温度低于10 ℃。在均质过程中,将乳液保存在冰中以防止热变性。均质后,立即在0、10 min吸取50 μL乳液,然后加入5 mL 1 mg/mL的SDS溶液充分混合。以SDS溶液为空白,测定500 nm波长处吸光度。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)按公式(2)、(3)计算。
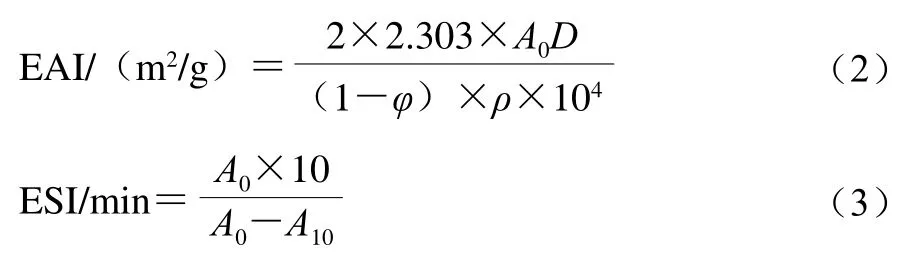
式中:A0和A10分别表示0 min和10 min时500 nm波长处的吸光度;D是稀释倍数100;φ是油相体积分数(20%);ρ是蛋白质量浓度/(g/mL)。
1.4 数据处理与分析
采用SPSS 21.0软件进行数据处理,实验结果均以平均值±标准差表示。采用SPSS 21.0统计软件进行单因素方差分析,通过Duncan多重比较进行显著性分析,P<0.05时表示不同处理组间存在显著差异;采用SPSS 21.0软件对各指标进行Pearson’s相关性分析。使用Origin 2018软件进行主成分分析、绘图。
2 结果与分析
2.1 超声对类PSE分离蛋白粒径和电位的影响
粒径通常用来评估蛋白聚集体的大小,在蛋白质的功能特性中起着重要作用[22]。图1显示不同超声处理后类PSE分离蛋白的粒径分布。随着超声功率的增加,蛋白粒径分布逐渐向左移动,并逐渐从双峰分布转变为单峰分布,表明蛋白质在水溶液中均匀分布。如表1所示,对照组(未经超声处理)平均粒径为(3 828.33±22.68)nm。超声功率为150、300、450 W时,蛋白平均粒径分别为(994.20±17.80)、(713.80±28.52)、(586.13±16.42)nm,表明超声处理可以显著减小类PSE分离蛋白的粒径(P<0.05),这与粒径分布是一致的。Yu Cuiping[11]、Zhang Ziye[19]、Malik[23]等也报道不同功率和时间超声处理后,鸡肌原纤维蛋白、贻贝分离蛋白和向日葵分离蛋白的粒径也显著降低。粒径降低的原因可能是超声空化作用产生的剪切力和湍流,经超声处理后,蛋白质聚集体中的非共价键被破坏,导致颗粒变小[24]。
由表1可知,蛋白质样品的ζ电位值都是负的,这表明蛋白表面带负电的基团多于带正电的基团。超声处理后蛋白质的表面净电荷是降低的,表明蛋白表面基团的电离度减弱[25]。与对照组相比,超声处理后样品的电位绝对值显著下降(P<0.05),这可能是由于超声处理使蛋白质结构展开,暴露出更多的带正电荷的基团,导致蛋白质表面的负电荷被中和[26]。ζ电位的变化与Wang Yuntao等[27]的研究结果一致。

表1 不同超声功率处理对类PSE鸡肉分离蛋白粒径和ζ电位的影响Table 1 Effects of different ultrasonic power levels on the particle size and ζ-potential of PSE-like chicken protein isolate
2.2 超声后类PSE分离蛋白的SDS-PAGE结果
图2A显示在还原和非还原条件下对照组和超声处理组类PSE分离蛋白样品的SDS-PAGE图谱。与对照组相比,各超声处理组蛋白组成成分没有发生明显变化,同时可以观察到3个主要的条带,分子质量分别约为205、45 kDa和35 kDa,对应的蛋白依次是肌球蛋白重链、肌动蛋白和原肌球蛋白。在还原条件下,与对照组相比(泳道1),超声处理的蛋白质样品的主要条带组成没有发生明显变化,这表明超声处理组未发生肽键断裂。由图2B可知,300、450 W超声处理组样品的肌球蛋白重链和肌动蛋白条带强度高于对照组,这可能是由于一定功率的超声处理可以增加类PSE分离蛋白的水溶性。Zhu Zhenbo等[28]研究超声处理核桃分离蛋白,结果表明不同超声功率和时间处理后蛋白质样品的主要条带并没有发生明显改变,而出现主要条带强度增强的原因是超声处理增加核桃蛋白的水溶性,这与本研究结果相似。在非还原条件下,对照组和超声处理的类PSE分离蛋白样品的电泳图谱也没有显著差异,表明超声处理没有破坏任何二硫键,进一步证实了超声处理没有导致任何蛋白质分子的断裂[28]。

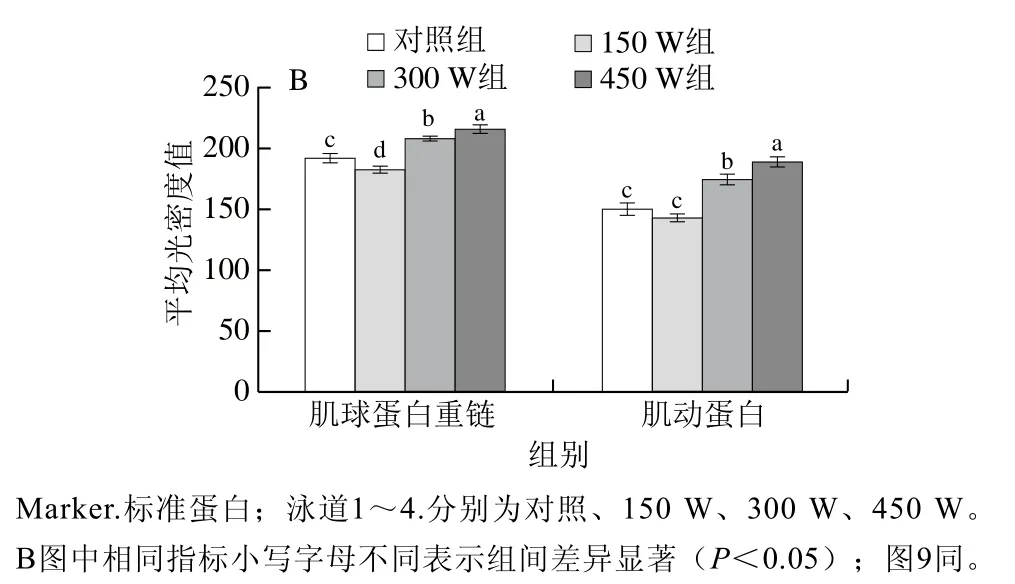
图2 类PSE鸡肉分离蛋白的SDS-PAGE图谱(A)和还原条件下肌球蛋白重链和肌动蛋白条带的平均光密度值(B)Fig. 2 SDS-PAGE profiles (A) and average optical density of myosin heavy chain and actin bands from PSE-like chicken protein isolate under reducing conditions (B)
2.3 超声对类PSE分离蛋白二级结构的影响
圆二色谱能够反映蛋白质主链肽键的构象,是反映蛋白质结构是否发生变化的重要指标[29]。如图3所示,类PSE分离蛋白在208、222 nm处出现的两个负吸收峰,是α-螺旋的吸收峰,且α-螺旋含量与峰的强度成正比[30]。随着超声功率的增加,峰的强度逐渐增大,说明α-螺旋含量增加,其含量的增加表明超声会引起类PSE分离蛋白构象部分恢复,从而使蛋白质的功能稳定性增加[31]。
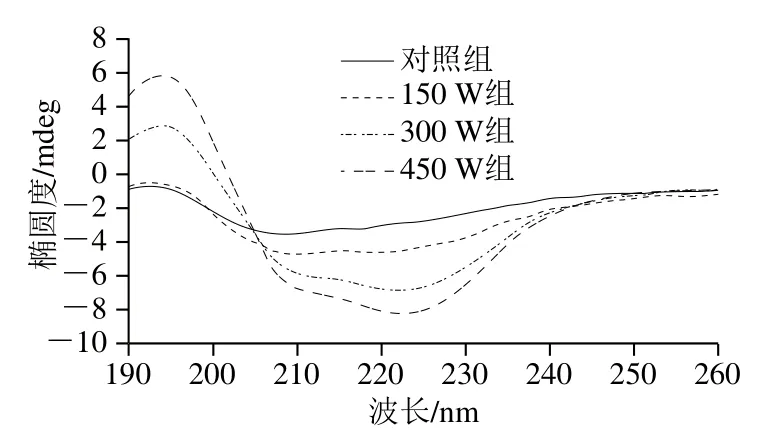
图3 不同超声功率处理对类PSE鸡肉分离蛋白二级结构的影响Fig. 3 Effects of different ultrasonic power levels on the secondary structure of PSE-like chicken protein isolate
如表2所示,随超声功率的增加,α-螺旋和无规卷曲相对含量增加,β-折叠、β-转角相对含量大体呈下降趋势;此外,与对照组相比,150、300 W超声处理时,β-转角和无规卷曲的相对含量没有显著变化(P>0.05),超声处理功率为450 W时,α-螺旋的相对含量显著增加(P<0.05),由15.25%增加到40.91%,而β-折叠的相对含量显著下降(P<0.05),可能是超声处理使两者之间发生了结构转化,β-折叠相对含量还与蛋白质疏水性有关,其相对含量降低表明分子内部的疏水性位点暴露,疏水性增强[32]。Hu Hao等[33]也发现超声处理增加大豆分离蛋白的α-螺旋和无规卷曲含量,减少β-折叠含量。但是,与本课题组之前研究超声处理类PSE鸡肉糜的结果[16]相反,这可能是由于类PSE鸡肉经过酸碱处理和超声处理温度不同等所致。以上结果表明,超声处理改变了类PSE分离蛋白的二级结构,促进类PSE分离蛋白构象部分恢复。
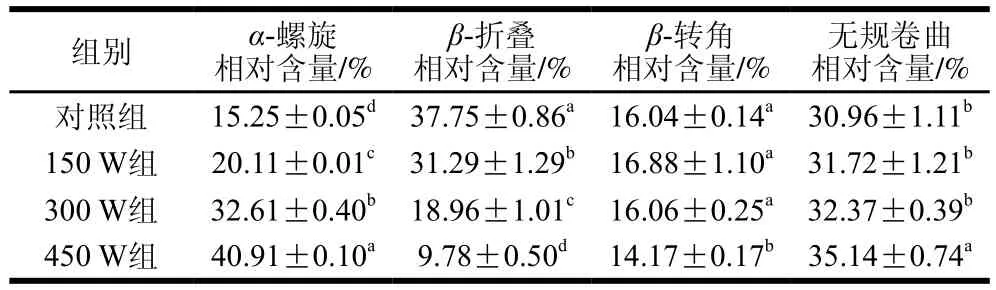
表2 超声处理类PSE鸡肉分离蛋白的二级结构相对含量变化Table 2 Changes in relative contents of secondary structures of PSE-like chicken protein isolate under ultrasonic treatments
2.4 超声对类PSE分离蛋白三级结构的影响
2.4.1 超声对类PSE分离蛋白自由巯基含量的影响
自由巯基是蛋白质中重要的功能成分之一。因此,其含量的变化可以反映蛋白质的变性程度,并对蛋白质的功能特性(例如溶解性、乳化能力和起泡能力)起着重要作用[34]。如图4所示,超声处理后自由巯基含量显著增加(P<0.05)。与对照组相比,当超声功率增加到450 W,自由巯基含量增加了约2 倍。自由巯基含量的增加可能是由于超声空化效应促进蛋白分子结构的展开,减小了蛋白粒径(图1),并使埋藏在分子内的巯基基团暴露出来[35],从而使自由巯基含量增加。Hu Hao等[33]同样研究发现,大豆分离蛋白的自由巯基含量随超声功率(200~600 W)的增加和超声时间(15~30 min)的延长而增加。然而Liu Ru等[36]报道,超声处理的肌球蛋白的自由巯基含量随超声功率(100~250 W)的增加和超声时间(3~12 min)的延长而降低,这可能是由于敏感的自由巯基基团被超声产生的过氧化氢(由超声空化作用产生的一些瞬态自由基形成)所氧化。Chandrapala等[37]表明超声处理后乳清浓缩蛋白的自由巯基含量没有变化。以上实验中超声处理后自由巯基含量的差异可能是由于蛋白质变性程度、本身特性和超声条件等不同。
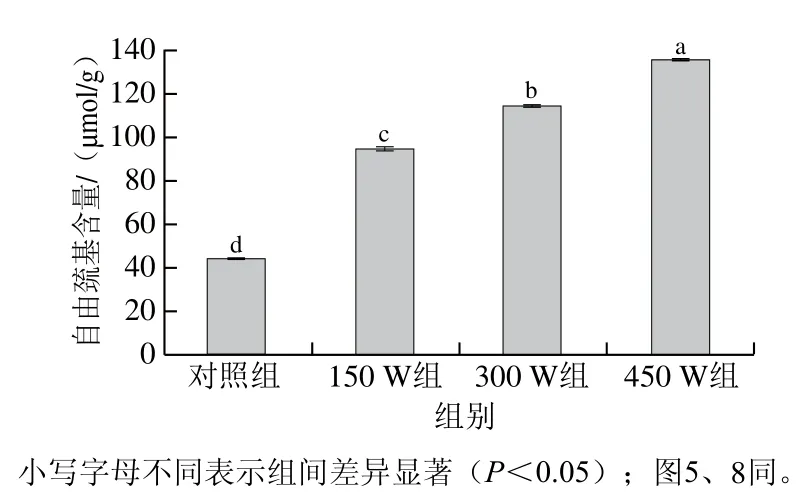
图4 不同超声功率处理对类PSE鸡肉分离蛋白自由巯基含量的影响Fig. 4 Effects of different ultrasonic power levels on the content of free sulfhydryl groups in PSE-like chicken protein isolate
2.4.2 超声对类PSE分离蛋白表面疏水性的影响
H0代表蛋白质表面疏水基团的数量,通常用来反映蛋白质构象的改变,也与蛋白质功能密切相关[37]。如图5所示,与对照组(517)相比,随着超声功率的增加,类PSE分离蛋白的H0显著增加(P<0.05)。同样,有研究表明鳕鱼分离蛋白、鲢鱼肌球蛋白、鸡肉肌原纤维蛋白等[10,36,38]的H0也随着超声强度增加或超声时间延长而增加。H0的增加可能是因为超声空化和物理剪切破坏蛋白质分子的部分疏水相互作用使蛋白质分子结构展开,暴露出分子内部的疏水基团[37],从而增加与ANS探针的结合位点。H0的变化趋势与自由巯基含量的变化趋势一致。
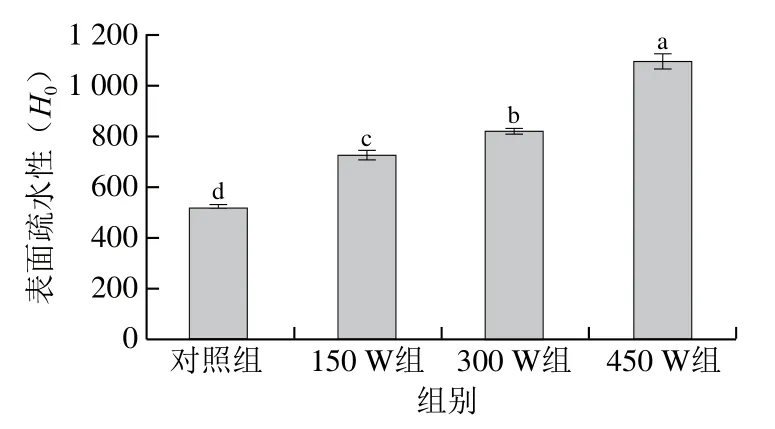
图5 不同超声功率处理对类PSE鸡肉分离蛋白表面疏水性的影响Fig. 5 Effects of different ultrasonic power levels on the surface hydrophobicity of PSE-like chicken protein isolate
2.4.3 超声对类PSE分离蛋白荧光强度的影响
荧光光谱法广泛用于评估蛋白质的三级结构变化,因为色氨酸/酪氨酸(Trp/Tyr)残基的内在荧光对微环境的极性极为敏感[39]。如图6所示,随着超声功率的增加,荧光强度明显增加,与对照组相比,450 W组类PSE分离蛋白的最大发射波长红移约3 nm。与对照组相比,超声处理后红移和荧光强度增加可能是由于蛋白质的解折叠,暴露出更多的Trp/Tyr残基和疏水基团,从而增加微环境中的非极性[21],这与H0的结果一致(图5)。这些结果表明超声处理后类PSE分离蛋白的构象被改变。Zou Ye等[29]也报道超声处理可以增强鸡肝中水溶性蛋白的荧光强度。
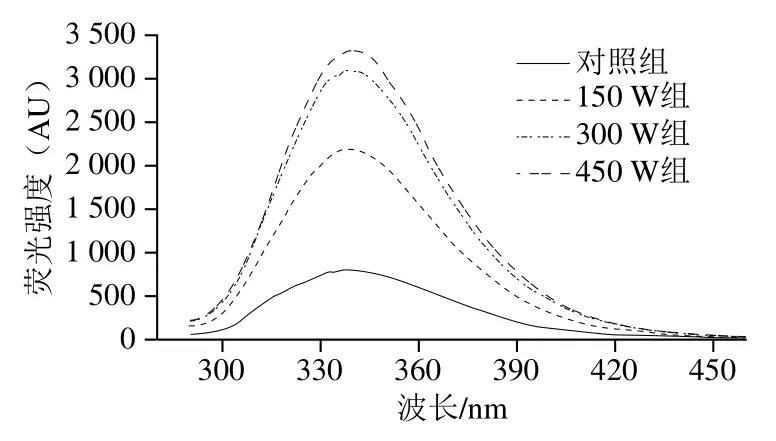
图6 不同超声功率处理对类PSE鸡肉分离蛋白荧光强度的影响Fig. 6 Effects of different ultrasonic power levels on the fluorescence intensity of PSE-like chicken protein isolate
2.5 超声对类PSE分离蛋白微观结构的影响
从图7A可以看出,对照组类PSE分离蛋白呈现大而不规则的形状。与对照组相比,超声处理后类PSE分离蛋白(图7B~D)呈现出更小和更松散的片状结构,这可能是由于超声空化作用使蛋白质结构展开。有研究指出,超声处理可以减小蛋白质的粒径并提高溶解度[33]。本研究中扫描电子显微镜观察结果与超声处理类PSE分离蛋白粒径(图1)和结构(图4~6)的变化一致。Jiang Lianzhou等[40]的研究也表明,超声处理的黑豆分离蛋白显示出更多的无序结构和不规则碎片。

图7 不同超声功率处理的类PSE鸡肉分离蛋白的扫描电子显微镜图Fig. 7 SEM of PSE-like chicken protein isolate under ultrasonic treatments at different powers
2.6 超声对类PSE分离蛋白溶解度的影响
在食品体系中,溶解度不仅是评价蛋白质物理化学性质的最佳指标,也是确定某些功能性质的基础,如凝胶和乳化能力。如图8所示,随着超声功率的增加,类PSE分离蛋白在去离子水中以及2%的盐(NaCl)溶液中的溶解度都显著增大(P<0.05)。与对照组相比,随着超声功率增加到450 W,去离子水和2%的盐溶液中蛋白的溶解度分别提高了1.17 倍和6.46 倍。去离子水中超声处理功率为450 W时蛋白的溶解度高于2%的盐溶液中对照组蛋白溶解度,表明一定功率的超声处理可以提高在降盐水平下类PSE分离蛋白的溶解度。蛋白质溶解度的升高可能是因为超声波的机械力破坏了蛋白质天然聚集形式的相互作用,促进可溶性蛋白质的形成[19]。此外,蛋白颗粒平均粒径降低(表1),表面积增加,会促进蛋白质与水之间的相互作用,从而导致类PSE分离蛋白溶解度的增加[38]。蛋白质溶解性的改善将有利于蛋白质乳化性能的提高。
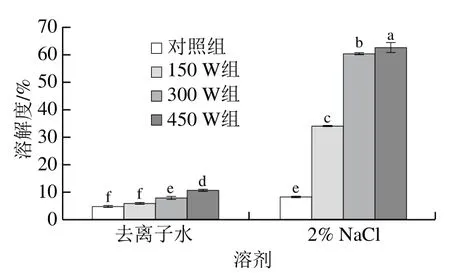
图8 不同超声功率处理对类PSE鸡肉分离蛋白溶解度的影响Fig. 8 Effects of different ultrasonic power levels on the solubility of PSE-like chicken protein isolate
2.7 超声对类PSE分离蛋白乳化特性的影响
EAI和ESI一般用来表征蛋白质的乳化特性,它们可以反映蛋白质帮助形成乳化体系及其稳定乳化体系的能力大小。如图9所示,超声处理样品的EAI显著高于对照组(P<0.05),这表明超声处理促进乳液的形成。随着超声功率的增加,蛋白质的EAI显著增加(P<0.05),超声后蛋白质的EAI最大值为24.23 m2/g。与对照组相比,超声功率为150、300、450 W时样品的ESI分别提高至16.06、30.45、31.7 min,表明超声处理可以提高乳液的稳定性。以上结果表明,超声能够改善类PSE分离蛋白的乳化特性。乳化特性的改善可能是由于超声处理使蛋白质粒径减小(图1和表1),粒径小的蛋白分子具有更大的分子迁移率来吸附在油-水界面周围或是因为超声处理诱导蛋白结构展开,暴露出更多的自由巯基和疏水基团增加蛋白的表面疏水性(图5),从而增强界面处蛋白之间的稳定性[41]。Amiri等[42]也发现,在不同的超声功率处理(100~300 W)30 min后,牛肉肌原纤维蛋白的EAI和ESI都显著增加。
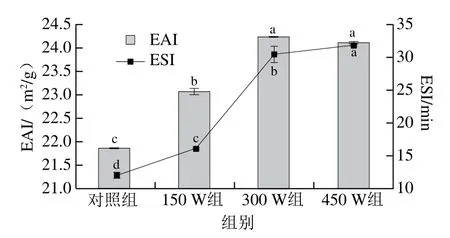
图9 不同超声功率处理对类PSE鸡肉分离蛋白EAI和ESI的影响Fig. 9 Effects of different ultrasonic power levels on the emulsifying activity index and emulsifying stability index of PSE-like chicken protein isolate
2.8 相关性分析和主成分分析
不同超声处理后类PSE分离蛋白的结构和乳化特性的Pearson’s相关性分析结果如图10A所示。类PSE分离蛋白的平均粒径与EAI(r=-0.959,P<0.01)、ESI(r=-0.713,P<0.01)呈极显著负相关,表明平均粒径较低的类PSE分离蛋白具有更好的乳化活性和乳化稳定性。EAI和ESI与α-螺旋相对含量、无规卷曲相对含量、自由巯基含量、荧光强度和表面疏水性呈极显著正相关(P<0.01),与β-折叠相对含量呈极显著负相关(P<0.01),表明蛋白质高级结构的改变有助于乳化特性的提高。这可能是由于超声改变了类PSE分离蛋白的构象,使蛋白构象解折叠和柔韧性增加,可以更容易地扩张并快速吸附在油-水界面,从而提高蛋白的乳化特性[43]。溶解度与EAI(r=0.759,P<0.01)和ESI(r=0.906,P<0.01)呈极显著正相关(P<0.01),表明溶解度的增加也有利于蛋白质乳化特性的改善。由此可以看出,超声处理后类PSE分离蛋白的结构、粒径和溶解度的改变,对其乳化特性有着显著和极显著的影响。
应用主成分分析法进一步分析了不同超声功率对类PSE分离蛋白结构和乳化特性的影响。主成分分析表明,PC1占总方差的87.4%,前两个主成分占总方差的97.8%,说明乳化特性(EAI和ESI)与结构之间的高度相关性。在载荷图(图10B)中,PC1主要与EAI、ESI、荧光强度、自由巯基含量、表面疏水性、α-螺旋相对含量、无规卷曲相对含量和溶解度等因子呈正相关,与粒径和β-折叠相对含量等因子呈负相关,这与图10A中相关性分析结果一致。PC2主要与β-折叠相对含量和EAI等因子呈正相关。如图10C所示,对照组和150 W组分布在PC1的负向端,而300、450 W组分布在PC1的正向端,450 W组在PC1的最右端且与对照组的距离最远,表明超声功率为450 W时对类PSE分离蛋白结构和乳化特性有显著的影响。综上,超声处理后类PSE分离蛋白乳化特性的提高与其结构的改变存在高度相关性。

图10 不同超声功率处理后类PSE鸡肉分离蛋白结构和乳化特性的Pearson’s相关性分析热图(A)、主成分分析载荷图(B)和因子评分图(C)Fig. 10 Heatmap of Pearson’s correlation analysis (A), PCA loading plots (B) and score plots (C) between the structure and emulsifying properties of PSE-like chicken protein isolate after ultrasonic treatments at different powers
3 结 论
本实验利用不同功率超声波处理类PSE分离蛋白,结果发现随着超声功率的增加,类PSE分离蛋白结构展开,暴露出更多的自由巯基、Trp/Tyr残基和疏水基团,从而增加蛋白质的疏水性,进而增加蛋白的EAI;同时蛋白粒径降低,溶解度提高,更多蛋白分子更容易吸附到油-水界面,增强了界面处蛋白之间的稳定性,使蛋白质ESI升高。超声处理能够改变类PSE分离蛋白的结构和物理性质,从而改善了类PSE分离蛋白的乳化特性,并且相关性分析和主成分分析表明蛋白质乳化特性的增加与其结构的改变显著相关。因此,超声处理提高类PSE分离蛋白功能特性,将有助于拓展应用超声波辅助酸碱洗处理提取利用类PSE鸡肉蛋白,可为类PSE分离蛋白在肉制品中的加工利用提供一定理论参考。
