HPV阳性宫颈癌患者血清miR-18a、miR-92a的表达及其与预后的关系*
2022-01-05玛依拉艾尼瓦尔汤新乐张裕祥
玛依拉·艾尼瓦尔,汤新乐,张裕祥
新疆医科大学第六附属医院检验科,新疆乌鲁木齐 830002
人乳头瘤病毒(HPV)的主要传播方式为性传播,多数女性在感染HPV后可自行清除,仍有部分患者无法完全清除,而当高危型HPV在机体长期处于高载量时,将会导致宫颈上皮内瘤变(CIN)或宫颈癌[1]。流行病学资料显示,2012年全球范围内约有52.76 万例新发宫颈癌患者及26.57万因宫颈癌死亡患者,且随着社会的发展,宫颈癌呈年轻化、高发病率的趋势[2-4]。近年来,手术、化疗、放疗等的综合治疗已成为早期宫颈癌的主要治疗方式,宫颈癌患者5年生存率可达90%,但对于晚期及复发性宫颈癌患者5年生存率仍不足20%和5%[5]。因此,探讨一种可用于指示宫颈癌发生及转归的特异性指标具有十分重要的意义。microRNA(miRNA)是一类长度为19~25个核苷酸的内源性非编码RNA,在转录后负性调控靶基因的表达,并在肿瘤的发生、发展及侵袭中具有一定的调控作用[6-7]。有研究表明,miR-18a及miR-92a在多种实体瘤中呈过表达,提示其可作为新型肿瘤标志物用于肿瘤诊断及预后评价[8-10]。宫颈癌作为实体瘤之一,是否这一类患者也存在血清miR-18a、miR-92a过表达,二者对HPV阳性宫颈癌诊断及评估预后的临床价值如何是笔者关注的重点之一。基于此,本研究拟分析HPV阳性宫颈癌患者血清miR-18a及miR-92a的表达,以及二者与预后的关系,旨在为临床上诊治HPV阳性宫颈癌患者提供相关依据。
1 资料与方法
1.1一般资料 选取2017年3月至2019年3月本院收治的79例HPV阳性宫颈癌患者为观察组,79例HPV阳性宫颈上皮内瘤变患者为对照组。观察组纳入标准:(1)经病理检查诊断为宫颈癌;(2)HPV检测为阳性,分型为HPV16型或18型;(3)未接受放射治疗、化疗及生物免疫治疗;(4)不存在其他恶性肿瘤或其他感染性疾病。对照组纳入标准:(1)HPV检测为阳性,分型为HPV16型或18型;(2)经病理检查诊断为宫颈上皮内瘤变;(3)近3个月内未接受过抗菌药物治疗;(4)近1周内无性生活史。两组排除标准:(1)合并免疫、内分泌等其他系统严重疾病;(2)处于经期或阴道不规则出血;(3)妊娠期或哺乳期女性;(4)依从性差,不能配合完成本研究;(5)既往有子宫手术史;(6)合并阴道炎或其他炎症性疾病;(7)近1年内接受过放疗、化疗及生物免疫治疗。所有纳入研究对象及其家属对本研究知情且同意,并签署知情同意书。本研究经本院医学伦理委员会批准。
1.2检测方法 所有研究对象于入组次日清晨空腹抽取静脉血5 mL。血液标本以3 000 r/min离心15 min,分离血清后提取总mRNA,采用反转录-聚合酶链反应(RT-PCR)法(Takara PCR试剂盒,日本Takara公司)检测各组miR-18a及miR-92a水平。引物设计及合成均由北京鼎国生物科技有限公司提供,引物序列见表1。miR-18a及miR-92a下游通用引物来自Mir-XTM miRNA First Strand反转录试剂盒(日本Takara公司)。根据反转录试剂盒进行反转录反应,根据SYBR RT-PCR试剂盒(日本Takara公司)说明书进行RT-PCR。反应体系:95 ℃ 预变性 30 s,95 ℃ 变性5 s,60 ℃ 退火30 s,循环35 次。采用2-ΔΔCt法检测各组miR-18a 和 U6基因相对表达量,内参为U6,每份标本重复检测3次,取平均值。

表1 引物序列
1.3观察指标 收集两组研究对象基线资料,并比较两组miR-18a及miR-92a水平。采用受试者工作特征(ROC)曲线分析血清miR-18a及miR-92a在诊断HPV阳性宫颈癌中的效能。比较不同年龄、病理类型、分化程度、肿瘤最大径、血管浸润、淋巴结转移、临床分期情况宫颈癌患者血清miR-18a及miR-92a水平。随访1年,观察组根据存活情况分为存活组和死亡组,比较两组miR-18a及miR-92a水平。分析miR-18a及miR-92a评估患者预后的效能。
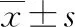
2 结 果
2.1观察组与对照组基线资料比较 观察组与对照组年龄、产次等基线资料比较,差异均无统计学意义(P>0.05)。见表2。
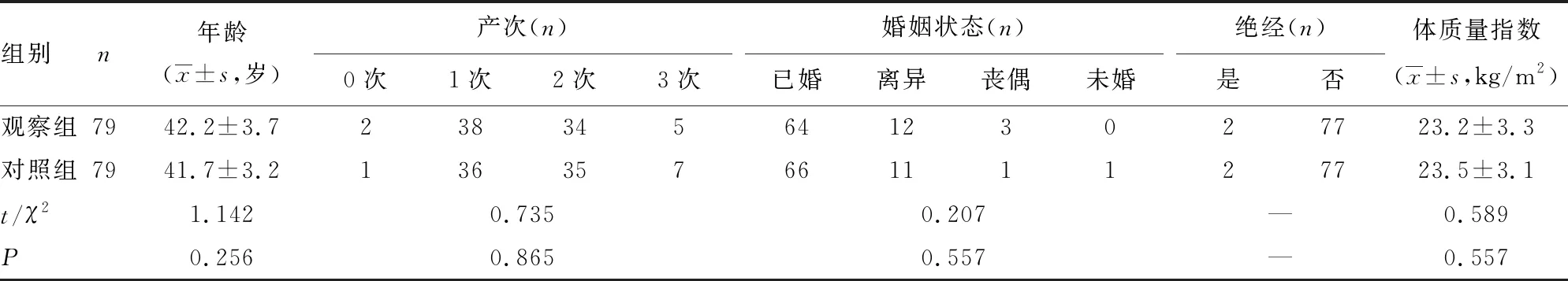
表2 观察组与对照组基线资料比较
2.2观察组与对照组血清miR-18a及miR-92a水平比较 与对照组比较,观察组血清miR-18a及miR-92a水平明显升高,差异有统计学意义(P<0.05)。见表3。
表3 观察组与对照组血清miR-18a及miR-92a水平比较
2.3不同特征HPV阳性宫颈癌患者血清miR-18a及miR-92a水平比较 HPV阳性宫颈癌患者中,与临床分期为Ⅰ~Ⅱ期、无淋巴结转移、血管浸润阴性的患者比较,临床分期Ⅲ期、有淋巴结转移、血管浸润阳性的患者miR-18a及miR-92a水平更高,差异均有统计学意义(P<0.05)。见表4。
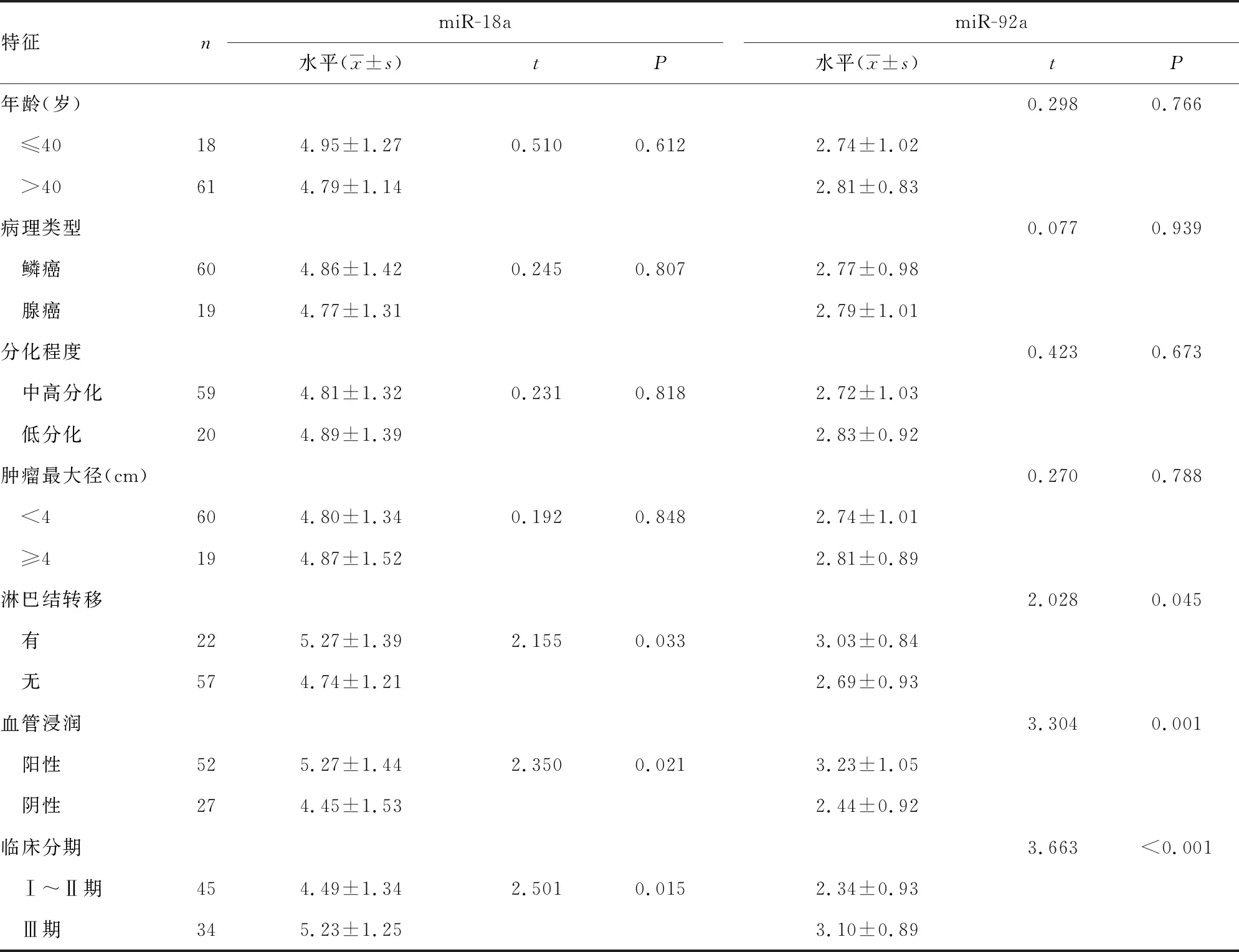
表4 不同特征HPV阳性宫颈癌患者血清miR-18a及miR-92a水平比较
2.4miR-18a及miR-92a水平对HPV阳性宫颈癌的诊断效能 当miR-18a截断值为3.161时,诊断HPV阳性宫颈癌的AUC为0.849(P<0.05);当miR-92a截断值为1.665时,诊断HPV阳性宫颈癌的AUC为0.827(P<0.05)。见表5、图1。

表5 miR-18a及miR-92a水平对HPV阳性宫颈癌的诊断效能
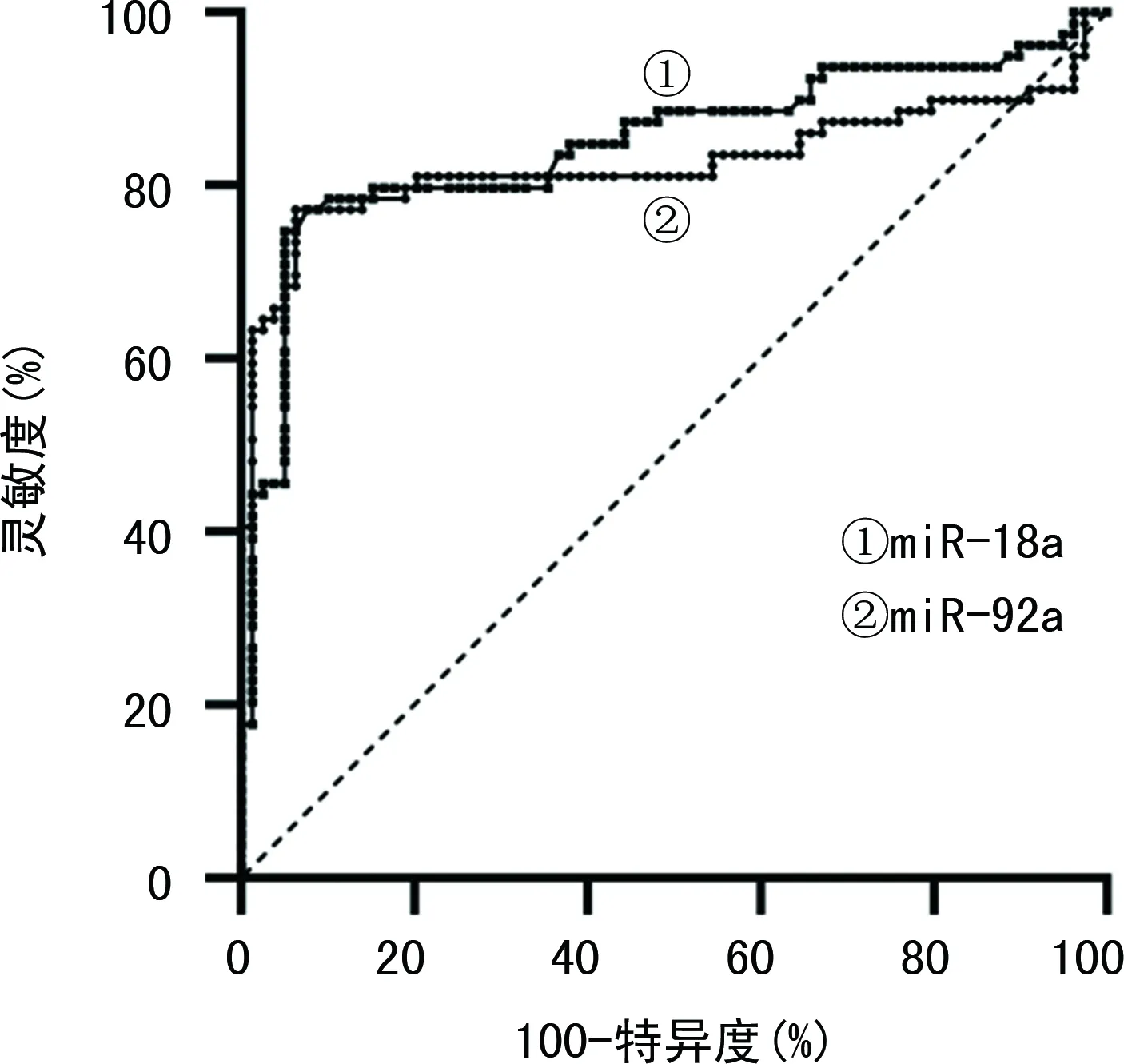
图1 miR-18a及miR-92a水平诊断HPV阳性宫颈癌的ROC 曲线
2.5存活组与死亡组血清miR-18a及miR-92a水平比较 与存活组比较,死亡组miR-18a及miR-92a水平更高,差异有统计学意义(P<0.05)。见表6。
表6 存活组与死亡组血清miR-18a及miR-92a水平比较
2.6miR-18a及miR-92a水平评估HPV阳性宫颈癌预后的效能 当miR-18a截断值为5.334时,评估HPV阳性宫颈癌预后的AUC为0.766(P<0.05);当miR-92a截断值为2.361时,评估HPV阳性宫颈癌预后的AUC为0.790(P<0.05)。见表7、图2。

表7 miR-18a及miR-92a水平评估HPV阳性宫颈癌预后的效能
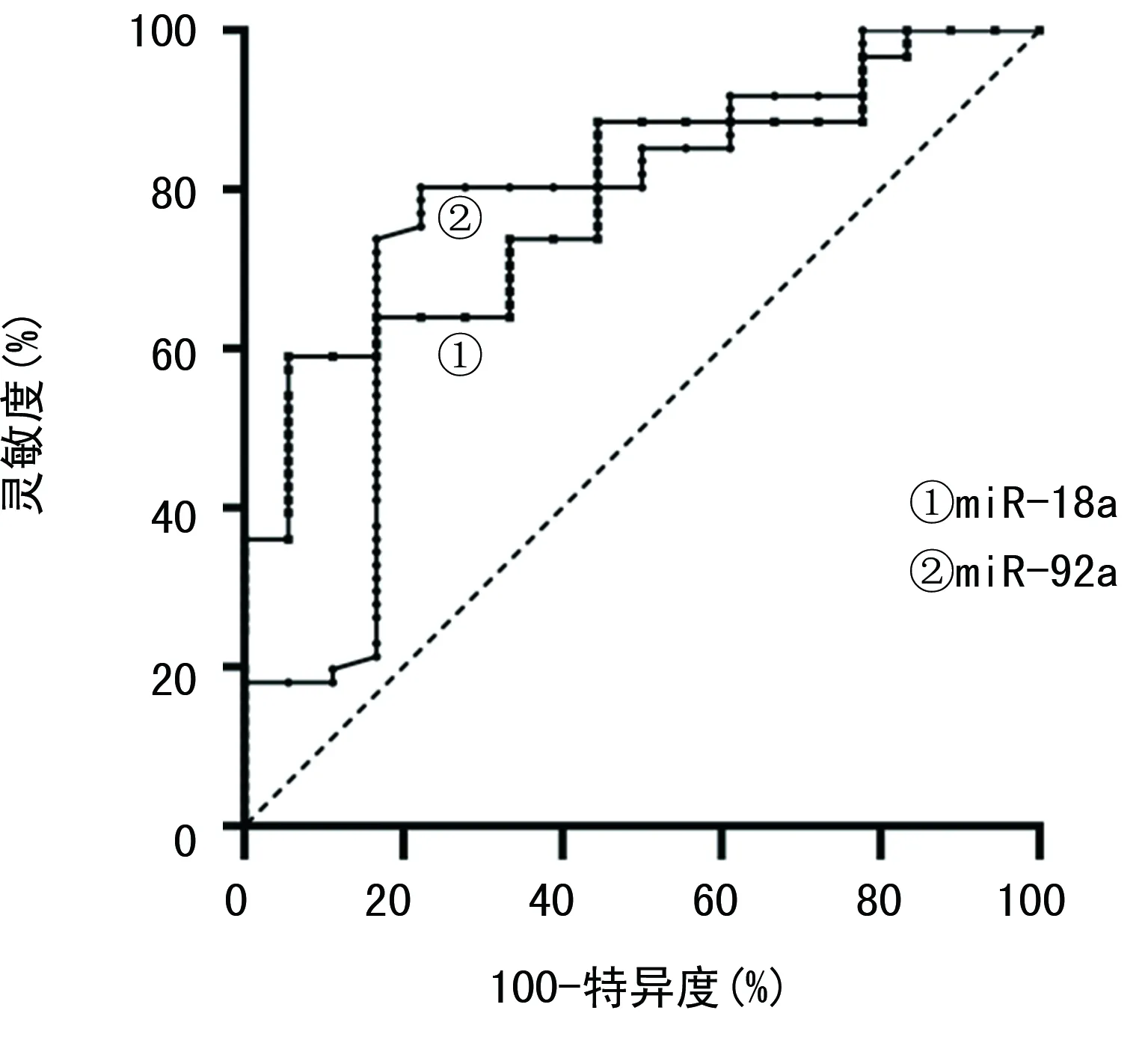
图2 miR-18a及miR-92a水平评估HPV阳性宫颈癌预后的ROC曲线
3 讨 论
宫颈癌的发生、发展与HPV感染、核苷酸多态性变化、染色体突变等因素密切相关[11-13]。随着医学的发展,对宫颈癌的分子生物学机制也有了深入研究。miRNA作为基因调控网络中的关键因素,其参与多个信号通路的调控。已有研究证实,miRNA与多种肿瘤细胞的增殖、分化、迁移等生物学行为密切相关,并参与肿瘤的发生、发展过程[14-15]。在一项多因素分析研究中,HPV感染,以及miR-18a、miR-92a水平的上升均为宫颈癌发生的独立危险因素[16]。但根据现有临床经验,HPV一过性感染比例较高,因此,通过HPV感染诊断宫颈癌的特异度较低。而miRNA以稳定、丰富的形式存在于血液中,因此,以血清为生物学标本,无创、操作简便,更易提高患者的依从性。
miR-18a属于miR-17-92基因簇成员,有研究表明,miR-18a可作为抑癌基因,通过调控其下游的靶基因进而抑制肿瘤细胞体外增殖,并诱导G1期阻滞,促进肿瘤细胞的凋亡[17-18]。但有研究发现,在乳腺癌、胶质母细胞瘤等多种肿瘤中,miR-18a的表达有所上升[19]。因此,miR-18在HPV阳性宫颈癌患者中是否表达异常是笔者探讨的重点之一。miR-92a作为miRNA家族成员之一,其参与多种肿瘤细胞的发生、发展,并与肿瘤恶性程度呈正相关[9]。本研究结果显示,相较于HPV阳性宫颈上皮内瘤变患者,HPV阳性宫颈癌患者血清miR-18a及miR-92水平均明显上升,这与既往研究结果一致,说明miR-18a及miR-92水平异常与HPV阳性宫颈癌发生关系密切。同时,本研究还发现,相较于临床分期为Ⅰ~Ⅱ期患者、无淋巴结转移、血管浸润阴性的患者,临床分期为Ⅲ期、有淋巴结转移、血管浸润阳性的患者miR-18a及miR-92a水平更高,这也说明血清miR-18a及miR-92a水平在一定程度上可反映宫颈癌恶性程度。本研究进一步通过ROC曲线分析了miR-18a及miR-92a水平在诊断HPV阳性宫颈癌患者中的临床价值,结果显示,当miR-18a截断值为3.161时,诊断HPV阳性宫颈癌的AUC为0.849(P<0.05);当miR-92a截断值为1.665时,诊断HPV阳性宫颈癌的AUC为0.827(P<0.05),说明miR-18a及miR-92a在诊断HPV阳性宫颈癌中均具有一定临床价值,血清miR-18a及miR-92a检测有望成为HPV阳性宫颈癌筛查的生物学标志物。目前,宫颈癌的发病率及病死率仍居高不下,且患者的预后较差,因此,探讨其预后指标对于临床上评估患者治疗措施的效果具有重要的临床意义。随访1年结果显示在HPV阳性宫颈癌患者中,死亡组血清miR-18a及miR-92a均明显高于存活组。ROC曲线结果显示:当miR-18a截断值为5.334时,评估HPV阳性宫颈癌预后的AUC为0.766(P<0.05);当miR-92a截断值为2.361时,评估HPV阳性宫颈癌预后的AUC为0.790(P<0.05)。提示血清miR-18a及miR-92a可作为评估HPV阳性宫颈癌患者预后的辅助指标。
综上所述,HPV阳性宫颈癌患者血清miR-18a及miR-92a水平明显上升,并在HPV阳性宫颈癌的诊断及预后评估中具有一定临床价值。
