联合检测血清CLU、NLRP3、FKN对老年2型糖尿病患者并发ASCVD的预测价值
2022-01-05李永利
孙 钧,贾 凡,李永利
1.武警北京总队医院检验与病理科,北京 100039;2.中国人民解放军总医院第五医学中心检验科,北京 100700
2型糖尿病(T2DM)是因胰岛素抵抗(IR)或胰岛素分泌不足而引起的一类慢性非传染性疾病[1]。动脉粥样硬化性心血管疾病(ASCVD)是指动脉血管粥样硬化病变导致血管狭窄或阻塞而引起的心血管疾病,为T2DM患者死亡的主要原因[2],因此,对T2DM患者并发ASCVD进行早期预测具有重要意义。T2DM并发动脉粥样硬化(AS)的机制复杂,主要与脂代谢紊乱、炎性反应、血管内皮损伤、氧化应激有关[3]。簇集蛋白(CLU)是一种分泌糖蛋白,广泛存在于机体多种组织中,研究发现,其参与了脂质运转和内皮细胞增殖等过程[4]。NOD样受体热蛋白结构域相关蛋白3(NLRP3)是一种细胞内蛋白复合体,参与内皮细胞损伤、炎性反应、代谢应激等过程[5]。分形趋化因子(FKN)是一种兼具黏附功能的趋化因子,可介导单核细胞黏附内皮细胞,引起内皮细胞功能紊乱,参与AS形成[6]。本研究分析了老年T2DM患者血清CLU、NLRP3、FKN水平变化,探讨3项指标与T2DM患者并发ASCVD的关系。
1 资料与方法
1.1一般资料 选取武警北京总队医院2018年7月至2020年4月收治的188例T2DM患者为研究对象,根据是否并发ASCVD将188例T2DM患者分为两组,并发ASCVD组72例;未并发ASCVD组116例。纳入标准:(1)T2DM符合《中国2型糖尿病防治指南(2017年版)》[7]的诊断标准;(2)ASCVD符合《冠状动脉粥样硬化性心脏病诊断标准(WS-319-2010)》[8]中相关诊断标准;(3)年龄≥65岁;(4)临床资料完整。排除标准:(1)合并血液系统疾病;(2)合并其他类型心脏病;(3)1型糖尿病或继发性糖尿病;(4)合并自身免疫性疾病;(5)合并其他慢性疾病;(6)合并急慢性感染;(7)近1个月内接受过他汀类药物治疗。另选取同期60例体检健康者纳入对照组,其中男43例,女17例;年龄65~85岁,平均(69.98±4.75)岁;体质量指数(BMI)为18~28 kg/m2,中位BMI为23 kg/m2。3组研究对象性别、年龄、BMI比较,差异无统计学意义(P>0.05)。所有研究对象对本研究知情同意,本研究经武警北京总队医院医学伦理委员会批准后进行。
1.2方法
1.2.1基础资料收集 收集T2DM患者基础资料,包括性别、年龄、BMI、病程、吸烟史、饮酒史。
1.2.2指标检测 采集T2DM患者入院后次日清晨5 mL空腹静脉血,采用迈瑞BS-480全自动生化分析仪检测血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)水平。采集T2DM患者餐后2 h静脉血3 mL,采用贝克曼库尔特全自动生化分析仪测定餐后2 h血糖(2 h PG)水平。采集T2DM患者入院后次日清晨空腹和体检健康者入院当日5 mL静脉血,3 000 r/min离心10 min,离心半径8 cm,分离血清,采用酶联免疫吸附试验(ELISA)法检测CLU、NLRP3、FKN水平,试剂盒由上海沪鼎生物科技有限公司提供,所有操作严格按照说明书进行。
2 结 果
2.13组血清CLU、NLRP3、FKN水平比较 对照组、未并发ASCVD组、并发ASCVD组血清CLU、NLRP3、FKN水平逐渐升高,两两比较,差异有统计学意义(P<0.05)。见表1。

表1 3组血清CLU、NLRP3、FKN水平比较
2.2并发ASCVD组与未并发ASCVD组基础资料比较 并发ASCVD组病程明显长于未并发ASCVD组,HDL-C、LDL-C、2 h PG、HbA1c水平明显高于未并发ASCVD组,差异有统计学意义(P<0.05)。见表2。

表2 并发ASCVD组与未并发ASCVD组基础资料比较[n/n或或n(%)或M(P25,P75)]
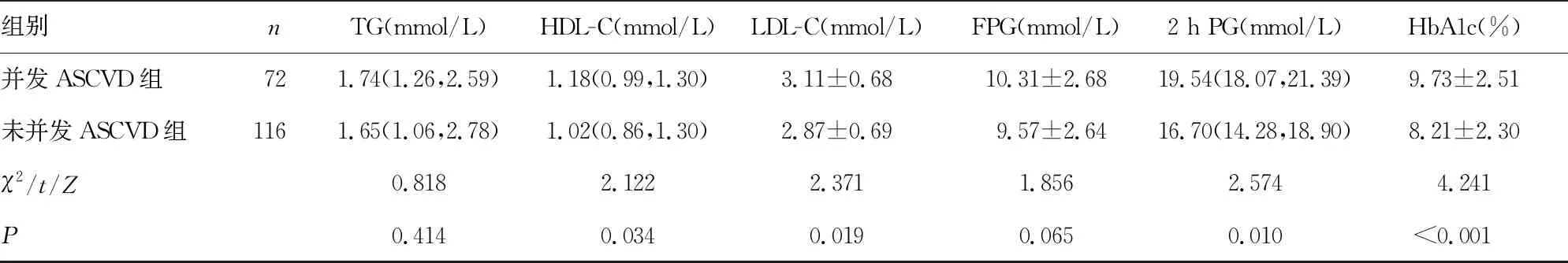
组别nTG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)FPG(mmol/L)2 h PG(mmol/L)HbA1c(%)并发ASCVD组721.74(1.26,2.59)1.18(0.99,1.30)3.11±0.6810.31±2.6819.54(18.07,21.39)9.73±2.51未并发ASCVD组1161.65(1.06,2.78)1.02(0.86,1.30)2.87±0.699.57±2.6416.70(14.28,18.90)8.21±2.30χ2/t/Z0.8182.1222.3711.8562.5744.241P0.4140.0340.0190.0650.010 <0.001
2.3T2DM并发ASCVD的多因素Logistic回归分析 以病程(≥10年=1,<10年=0)、HDL-C、LDL-C、2 h PG、HbA1c、CLU、NLRP3、FKN为自变量,是否并发ASCVD为因变量(是=1,否=0),采用多因素Logistic回归分析显示,高水平LDL-C、HbA1c、CLU、NLRP3、FKN为T2DM并发ASCVD的独立危险因素(P<0.05)。见表3。
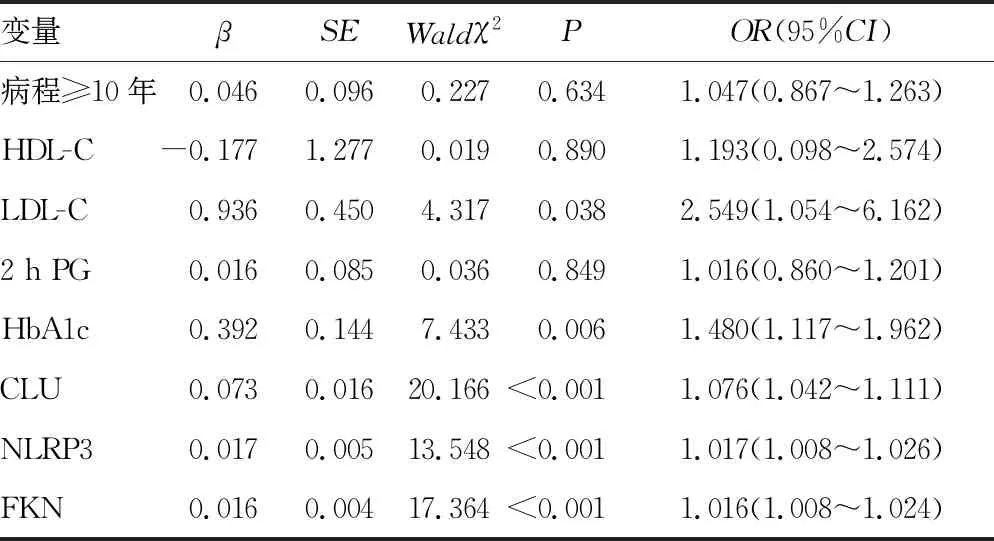
表3 T2DM并发ASCVD的多因素Logistic回归分析
2.4血清CLU、NLRP3、FKN水平对T2DM并发ASCVD的预测价值 ROC曲线分析结果显示,CLU、NLRP3、FKN联合检测预测T2DM并发ASCVD的AUC明显大于CLU、NLRP3、FKN单独检测(Z=3.606、3.916、3.728,P<0.05),灵敏度和特异度也高于CLU、NLRP3、FKN单独检测。见表4、图1。
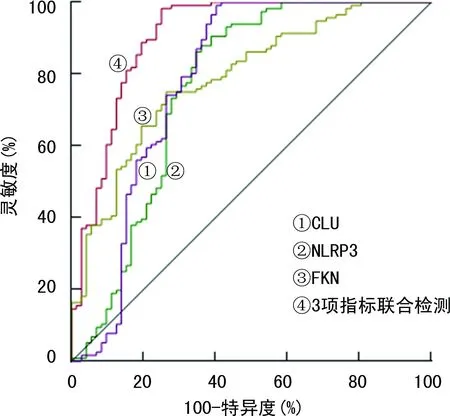
图1 血清CLU、NLRP3、FKN预测T2DM并发ASCVD的ROC曲线
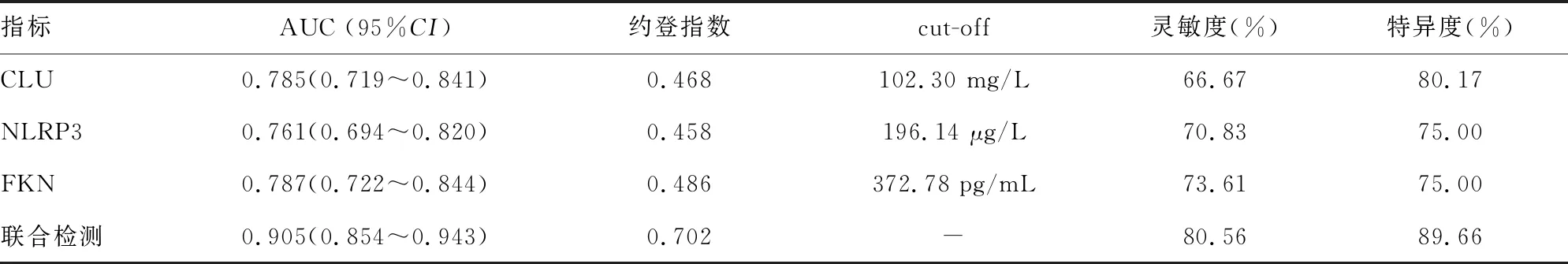
表4 血清CLU、NLRP3、FKN水平对T2DM并发ASCVD的预测价值
3 讨 论
ASCVD是导致T2DM患者死亡的主要原因,同非糖尿病患者相比,糖尿病患者发生ASCVD的风险成倍增加,且年龄更小、病变范围更广泛、预后更差。研究发现,单纯的降糖治疗并不能明显降低T2DM患者发生ASCVD的风险[2]。这是因为ASCVD发生不仅与T2DM患者高血糖有关,还与脂代谢紊乱、炎性反应、内皮细胞功能、氧化应激等因素有关,因此,评估T2DM患者并发ASCVD的危险因素至关重要,可为临床早期预测ASCVD提供参考,指导T2DM患者治疗,改善预后。
CLU又称为载脂蛋白J,在人体组织和体液中广泛分布,其启动子包含激活蛋白-1、激活蛋白-2、转化生长因子-β等多种调控元素,根据其涉及组织和细胞因子不同,参与细胞膜保护、脂质转运、补体调节、细胞凋亡等作用[4]。SCHWARZ等[9]通过免疫组化技术分析发现,正常动脉内没有CLU表达,而AS不同阶段的动脉均可见CLU表达,且随着病变加重而升高,尤其在泡沫细胞中CLU表达升高,提示CLU可能参与了AS发生及发展。近年来研究发现,敲除CLU基因后,血管平滑肌细胞增殖和内膜增生速度明显减缓,当CLU过表达时则会促进血管平滑肌细胞增殖和内膜增生,参与AS发生,同时发现CLU也可作为氧化应激和炎性反应的蛋白生物传感器,通过瘦素、C反应蛋白参与氧化应激和炎性反应,促进AS进展[10]。另外有研究显示,急性冠状动脉综合征患者血清CLU水平明显升高,与冠状动脉狭窄程度相关[11]。本研究结果显示,未并发ASCVD组血清CLU水平明显高于对照组,差异有统计学意义(P<0.05),说明CLU可能参与了T2DM发生,可能与CLU具有调节组织对胰岛的敏感性和胰岛素抵抗有关[12]。进一步分析发现,并发ASCVD组血清CLU水平较未并发ASCVD组升高,为T2DM并发ASCVD的独立危险因素(P<0.05),说明CLU参与了ASCVD发生、发展,分析与CLU可介导瘦素、C反应蛋白参与AS发生有关。但也有研究发现,CLU可促进单核/巨噬细胞源性泡沫细胞胆固醇、磷脂转运,改善AS[13],但AS早期可见CLU高表达[9],因此,对于CLU在脂质转运中的作用尚不明确。
NLRP3是一种由半胱天冬酶-1、凋亡相关斑点样蛋白、核受体蛋白组成的复合体,当NLRP3被激活后,可引起同型PYD-PYD区域交互,募集凋亡相关斑点样蛋白,使其聚合成为大斑点结构,促进pro-半胱天冬酶-1聚合催化为半胱天冬酶-1,半胱天冬酶-1又可活化pro-白细胞介素-1β、pro-白细胞介素-18,裂解为白细胞介素-1β、白细胞介素-18,参与人体免疫炎性反应过程[14]。有研究显示,T2DM患者血清NLRP3表达明显升高,参与了患者下肢AS进展[15]。本研究结果显示,未并发ASCVD组血清CLU水平明显高于对照组,差异有统计学意义(P<0.05),分析原因为T2DM患者在高糖的刺激下激活NLRP3,导致NLRP3大量分泌。本研究结果还显示,ASCVD组血清NLRP3水平较未并发ASCVD组进一步升高,为T2DM并发ASCVD的独立危险因素(P<0.05),分析原因为NLRP3可分泌大量白细胞介素-1β和白细胞介素-18,参与炎性反应,损伤血管内皮,诱导AS形成,同时过度炎性反应也会使巨噬细胞发展成为促炎型巨噬细胞,促进AS发展。
FKN为CX2C趋化因子中唯一已知超家族成员,其存在形式可分为两种,生理状态下,FKN趋化结构域通过柄样结构黏蛋白连接于细胞膜表面,为膜结合型FKN;特定状态下,蛋白水解酶水解细胞表面,可释放可溶性FKN[16]。单核细胞为AS形成过程中泡沫细胞的前体细胞,单核细胞和白细胞穿越血管向炎性反应部位移行,大量聚集释放氧自由基、细胞因子、蛋白水解酶,加重血管内皮损伤,两者向炎性反应部位移行时均需要趋化因子和黏附分子参与[17]。最初研究认为,FKN是一种趋化因子,后续发现其独特的黏蛋白样杆状结构凸出于细胞膜表面,易于黏附流动,因此,FKN在发挥趋化效应的同时还能诱导内皮细胞活化,促进单核细胞、白细胞黏附活化的内皮细胞,进而影响内皮细胞功能[18]。ROWINSKA等[19]分别对两组小鼠进行促AS饮食,结果发现,敲除FKN基因小鼠的平滑肌细胞增殖数量和AS明显减少,说明FKN参与了AS形成。本研究结果显示,对照组、未并发ASCVD组、并发ASCVD组血清FKN水平逐渐升高,血清FKN水平升高为T2DM并发ASCVD的独立危险因素(P<0.05),提示FKN可通过炎性反应损伤血管内皮功能,促进AS发生。进一步分析结果显示,CLU、NLRP3、FKN联合检测预测T2DM并发ASCVD的AUC、灵敏度、特异度均高于CLU、NLRP3、FKN单独检测,说明联合检测血清CLU、NLRP3、FKN有助于更准确地预测T2DM患者ASCVD发生。
综上所述,T2DM患者血清CLU、NLRP3、FKN水平明显升高,3项指标均为T2DM患者并发ASCVD的独立危险因素,联合检测可提升对ASCVD预测价值。
