LncRNA TUG1靶向miR-222-3p对肺炎链球菌诱导的人肺泡上皮细胞损伤的影响
2022-01-05李小丽张庆军
李小丽,王 辉,张庆军
应急总医院呼吸内科,北京 100028
肺炎在全球发病率非常高,患者康复时间长且病死率高[1]。肺炎链球菌是一种机会性病原体,定植在人类上呼吸道的黏膜表面,通过局部扩散、吸入或播种等方式到达血液中,引起肺炎等疾病[2-4]。因此,了解肺炎链球菌感染过程涉及的分子途径对于预防和治疗肺炎至关重要。越来越多的研究显示,长链非编码RNA(LncRNA)是多种人类疾病诊断的潜在生物标志物[5-6]。LncRNA牛磺酸上调基因1(TUG1)通过抑制微小RNA(miRNA)-127,保护脂多糖(LPS)诱发的MRC-5细胞损伤,在肺炎中显示出较好的治疗效果[6]。TUG1通过海绵miR-590-5p/FGF1促进哮喘患者气道平滑肌细胞的增殖和迁移,并减少了细胞凋亡[7]。miR-222-3p在肺炎支原体肺炎患儿中高表达,可能是诊断肺炎支原体肺炎和判断患者预后的生物标志物[8]。但TUG1对肺炎链球菌感染的人肺泡上皮细胞(HPAEpiC细胞)凋亡的影响,以及miR-222-3p是否介导其作用过程,目前尚未明确。因此,本研究以肺炎链球菌感染HPAEpiC细胞构建肺损伤模型,并评估TUG1在该模型中的影响,除此之外,还探讨了TUG1和miR-222-3p之间的调控关系,同时评估miR-222-3p在TUG1影响细胞损伤中的作用,揭示TUG1的潜在作用机制,为治疗肺炎提供新的依据。
1 材料与方法
1.1仪器与试剂 72株HPAEpiC细胞(美国ScienCell),肺炎链球菌-3型(美国菌种保藏中心),Lipofectamine 2000、TUG1小干扰RNA(Si-TUG1)、阴性对照siRNA(Si-NC,美国Invitrogen),miR-222-3p、miR-NC、anti-miR-222-3p、anti-miR-NC(上海吉玛),PrimeScript RT试剂盒、SYBR Green Premix Ex Taq(大连Takara),miRcute miRNA qPCR检测试剂盒(北京Tiangen),膜联蛋白V(Annexin V)-FITC/PI试剂盒(上海Beyotime),牛血清蛋白、总蛋白提取试剂盒(上海Solarbio),硝酸纤维素膜(美国Millipore),PGL3报告基因载体、双荧光素酶报告基因检测系统(美国Promega)。
1.2方法
1.2.1细胞培养与肺炎链球菌感染 HPAEpiC细胞在含有10%胎牛血清的Dulbecco改良Eagle培养基(DMEM)/F12中于37 ℃、5% CO2的湿润环境下培养。肺炎链球菌在含脱纤维羊血(5%)的血平板中培养。感染时,采用1×108CFU/mL肺炎链球菌(提前12 h在含0.5%酵母的托休二氏溶液中培养)感染HPAEpiC细胞48 h[9]。
1.2.2细胞分组与处理 HPAEpiC细胞分为对照(NC)组、肺炎链球菌组、肺炎链球菌+Si-NC组、肺炎链球菌+Si-TUG1组、肺炎链球菌+miR-NC组、肺炎链球菌+miR-222-3p组、肺炎链球菌+Si-TUG1+anti-miR-NC组、肺炎链球菌+Si-TUG1+anti-miR-222-3p组。NC组HPAEpiC细胞未做任何处理;肺炎链球菌组HPAEpiC细胞以1×108CFU/mL肺炎链球菌感染;肺炎链球菌+Si-NC组、肺炎链球菌+Si-TUG1组、肺炎链球菌+miR-NC组、肺炎链球菌+miR-222-3p组的HPAEpiC细胞分别转染Si-NC、Si-TUG1、miR-NC、miR-222-3p,肺炎链球菌+Si-TUG1+anti-miR-NC组、肺炎链球菌+Si-TUG1+anti-miR-222-3p组共转染Si-TUG1+anti-miR-NC、Si-TUG1+anti-miR-222-3p,转染后24 h,以1×108CFU/mL肺炎链球菌感染。HPAEpiC细胞转染时,按照制造商的操作规程,将HPAEpiC细胞在六孔板上预孵育至40%~60%汇合,然后与寡核苷酸或siRNA及Lipofectamine 2000一起孵育进行转染。
1.2.3实时定量PCR检测TUG1、miR-222-3p表达 根据制造商的规程,通过TRIzol试剂从HPAEpiC细胞中提取总RNA。使用PrimeScript RT试剂盒进行cDNA合成。使用SYBR Green Premix Ex Taq和miRcute miRNA qPCR检测试剂盒在ABI 7500系统上进行实时定量PCR检测。GAPDH和U6充当内源性对照。引物序列为TUG1正向5′-GGACACAATTCGCCACGACTT-3′,反向5′-GCGCAGTCCCAGATTCCA-3′;GAPDH正向5′-AGAAGGCTGGGGCTCATTTG-3′,反向5′-AGGGGCCATCCACAGTCTTC-3′。miR-222-3p正向5′-AGCTACATCTGGCTACTGG-3′,反向5′-GTATCCAGTGCAGGGTCC-3′;U6正向5′-CTC GCTTCGGCAGCACA-3′,反向5′-TGGTGTCGT GGAGTCG-3′。
1.2.4流式细胞术检测细胞凋亡 借助Annexin V-FITC/PI试剂盒检测HPAEpiC细胞凋亡(1×105个细胞/孔)。将500 μL结合缓冲液与HPAEpiC细胞悬液混合。然后,添加5 μL Annexin V-FITC并保持5 min,随后添加5 μL PI并在黑暗中于室温下反应10 min。使用Beckman Coulter流式细胞仪检测细胞凋亡水平。
1.2.5Western blotting检测蛋白表达 使用总蛋白提取试剂盒提取总蛋白,并使用二辛可宁酸方法对HPAEpiC细胞蛋白进行定量。制备分离凝胶(10%)和浓缩凝胶(5%),每个孔中加入20 μL蛋白样品,进行SDS-PAGE,电泳结束,在3 mA下2 h完成硝酸纤维素膜的转移。室温下用5%牛血清清蛋白封闭膜2 h。将一抗Bcl2相关X蛋白(Bax蛋白,1∶3 000稀释)和B细胞淋巴瘤/白血病2(Bcl2蛋白,1∶3 000稀释)与膜在4 ℃条件下孵育过夜,然后,将其与HRP标记二抗(1∶5 000稀释)在室温下混合2 h,采用增强化学发光法(ECL)化学发光保持30 min后,再采用Image-Pro Plus软件进行蛋白水平分析。
1.2.6双荧光素酶报告实验 含有miR-222-3p结合位点的野生型(WT)-TUG1/突变型(MUT)-TUG1序列被扩增并克隆到PGL3报告基因载体中。将HPAEpiC细胞接种到六孔板中后培养过夜,并与WT-TUG1/MUT-TUG1报告基因质粒和miR-222-3p/miR-NC共转染。转染后48 h,萤火虫和海肾荧光素酶活性使用双荧光素酶报告基因检测系统测量。针对海肾荧光素酶基因的活性对数据进行标准化。
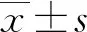
2 结 果
2.1肺炎链球菌感染对HPAEpiC细胞中miR-222-3p和TUG1表达的影响 肺炎链球菌感染前后,肺炎链球菌组HPAEpiC细胞中TUG1表达量为(0.43±0.03),约为NC组(1.03±0.02)的0.42倍,肺炎链球菌组miR-222-3p表达量为(2.30±0.09),约为NC组(1.01±0.03)的2.28倍,差异均有统计学意义(t=18.790,P<0.001;t=13.860,P<0.001)。
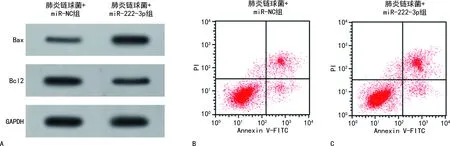
2.2转染TUG1对肺炎链球菌诱导的HPAEpiC细胞凋亡的影响 肺炎链球菌组和肺炎链球菌+Si-NC组HPAEpiC细胞的TUG1表达量均低于NC组,凋亡率、Bax蛋白表达量均高于NC组,Bcl2蛋白表达量低于NC组,差异均有统计学意义(P<0.05)。肺炎链球菌+Si-TUG1组HPAEpiC细胞的TUG1表达量低于肺炎链球菌+Si-NC组,凋亡率、Bax蛋白表达量均高于肺炎链球菌+Si-NC组,Bcl2蛋白表达量低于肺炎链球菌+Si-NC组,差异均有统计学意义(P<0.05)。见图1、表1。
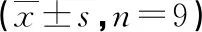
表1 转染TUG1对肺炎链球菌诱导的HPAEpiC细胞凋亡的影响
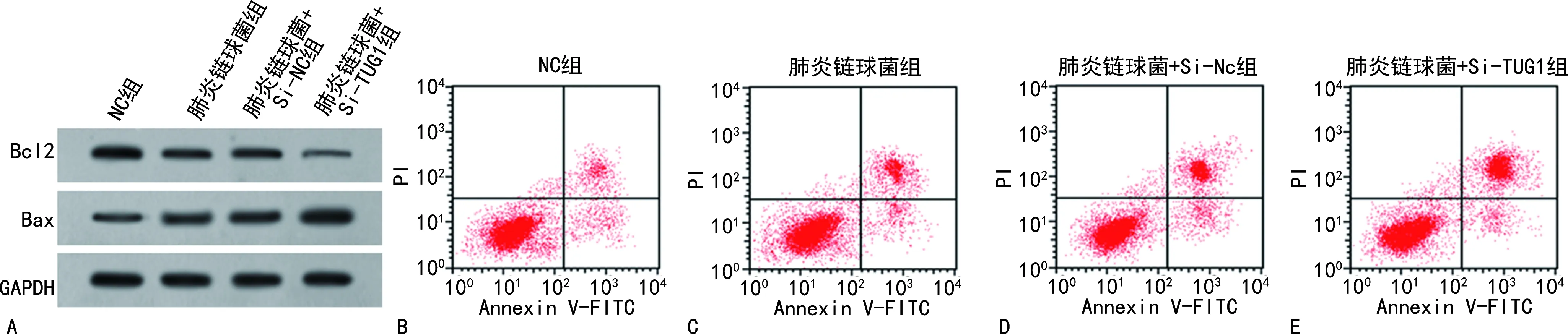
注:A为蛋白质电泳图;B、C、D、E均为流式凋亡图。
2.3TUG1靶向调控miR-222-3p的表达 miR-222-3p与TUG1含有靶向结合的核苷酸序列,生物信息学预测结果见图2。miR-222-3p与WT-TUG1共转染的荧光素酶活性(0.46±0.03)是miR-NC与WT-TUG1共转染的荧光素酶活性(1.00±0.01)的0.46倍,差异有统计学意义(t=18.960,P<0.001);而miR-222-3p、MUT-TUG1共转染的荧光素酶活性(1.00±0.02)与miR-NC、MUT-TUG1共转染的荧光素酶活性(1.02±0.03)比较,差异无统计学意义(t=0.429,P=0.674)。
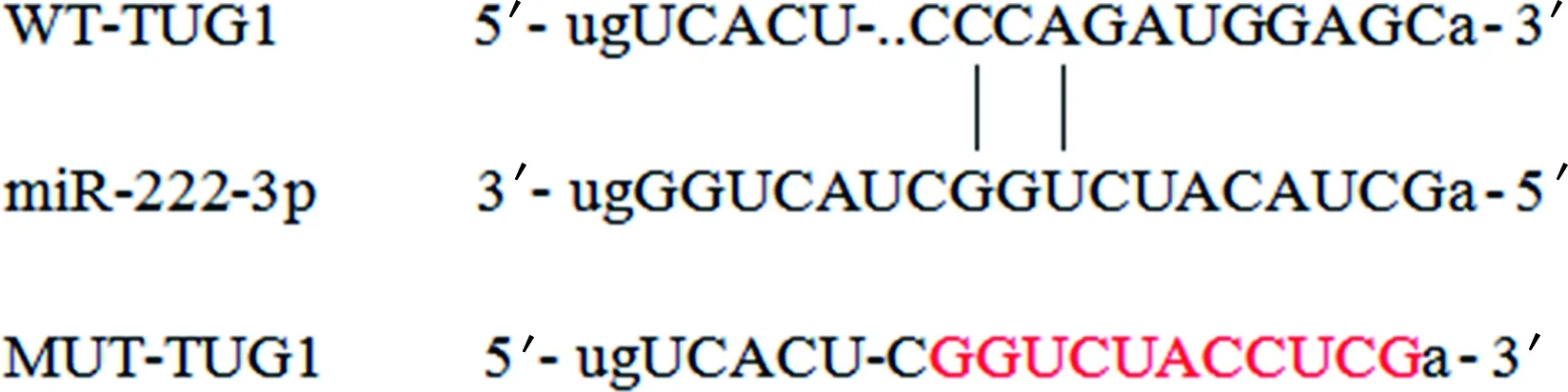
图2 miR-222-3p含有与TUG1靶向结合的位点
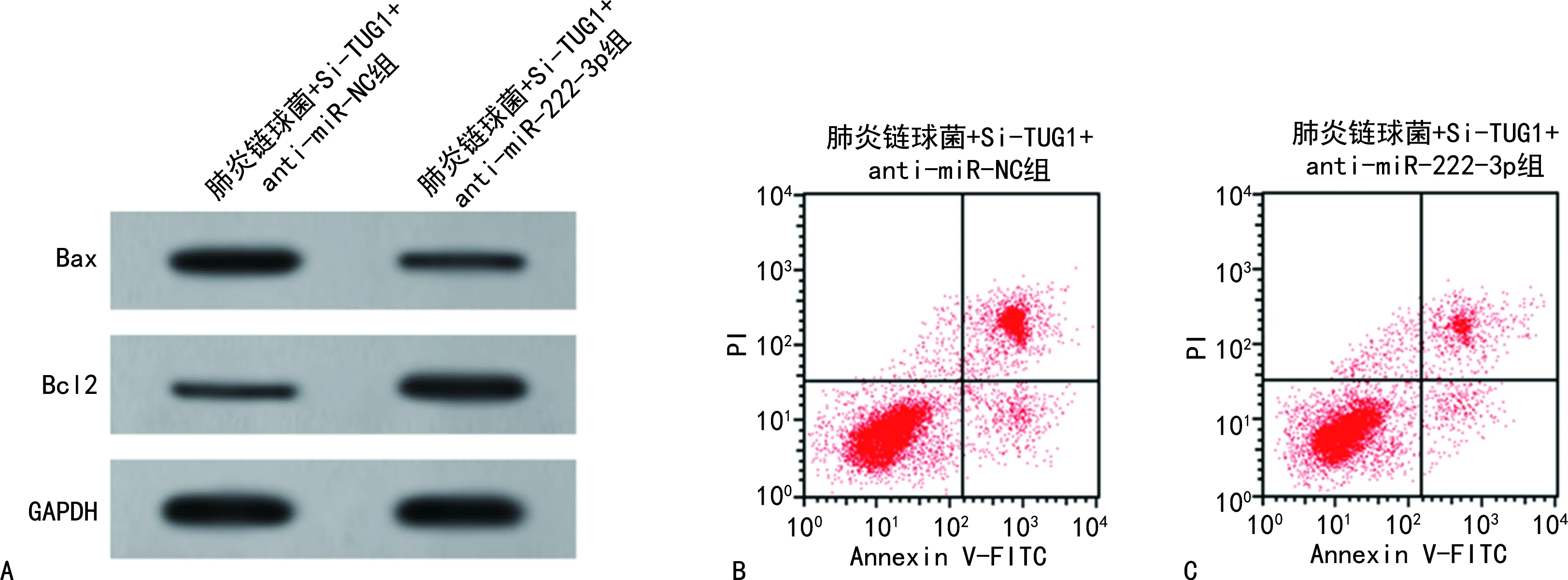
2.4过表达miR-222-3p对肺炎链球菌诱导的HPAEpiC细胞凋亡的影响 肺炎链球菌+miR-222-3p组HPAEpiC细胞的miR-222-3p表达量、凋亡率、Bax蛋白表达量比肺炎链球菌+miR-NC组高,且Bcl2蛋白表达量比肺炎链球菌+miR-NC组低,差异均有统计学意义(P<0.05)。见图3、表2。
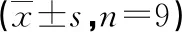
表2 肺炎链球菌+miR-NC组和肺炎链球菌+miR-222-3p组的miR-222-3p、凋亡率、凋亡蛋白比较
2.5干扰miR-222-3p表达部分逆转TUG1对肺炎链球菌诱导的HPAEpiC细胞凋亡的影响 与肺炎链球菌+Si-TUG1+anti-miR-NC组比较,肺炎链球菌+Si-TUG1+anti-miR-222-3p组HPAEpiC细胞中miR-222-3p表达量、凋亡率和Bax蛋白表达量降低,Bcl2蛋白表达量升高,差异有统计学意义(P<0.05)。见图4、表3。
注:A为蛋白质电泳图;B、C均为流式凋亡图。
注:A为蛋白质电泳图;B、C均为流式凋亡图。
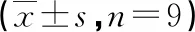
表3 肺炎链球菌+Si-TUG1+anti-miR-NC组与肺炎链球菌+Si-TUG1+anti-miR-222-3p组的miR-222-3p、凋亡率、凋亡蛋白比较
3 讨 论
本研究探讨了TUG1对肺炎链球菌感染的HPAEpiC细胞的影响,结果发现,肺炎链球菌触发了HPAEpiC细胞凋亡。此外,干扰TUG1加速了肺炎链球菌诱发的HPAEpiC细胞凋亡。另外,干扰miR-222-3p表达部分逆转干扰TUG1对肺炎链球菌诱导的HPAEpiC细胞凋亡的影响。
TUG1已被广泛应用于各种癌症研究中,包括肾细胞癌[10]、前列腺癌[11]、胃癌[12]、结肠癌[13]。越来越多的证据证实TUG1在多种癌症病理、生理过程中均发挥了特定的生物学功能。例如,一项研究表明,过表达的TUG1通过减弱细胞凋亡和炎性反应来保护小鼠免受寒冷诱导的肝损伤[14]。此外,研究表明,在LPS引起的MRC-5细胞损伤中,TUG1减轻了细胞凋亡,下调Bax蛋白表达而上调Bcl2蛋白表达,机制与调控miR-127有关[6]。在哮喘大鼠模型中,沉默TUG1可增加哮喘中气道平滑肌细胞的凋亡,而TUG1过表达抑制细胞凋亡[7]。然而,目前研究尚未揭示TUG1是否能保护HPAEpiC细胞免受肺炎链球菌触发的细胞损伤。本研究观察到,TUG1在肺炎链球菌感染的HPAEpiC细胞中低表达,干扰TUG1能明显促进肺炎链球菌诱导的HPAEpiC细胞凋亡。同时,干扰TUG1可诱导促凋亡蛋白Bax蛋白的表达并抑制抗凋亡蛋白Bcl2蛋白的表达。这些数据均提示,TUG1对HPAEpiC细胞中肺炎链球菌触发的细胞凋亡具有抑制作用。
miRNA通过控制参与组织发育和再生的多个信号和转录因子的表达,已成为病理过程的关键调节剂[15]。根据报道,在胃癌[16]、肾细胞癌[17]、非小细胞肺癌[18]和宫颈癌[19]患者中,miR-222-3p表达增加。然而,在卵巢癌[20]及严重心肌纤维化患者中观察到较低的miR-222-3p水平[21]。可见在不同疾病患者中,miR-222-3p表达不同。研究显示,与正常椎间盘组织比较,椎间盘退变组织中的miR-222-3p明显增加;miR-222-3p过表达明显增加了髓核细胞的凋亡并减少其增殖,miR-222-3p的下调可抑制髓核细胞凋亡并诱导增殖;miR-222-3p会加速椎间盘退变的发展[22]。本研究发现,肺炎链球菌感染使HPAEpiC细胞miR-222-3p表达上调,与以往研究报道一致[8]。更重要的是,miR-222-3p过表达可以增加肺炎链球菌诱导的HPAEpiC细胞凋亡,同时上调促凋亡蛋白Bax蛋白,下调抗凋亡蛋白Bcl2蛋白。上述数据与以往的研究部分相似[22],提示miR-222-3p可能加重肺炎链球菌感染的HPAEpiC细胞损伤。
本研究的生物信息学预测表明,TUG1序列中存在假定的miR-222-3p结合位点。双荧光素酶报告实验结果揭示了miR-222-3p为TUG1的靶标,TUG1可以靶向调控miR-222-3p的表达。但miR-222-3p是否影响TUG1对肺炎链球菌感染的HPAEpiC细胞损伤的保护活性仍然未知。本研究进一步观察到,干扰miR-222-3p表达后,干扰TUG1促进肺炎链球菌诱导的HPAEpiC细胞凋亡的作用被部分逆转。表明TUG1通过靶向调控肺炎链球菌感染的HPAEpiC细胞中miR-222-3p的表达,减轻细胞凋亡。
综上所述,TUG1通过靶向miR-222-3p对肺炎链球菌感染的HPAEpiC细胞起保护活性。这些发现可能为肺炎链球菌感染的肺炎提供一种新的治疗方法。
