瓣膜赘生物组织均质处理后病原体培养方法研究
2022-01-05刘玉磊
刘玉磊,蒋 晔
1.首都医科大学附属北京安贞医院检验科,北京 100029;2.首都医科大学附属北京同仁医院检验科,北京 100069
感染性心内膜炎(IE)是一种罕见病,主要由病原体感染心内膜所致,容易累及心脏瓣膜,特征性损伤为心脏瓣膜的赘生物生成,其临床表现的多样性给临床医生的诊断及治疗带来了很大的困难,年发生率为1.5/100 000~9.6/100 000,致死率约为25%,具有非常高的院内病死率和长期病死率[1-2]。目前,临床诊断IE的证据主要包括患者临床症状,体征,感染性标志物,胸或食管超声心动图、CT、核磁共振等影像学结果,二代测序、血及赘生物培养等病原学检查结果等[3-6]。目前,导致IE的病原体包括革兰阳性(G+)球菌(以链球菌、金黄色葡萄球菌为主)、革兰阴性(G-)菌(HACEK等)、真菌(念珠菌为主)及巴尔通体等[7-10]。IE主要的治疗手段分为以使用抗菌药物为主的内科治疗和以瓣膜修复或置换为主的外科治疗[4,11-12],其中术后赘生物培养结果与抗菌药物使用方案及术后复发率有关,不充分的抗菌药物治疗会导致瓣膜置换术后感染复发,具有极高的病死率[10,13-15]。但目前赘生物培养病原体检出率很低,如何充分释放赘生物内病原体,提高病原体检出率是临床急需解决的问题[3,16]。因此,本研究探讨了组织均质前处理赘生物标本适宜条件,验证组织均质处理临床标本的使用效果,以期提高赘生物标本的病原体检出率。
1 材料与方法
1.1标本来源 收集2020年1-12月首都医科大学附属北京安贞医院感染性心内膜炎患者外科手术中切除的心脏瓣膜赘生物30份。
1.2仪器与试剂 麦氏比浊仪(法国生物梅里埃)、组织均质仪(杭州奥盛)、生物安全柜(ESCO)、二氧化碳细菌培养箱(Thermo Fisher Scientific)、微生物鉴定质谱仪(Bruker)、显微镜(NIKON)。细菌鉴定培养液(BD);无菌拭子;金黄色葡萄球菌菌株;大肠埃希菌菌株;近平滑念珠菌菌株;艾肯菌菌株;戈登链球菌菌株;组织均质管;304不锈钢大钢珠(R=5 mm)、小钢珠(R=3 mm);无菌手术剪;无菌手术钳;组织研磨器;血琼脂增菌平板(OXOID);巧克力平板(郑州安图生物);脑心浸液增菌肉汤、脑心浸液琼脂平板、脑心浸液琼脂培养液(广州迪景)。
1.2方法
1.2.1质量控制 整个研究过程遵循以下措施保证实验的质量。实验前进行手部卫生消毒和安全柜使用前的乙醇喷拭;实验器材和耗材进行134 ℃ 8 min压力蒸汽灭菌,通过灭菌指示卡和芽孢杆菌灭菌效果监测,保证高压灭菌器的灭菌效果;实验耗材(钢珠、组织均质管、手工组织研磨器)每批次进行无菌试验;每批次脑心浸液增菌肉汤和分离培养用平板进行验证菌株的生长实验和无菌实验;制订实验中组织均质管破碎后的生物安全应急处理流程和预案(立即停止组织均质,静置20 min后,打开组织均质的盖子用乙醇喷洒、擦拭)。
1.2.2实验方法 (1)组织均质前处理赘生物标本适宜条件的探索和验证。①定量培养稀释度的确认:用金黄色葡萄球菌做定量培养稀释度确认。取菌株到5 mL鉴定培养液中调整菌量麦氏浊度为1,然后取10 μL菌液加入10 mL的鉴定培养液中,调整为1∶1 000稀释的工作菌液。取10 μL工作菌液按连续划线法接种到血平板上进行定量培养,37 ℃培养24 h后观察,验证分离菌落与理论菌落(3 000 cfu)的一致性。取100 μL的1麦氏浊度菌液加入9 900 μL的麦氏浊度管中,调整为1∶100稀释工作菌液。然后取10 μL工作菌液按连续划线法接种到血平板上进行定量培养,37 ℃培养24 h后观察,验证分离菌落与理论菌落(33 000 cfu)的一致性。选择适宜的稀释倍数(后文称之为“原稀释菌液”)进行菌株存活情况验证。②不同条件菌株存活率验证:配制金黄色葡萄球菌、戈登链球菌、大肠埃希菌、近平滑念珠菌、艾肯菌5种细菌的鉴定培养液。每次准备16支组织均质管,分为4组,管内依次加入2个大钢珠、3个小钢珠、2个大钢珠,然后加入0.5 mL提前配制好的鉴定培养液,将每组的4支均质管分别标记-80 ℃、-20 ℃、4 ℃及常温(RT),放入对应的冰箱中静置30 min。取出不同温度的均质管进行均质模拟处理。均质处理程序为3个循环,每个循环停顿10 s(inter),采用不同的4个速度和时间,分别为6 m/s 1 min 30 s、6 m/s 1 min、4 m/s 1 min 30 s、4 m/s 1 min。取模拟均质处理后的菌液10 μL,定量接种在分离培养血平板上,同时取10 μL原稀释菌液进行定量培养。35 ℃ 24 h后观察菌落形成数量(cfu),验证不同模拟条件处理时细菌存活情况。③不同条件组织破碎效果验证:选择菌株存活数无明显差异的模拟均质处理条件进行组织破碎效果的验证。在组织均质管内加入顺序为2个大钢珠、3个小钢珠、赘生物组织、2个大钢珠,加入500 μL鉴定培养菌液。不同的均质程序进行均质处理后,肉眼观察和涂片显微镜观察赘生物组织的破碎程度。按组织破碎效果最佳、菌株存活数无明显降低的均质程序进行临床心脏瓣膜赘生物组织的均质处理。(2)临床赘生物标本的均质处理。临床送检的新鲜心脏瓣膜赘生物组织标本同时进行3种不同的前处理,分别为均质仪均质处理、剪刀剪碎处理和研磨管手工研磨处理。收到的瓣膜赘生物标本用无菌手术剪将病变部位平均剪成3块,每块直径大约为5 mm,要尽可能地使每一块都含有明显病变的组织或钙化组织。①均质前处理:在均质管中依次放入2个大钢珠、3个小钢珠,然后放入其中一小块剪下的赘生物组织,再放入2个大钢珠,然后加入0.5 mL的脑心浸液琼脂培养液,盖紧管盖后放入-20 ℃冰箱中,30 min后取出进行均质处理,均质处理程序为6 m/s 1 min。经前期标本验证发现,仅需2个循环就可以将组织充分破碎,在后续实验中均调整为2个循环。均质处理后,取组织匀浆10 μL定量接种在血琼脂平板、巧克力平板和脑心浸液琼脂平板上进行直接分离培养,CO2孵育箱35 ℃ 培养24 h后进行菌落观察和鉴定。同时,再取匀浆涂8张玻片,分别进行革兰染色1张、抗酸染色1张、真菌荧光染色1张、瑞氏染色1张,剩余4张作为备片使用。涂片染色后,先用×10显微镜观察染色是否均匀,有无真菌孢子及菌丝等较大病原体,然后再转换到×100油镜下观察是否有链球菌、G+球菌、G-球菌、G-杆菌及G+球杆菌。剩余组织匀浆全部转移入脑心浸液琼脂培养液中进行增菌培养,然后次日进行分离培养,分离培养的培养基和条件同均质后直接分离培养。②手工研磨前处理:取第2块剪出的赘生物组织,用无菌手术剪尽可能剪碎后放入手工研磨器中,同时加入0.5 mL脑心浸液琼脂培养液一起进行手工研磨。充分研磨后,将全部研磨后组织液用无菌吸管转换到脑心浸液琼脂培养液中进行增菌培养,次日进行分离培养,培养基及条件同上。③手工剪碎处理:取第3块剪出的赘生物组织,用无菌手术剪尽可能剪碎后,转移入脑心浸液琼脂培养液中进行增菌培养,次日进行分离培养,培养基及条件同上。(3)分离培养和镜检。临床标本采用不同方法进行病原体检测,比较不同方法或组合的病原体检出率。①直接培养:标本不进行任何前处理,脑心浸液增菌培养后进行分离培养;②剪碎培养:将标本尽可能剪碎成为细小颗粒(直径1~2 mm)后,脑心浸液进行增菌培养后,再进行分离培养;③研磨培养:手工组织研磨器(管)研磨的标本进行增菌培养后,再进行分离培养;④均质直接培养:组织均质前处理后,直接取匀浆进行分离培养;⑤均质增菌培养:组织均质前处理后,匀浆转移入脑心肉汤增菌培养,然后进行分离培养;⑥均质后镜检:均质处理后的组织标本(匀浆)进行涂片、革兰染色和显微镜镜检观察病原体。(4)病原体种属鉴定。分离培养有病原体生长时,利用全自动微生物鉴定质谱仪进行病原体(细菌、真菌)的种属鉴定。质谱鉴定方法按照实验室标准操作程序进行。有真菌生长时,通过棉兰染色进行形态学鉴定。
2 结 果
2.1稀释倍数的选择 1∶100的稀释倍数在培养基上形成的菌落过于密集,而1∶1 000的稀释倍数能够形成密度适中的菌落,采取此倍数验证均质处理后菌落的存活情况。
2.2不同均质条件下病原体的存活率 初次实验验证,金黄色葡萄球菌在6 m/s 1 min 30 s各温度下均未长菌,所以后续实验的其他5种菌株筛除了此转速条件。其中金黄色葡萄球菌在各转速及温度条件下生长情况与原稀释菌液无明显差异。戈登链球菌筛除了6 m/s 1 min中的-80 ℃和RT条件。大肠埃希菌筛除了6 m/s 1 min中的-80 ℃条件。近平滑念珠菌筛除了6 m/s 1 min中的4 ℃和RT条件。艾肯菌只有在6 m/s 1 min中-80 ℃和-20 ℃、4 m/s 1 min 30 s中-20 ℃和4 m/s 1 min中-80 ℃和-20 ℃条件下生长无明显差异。不同均质程序下验证菌株存活结果见表1。

表1 5种均质程序验证菌株在不同均质程序下的存活情况(cfu)
2.3不同均质条件组织破碎效果及细菌存活情况 4 m/s 1 min 30 s和4 m/s 1 min条件下组织未被均匀打碎,管内仍有1~2 mm的组织块。而6 m/s 1 min条件下组织被均匀打成泥浆泡沫状,模拟赘生物标本处理时实验菌株的存活情况见表2。

表2 加入赘生物标本后不同条件下模拟菌株存活情况(cfu)
2.4临床赘生物标本均质处理后培养、镜检结果 30份临床赘生物标本经过不同前处理程序进行处理后,分离培养出的病原体包括凝固酶阴性葡萄球菌、肠球菌、棒杆菌、链球菌、念珠菌、莫拉菌、青霉菌、曲霉菌、芽孢杆菌(可疑污染菌)。部分标本疑似存在处理前标本采集送检过程中的污染,部分标本在手工研磨处理过程中存在污染的现象。研磨后镜检可直接观察检出的病原体包括G+球菌、G+链球菌、真菌、G+杆菌等。革兰染色镜检可见较多染成阳性的沉渣,疑似钢珠在研磨过程中剧烈碰撞导致材质脱落造成。30份临床心脏瓣膜赘生物标本均质后培养、镜检结果见表3。
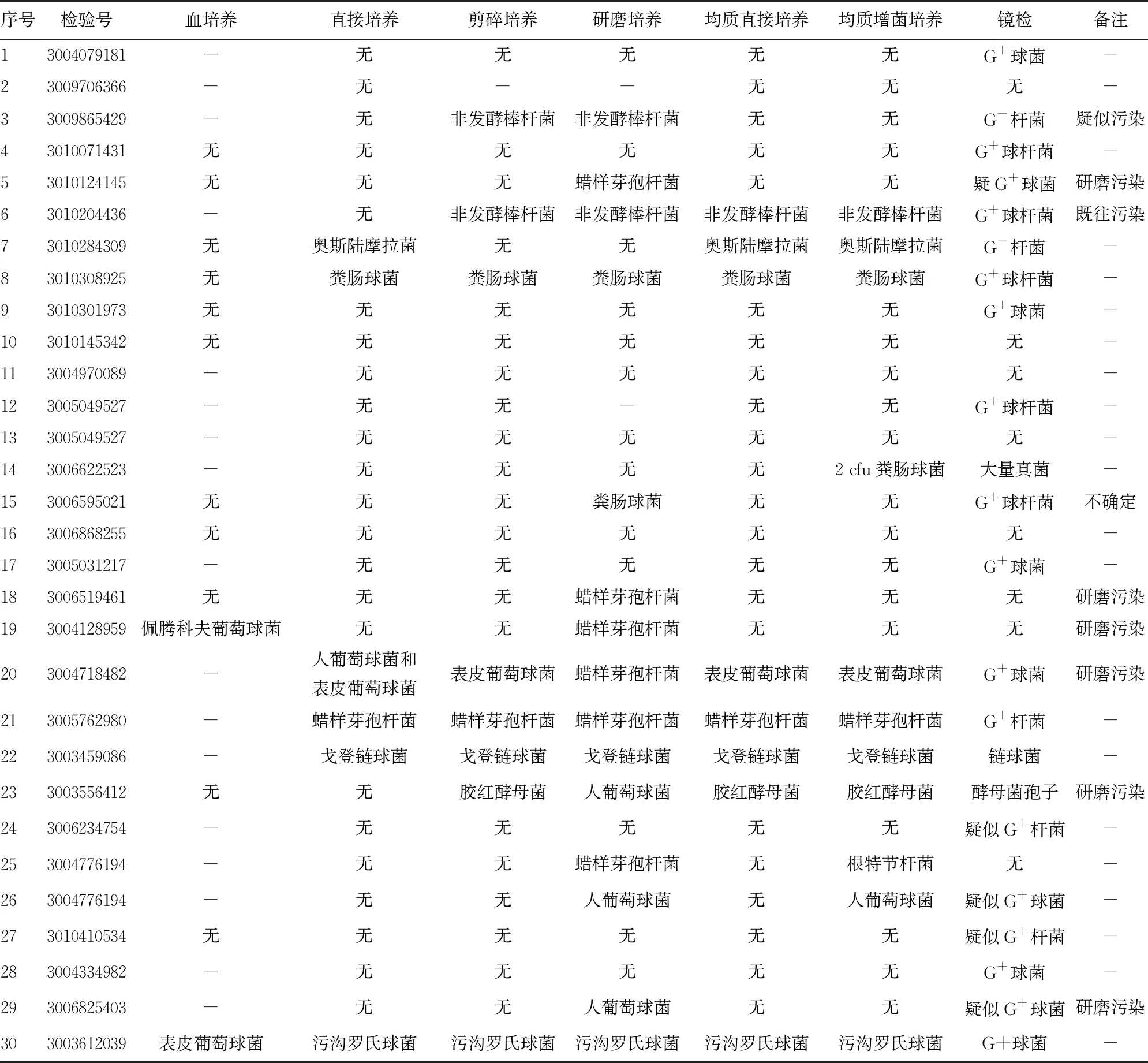
表3 30份临床赘生物标本均质处理后培养、镜检结果
均质直接培养的阳性率较研磨培养升高,可达23.3%。均质增菌培养阳性率可达36.7%。均质后增菌培养联合镜检阳性率高达76.7%。不同前处理方法病原体检出情况见表4。
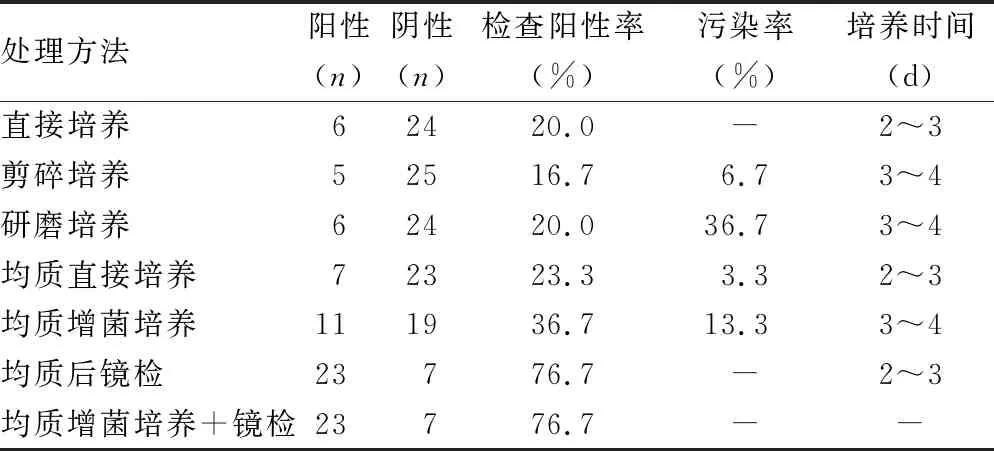
表4 赘生物标本不同前处理条件病原体检出结果
处理的30份标本中,研磨培养阳性6例,阴性24例,均质增菌培养阳性11例,阴性19例,均质增菌培养联合镜检阳性23例,阴性7例。研磨培养与均质增菌培养病原体阳性率分别为20.0%、36.7%,差异有统计学意义(χ2=2.052,P=0.126)。研磨培养与均质增菌培养联合镜检的病原体阳性率分别为20.0%、76.7%,差异有统计学意义(χ2=17.954,P<0.001)。
3 讨 论
目前,在心脏瓣膜赘生物标本或其他人体组织标本微生物培养前处理方面,尚无足够的研究明确最佳的组织前处理方案。仅在人工假体等骨科组织标本前处理中,超声波前处理、表面研磨处理、酶消化处理、化学物质处理等方案有极少的研究证明不同的前处理方法细菌培养阳性率差异较大[17-19]。本研究中,针对心脏瓣膜标本,探索了不同的前处理程序,以提高瓣膜赘生物标本微生物培养阳性率及病原体检出率。
均质条件探索实验证明,6 m/s 1 min;-20 ℃条件是处理临床瓣膜标本的适宜条件。此条件下病原体存活数最多,可以将组织完全被打碎,使得组织内的病原体得到充分释放,而且组织均质管也无破碎情况,并且只有在-20 ℃下细菌存活数与原稀释菌液无明显差异,其他温度下,细菌可能受温度或高或低的影响而死亡。但在6 m/s 1 min 30 s时,4种温度(-80 ℃、-20 ℃、4 ℃、RT)条件下组织均质管均有出现管壁或管底破碎的情况,可能由于在6 m/s 1 min 30 s条件下转速过高导致。在-80 ℃其他转速条件下也会出现均质管破碎情况,原因可能是均质管温度过低,脆性提高,在均质处理过程中,均质管温度又急剧升高,温差突然的改变导致管壁破碎。所以后期尚需改进以下几点:(1)工业化均质在临床应用时应加入温控系统进行简化操作,适应不同生物学特性的病原体,提高菌株存活率;(2)选择优质耗材(均质管),提高均质管条件耐受范围。
均质增菌培养联合镜检的方法能够明显提高病原体检出率。均质处理心脏瓣膜赘生物可降低手工操作污染率,同时组织充分破碎,病原体充分释放。均质化处理后显微镜镜检可发现一些不可培养的病原体,并可根据镜检结果选择和调整培养条件,从而提高病原检出率。均质增菌培养病原检出率最高,但是报告时间相对延长(1 d)。仍需改进的是镜检中镜下会有沉渣影响,沉渣由钢珠在均质过程中互相剧烈碰撞,材质破碎所致,后续实验可以更换更加优质的钢珠,或用瓷珠代替。另外,均质前处理方法相对手工研磨来说,污染率已经大大减少,但实验过程中污染问题仍是存在的,例如将组织放入组织均质管的过程中,取均质后增菌培养液进行分离培养接种时,依旧有可能会被污染,所以这些步骤中应尽可能地去规范实验操作,避免污染。
研磨培养与均质增菌培养标本结果相比,差异无统计学意义(P>0.05),可能是因为本次试验入组的标本量过少导致,组织标本较多的实验室可进一步增加样本量,进行统计分析。由于部分病原体镜检观察可见而培养阴性,导致均质增菌培养联合镜检与研磨培养相比,病原体检出率明显升高。例如部分病原菌营养要求较高,实验室内无法培养或部分病原体在使用抗菌药物后已死亡导致培养阴性。
综上所述,推荐临床组织标本进行均质前处理。感染性心内膜炎心脏瓣膜赘生物的特性是纤维结缔组织致密,部分瓣膜存在“钙化”情况,不易通过手工研磨或酶消化处理释放内部的病原体,并且手工研磨或剪碎处理不能够将病原体充分释放。而均质处理的优点在于耗材成本低,手工操作流程少,标本被污染的概率降低,临床瓣膜组织标本得到充分破碎,使得组织内的病原体充分释放,提高了病原体的检出率和镜检阳性率,适用于外科手术量大的临床医院,节省时间,且方便快捷。
