植物类黄酮的生理功能与抗菌机制
2022-01-05任建敏
任 建 敏
(重庆工商大学 环境与资源学院,重庆 400067)
病原微生物自从起源以来,作为人类发病率和死亡率的主要原因,一直威胁人类健康。在1930年代人类发现青霉素与磺胺类药物前,尽管人类尝试不同种类植物提取物抗传染病产生了各种结果[1-2],但除了毒砷,这还是唯一抗传染病的方法。
过去几十年,抗生素在治疗细菌和真菌引起的传染病中发挥了重要作用,但由于它们在医学、兽医,特别是农业领域不负责任、不适当或过度被使用,导致其耐药菌株持续产生,已对人类健康构成严重威胁[3]。同时,自1970年代以来,开发或获得批准的抗生素锐减[4],寻找新的抗菌药物迫在眉睫。
类黄酮是一大类植物药效成分之一,具有抗氧化、抗炎、抗过敏、抗癌、抗病毒和抗真菌等特性[5],在国内外民间医学中,用于抗菌与治疗人类疾病,已被其活性成分制剂成功使用所支持。如万寿菊,含六羟黄酮阿拉伯半乳糖苷,在阿根廷民间广泛用于治疗各种传染病[6]。菅属花提取物包含甘草黄酮C和Derrone,对革兰氏阳性和革兰氏阴性细菌有抗菌活性。雏菊,含有大量类黄酮如芹菜素、山柰酚、木犀草素、槲皮素及各类黄酮苷,在伊朗民间广泛用作消毒剂和治疗某些疾病[7]。
植物来源的药物临床使用悠久,到目前已试验约100 000种植物的药用价值[8-9],在患者中有良好的耐受和接受性,似乎是抗菌药物可靠来源之一[3]。从类黄酮成分中筛选抗菌活性成分是国内外研究的热点。
1 类黄酮化合物的结构
类黄酮化学结构由A和B两苯环通过中央三碳连接含C6-C3-C6框架的系列化合物。根据中央三碳是否构成C环及C环不饱和与氧化程度、B环与C环连接位置等特点,类黄酮可以分成黄酮(图1)、异黄酮(图2)、黄酮醇(图3) 黄烷醇(也称为儿茶素,图4)、黄烷酮(图5)、黄烷酮醇(图6)、查尔酮、二氢查耳酮(图7)、花青素和橙酮各子类(图8)[10]。其化学结构如下:
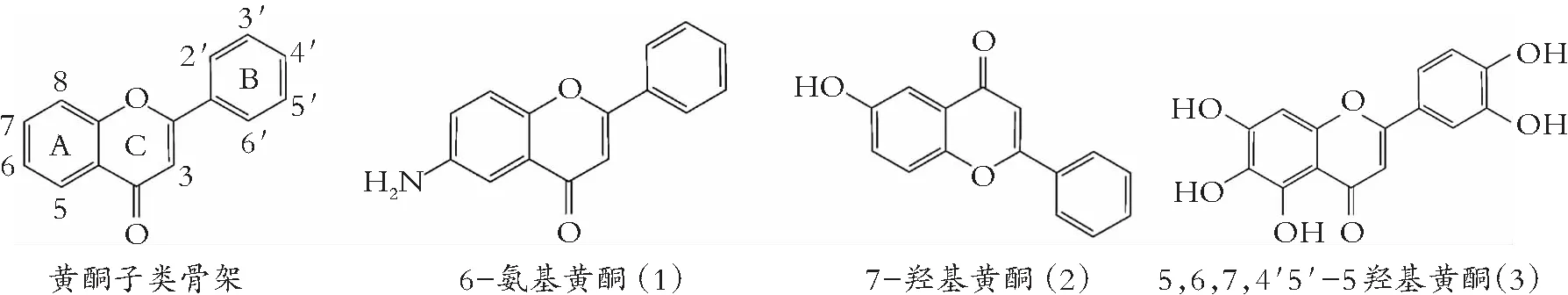
图1 黄酮的化学结构
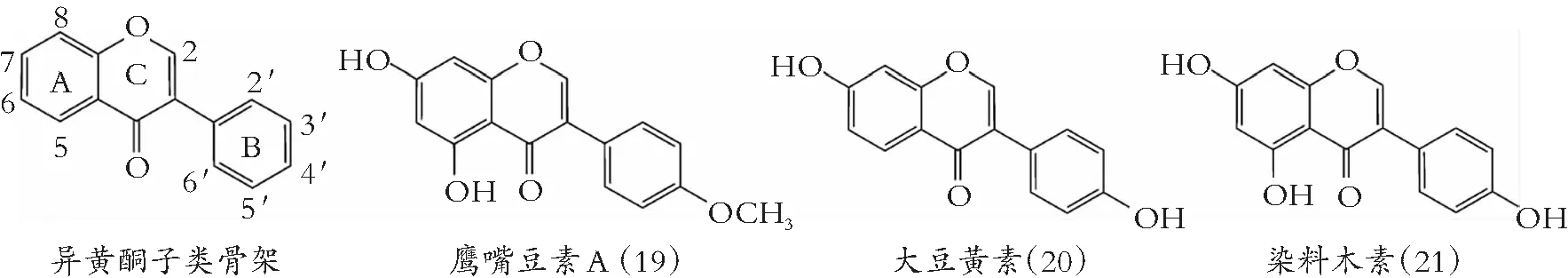
图2 异黄酮的化学结构
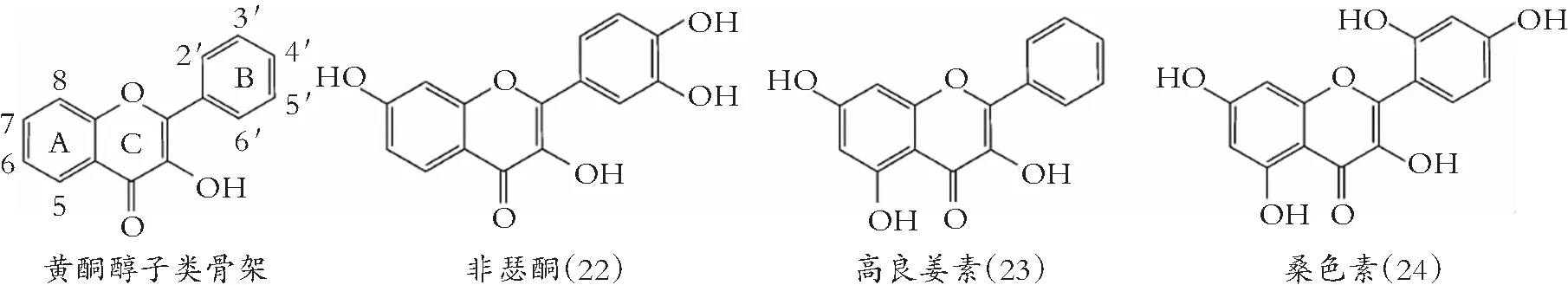
图3 黄酮醇的化学结构
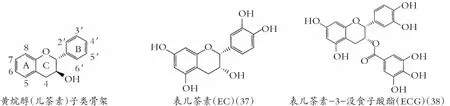
图4 黄烷醇(儿茶素)的化学结构
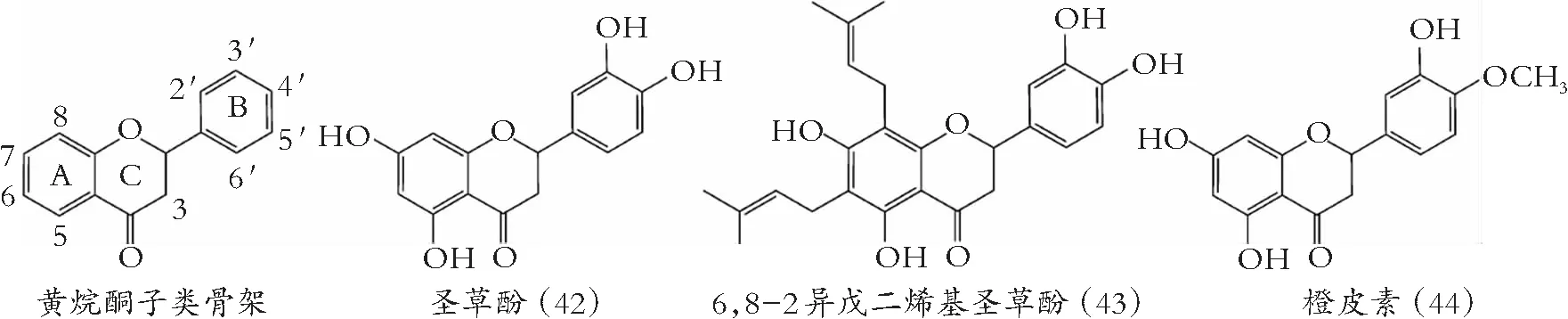
图5 黄烷酮的化学结构
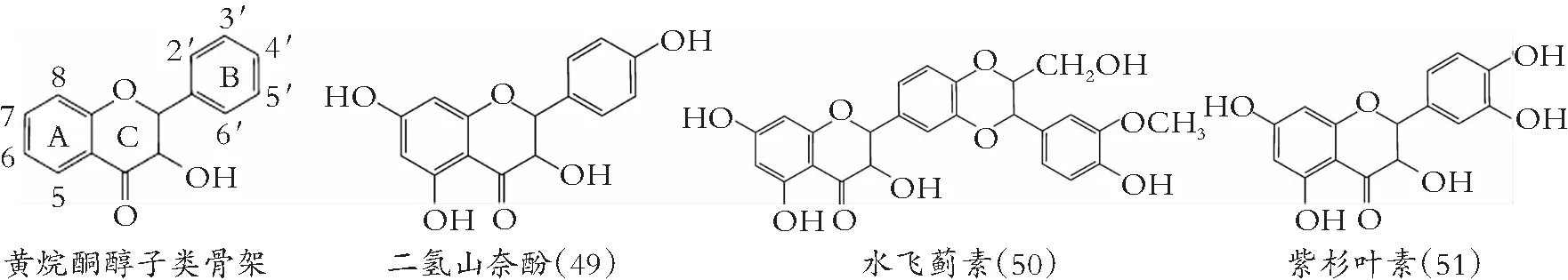
图6 黄烷酮醇的化学结构

图7 查耳酮的化学结构
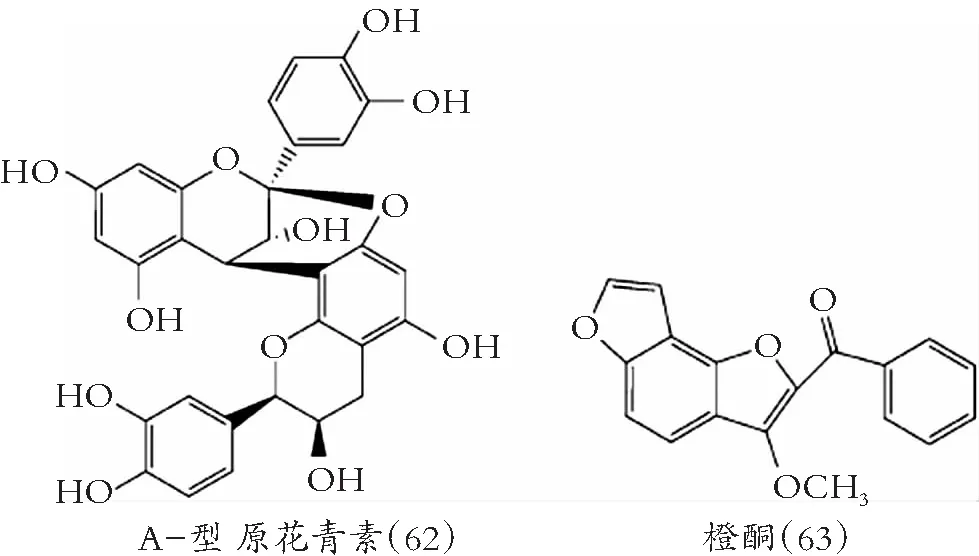
图8 其他类黄酮化合物的化学结构
类黄酮化合物频繁的化学修饰,形成丰富多样的结构[11]。类黄酮、类黄酮苷与它们的异戊二烯基化、香叶基化、甲氧基化、羟基化、乙酰基化以及聚合物,使得它与植物、微生物和动物各亚细胞中的靶标相互反应,以发挥不同的生理功能与抗菌作用[12]。
2 类黄酮的生理功能
类黄酮是植物长期进化过程中,在非生物和生物应力(如营养、阳光强度、紫外线辐射、冷、热、干旱、盐碱、食草动物与病原微生物侵蚀等因子)刺激下,产生的一大类植物次生代谢物。其化学结构、含量与分布随不同植物、不同组织和植物年龄发生变化[13]。相同种类植物会产生相似的类黄酮[13-14]。
在植物器官,这些化合物履行多种生理功能。呈现花和水果颜色的花青素,与其他类黄酮色素,起吸引传粉者与种子传播的作用[15]。在植物组织,受应力刺激产生的花青素和其他非色素类黄酮,如黄酮和黄酮醇等也对应力起抑制作用,保护组织免受伤害[16-17]。类黄酮还参与植物能量转移、光合作用、形态形成、生长因子与性别决定等过程[18]。
大量研究表明:在植物整个生命过程中,类黄酮是重要的抗菌素。植物拥有先天免疫能力,包括自身合成类黄酮与不同层次的防御反应,以阻止病原体传播[19]。如黄烷酮-樱花素(47),大量存在于受外界各病原体包括细菌和真菌侵蚀的稻米中[20]。植物为了快速应对病原体的侵蚀,类黄酮大多集中在叶的维管束。此外,许多类黄酮已被确认是化感物质,通过根系分泌或组织脱落方式释放到外界环境,是植物与植物以及植物与微生物之间进行信号交流的媒介,影响周围其他植物或微生物生长[21]。
3 类黄酮的抗菌机制
研究得出,应对植物病原体抗菌活性为特征的许多类黄酮,也可有效应用于对抗人类病原体,且有别于传统抗菌药物的抗菌机制,细菌耐药性较低,逆转抗生素耐药等优点[22]。
3.1 破坏细菌细胞膜
细胞膜负责渗透调节、呼吸和运输过程,以及肽聚糖与脂类的生物合成。细菌细胞膜完整性的破坏会直接或间接引起代谢功能障碍,最终导致细菌死亡[23]。
到目前,类黄酮特别是儿茶素,对革兰氏阳性和革兰氏阴性细菌有广泛的研究。儿茶素(图4)的抗菌作用,首先与细菌脂质双分子层疏水性膜内部的非极性化合物结合,然后与脂质极性基团形成氢键[24],诱导细胞膜结构变化、间接调节膜蛋白分布或功能[25]。
实验证明,儿茶素与脂质结合,灭活、抑制细菌细胞内外酶的合成,使细菌细胞膜破裂[26]。Bouayed等[27]采用细胞模型,得出类黄酮如表儿茶素(37)、EGCG(39)和槲皮素(30)有助氧化活性。
Fathima等[28]报道,儿茶素通过高浓度EGCG产生活性氧(ROS)爆发,诱导细菌膜渗透性变化与膜损伤引起杀菌作用。Cushnie等[29]发现,儿茶素导致耐甲氧西林金黄色葡萄球菌(MRSA) 膜损伤,产生钾泄漏,且亲脂性更强的3-O-辛酰-表儿茶素(40),比普通表儿茶素(37)有更好抗菌效果,表明增加亲脂酰基链长度,能提高儿茶素抗菌活性[30]。
其他类黄酮如2,4,6′-3羟基-3′-甲基查尔酮(52)导致变形链球菌胞内物质如蛋白质和离子泄漏[31]。来自蜂胶的槲皮素(30)能降低金黄色葡萄球菌质子动力势,增加膜渗透性,提示蜂胶与抗生素如四环素和氨苄青霉素有协同抗菌活性[32]。
此外,黄酮芹菜素(7)、刺槐黄素(8)以及黄酮醇桑色素(24)和鼠李黄素(35),通过扰乱脂的有序与定向排列,引起膜结构不稳,增大胞内物质渗漏[33]。
Tsuchiya等[34]报道,黄烷酮柚皮素(45)和槐黄烷酮G(48)对耐甲氧西林金黄色葡萄球菌(MRSA)的抗菌活性,是因降低细胞膜内外流动性引起。槲皮素(30)、芦丁(33)和银锻苷(36)可减小脂双分子层厚度,破坏脂质单层结构[35]。
黃烷酮C- 3位被亚芳基取代,影响金黄色葡萄球菌、表皮葡萄球菌与粪肠球菌引发细菌细胞聚集,破坏细胞膜完整性,导致细菌生物膜扰动,有高度抗菌活性[36]。
类黄酮-OH的数量、分布,以及C环甲氧基等差异,影响类黄酮与脂质双层之间的相互作用[37]。
3.2 抑制细菌脂肪酸、粘肽层合成
脂肪酸是细胞膜重要组成成分,细菌脂肪酸合成酶 (FAS-II)在许多方面不同于哺乳动物脂肪酸合成酶(FAS-I),这使抗菌剂对FAS-II有优良的靶向性。研究报道,很多类黄酮是FAS-II抑制剂。
槲皮素(30)、芹菜素(7)与樱花素(47)能抑制幽门螺杆菌的3-羟脂酰基-ACP脱水酶[38]。Jeong等[39]研究了11个不同结构的羟基黄烷酮对粪球菌3-酮脂酰-ACP合酶的影响,得出圣草酚(42)、柚皮素(45)和紫杉叶素(51)有好的抑制效果。类黄酮B环4′、 5′-OH和Arg38和Phe308酶氨基酸残基间形成氢键,对抗菌活性起关键作用。
Elmasri等[40]发现,5,6,7, 4′,5′-5羟基黄酮(3)和5-羟基7,4′-2甲氧基黄酮(5)下调丙二酰辅酶A酰基载体蛋白转酰酶fabD,调节细菌FAS-II。因此,这二黄酮被认为是阻断细菌生长有前途的药物。
绿茶EGCG(39)能抑制细菌FAS-II特定还原酶(FabG FabI)[41]。FabG酶( 3-酮脂酰ACP还原酶)是已知催化还原细菌包膜β-酮基同工酶[42]。EGCG(39)还能抑制参与细菌脂肪酸生物合成的其他酶如3-酮脂酰基-ACP和烯脂酰-ACP还原酶[61],这些酶是开发新抗生素理想的靶点。
分枝杆菌是引起一些难以治疗严重疾病的病原菌[43],细菌拥有FAS-II和FAS-I,二者对分枝菌酸的生物合成都很重要。许多类黄酮包括槲皮素(30)、山柰酚(26)、非瑟酮(22)、桑色素(24)、杨梅酮(25)、黄岑素(12)、木犀草素(15)以及EGCG(39)抑制FAS-I[43]。这些类黄酮对FAS-II,包括烯脂酰-ACP还原酶、β-酮脂酰-ACP还原酶、β-羟脂酰-ACP脱水酶,也有抑制活性。紫铆因 (54)、异甘草素(56)和非瑟酮(22),能降低牛结核分枝杆菌卡介苗FAS-II活性[44]。
粘肽层是肽聚糖、胞壁质或粘质复合物,抑制其合成是常见传统抗菌药物和类黄酮抗菌作用机制之一。黄岑素(12)有助于EGCG(39)引起的肽聚糖损伤[45]。高良姜素(23)、山奈素(28)和山奈素-3-葡萄糖苷(29)不仅对耐阿莫西林大肠杆菌有抗菌活性,而且能抑制肽聚糖和核糖体合成,逆转抗菌剂耐药性[46]。儿茶素与肽聚糖化合,干扰细菌细胞壁合成。EGCG(39)和环丝氨酸协同抑制细胞壁合成,与β-内酰胺(苯唑西林青霉素、甲氧西林、氨苄西林、头孢氨苄)直接或间接靶向肽聚糖,从而增强β-内酰胺抗菌药物活性[47]。
3.3 抑制核酸合成
类黄酮有拓扑异构酶抑制剂活性,Ohemeng等[48]发现槲皮素(30)、芹菜素(7)和3,6,7,3′,4′-5羟基黄酮(4)抑制大肠杆菌DNA促旋酶。得出,槲皮素与促旋酶B亚基结合,经5,7,3′-OH与DNA促旋酶的氨基酸残基形成氢键,封锁D-丙氨酸-D-丙氨酸连接酶ATP结合袋[49]。类黄酮羟基比甲氧基与促旋酶结合能力更强,如白杨素(13)和山柰酚(26)较蜜橘黄素(16)和福橘素(18)能更好地抑制大肠杆菌DNA促旋酶,但5′羟基大大减小了其抑制活性。
类黄酮与DNA促旋酶B亚基(GyrB)三磷酸腺苷(ATP)结合位点发生竞争反应,是抑制DNA成为超螺旋第二种机制。类黄酮与DNA结合,稳定DNA-促旋酶复合物,引起DNA裂解感应[50]。3-OH、 5-OH、 7-OH和4-羰基基团,是类黄酮与GyrB残基结合的重要基团[51]。Ulanowska 等[52]发现,异黄酮染料木素(21)以剂量-反应的方式,抑制鳗弧菌的生长,其原因是染料木素介导拓扑异构酶II-DNA裂解复合物的稳定性,导致细胞分裂或染色体复制受损。
解旋酶是无处不在的马达蛋白,作用ATP水解释放能量,分离、重排核酸双链[53]。类似于拓扑异构酶与促旋酶,是DNA复制所必需。研究表明这些蛋白质是类黄酮的分子靶点,其药效基团与核酸的键合能力,已作为解旋酶抑制剂被筛选。
木犀草素(15)及其结构相似的黄酮醇,如莫林(24)杨梅酮(25),被证明抑制复制的解旋酶如DnaB和RecBCD解旋酶/ E. coli 核酸酶[54]。杨梅酮抑制革兰氏阴性细菌生长,被认为是许多DNA和RNA聚合酶以及病毒反转录酶和端粒酶的有效抑制剂[55]。
二氢叶酸还原酶(DHFR)是许多药物包括抗菌药物,常见的靶点。DHFR在叶酸合成途径提供嘧啶和嘌呤前体[56]。据报道,EGCG(39)抑制嗜麦芽寡养单胞菌、结核分枝杆菌和大肠杆菌的DHFRs[57]。EGCG与叶酸通路其他抑制剂,如磺胺甲恶唑和乙胺丁醇,有协同效应[57]。
类黄酮插层DNA,抑制细菌核酸合成,也被认为是一种抗菌机制。Mori等[58]用EGCG(39)、杨梅酮(25)和洋槐黄素(17)培养普通变形杆菌和金黄色葡萄球菌,引起DNA、RNA和蛋白质合成降低,这是A环无6-OH和B环-3′、4′、5′- 3 OH结构的类黄酮,与核酸双链插层所致。
大量研究得出,在人类癌症细胞中,类黄酮介导拓扑异构酶抑制和DNA插层,是普遍作用机制[59]。
3.4 抑制电子传递链和ATP合成
膜电位,生命系统几乎所有化学过程必需的主要能量来源,也是细菌细胞生存和生长最重要的因素。奇特的是,用异补骨脂查尔酮(57)和6-异戊二烯基芹菜素(10)处理金黄色葡萄球菌,导致细菌膜去极化[60]。Haraguchi等[61]报道,甘草查尔酮抑制微球菌细胞氧消耗,其抑制位点存在于电子传递链细胞色素C和CoQ之间,甘草查尔酮A、B、C、D(58~61)亲脂性的异戊二烯基团,有助于它们渗透到细菌细胞。
已被证明,各种多酚类黄酮与存在于ATP合酶F1部分独特的多酚结合袋α、β和γ亚基界面结合,阻碍γ-亚基顺时针或逆时针旋转,抑制ATP合成酶[64]。不同物种,包括人、牛、鼠与大肠杆菌,多酚结合袋残留物高度保守,其他微生物容易受到这种抑制[65]。最有效的大肠杆菌ATP酶F1FO抑制剂有:黄芩素(12)、桑色素(24)、表儿茶素 (37)以及水飞蓟素(50)。槲皮素(30)、栎皮酮-3-葡萄糖苷(31)和栎皮酮-3-李糖苷(32),虽不抑制ATP合成,但能防止ATP水解[65]。EGCG(39)通过抑制变异链球菌ATP酶F1FO活性,抑制产酸和耐酸性能[66]。Ulrey等[67]发现,用A型的原花青素(73)处理绿脓杆菌,下调ATP合成过程多蛋白质表达。
3.5 与金属离子形成螯合物
类黄酮与过渡金属离子有很强的螯合能力[68],抑制细菌金属酶活性,对许多其它抗菌物质包括母乳中的乳铁蛋白,这是常见的作用机制。类黄酮的螯合位点包括:A环或B环两邻-OH、C环3-OH与C环-4-酮基,或A环5-OH和C环-4-酮基位置。虽然螯合物的抗菌活性很大程度上取决于金属离子,但螯合物的形成优先取决于类黄酮螯合位点和pH值[69]。研究表明:槲皮素(30)与Mn2+、Hg2+、Co2+、Cd2+螯合物对金黄色葡萄球菌、蜡样芽胞杆菌、绿脓杆菌、E大肠杆菌和肺炎克雷伯菌有杀菌作用。类似地,桑色素(24)Ca2+、Mg2+螯合物对金黄色葡萄球菌和微球菌有抗菌作用[70];7,4′-2甲氧基芹菜素(9)与Cu2+、Ni2+、Zn2+、Co3+、 Fe3+、Cr3+、Cd2+和M2 +螯合物,对大肠杆菌、金黄色葡萄球菌和普通变形杆菌有抗菌效果[71]。
3.6 抑制细菌生物膜形成
类黄酮除直接与细菌作用,还影响细菌生长、粘附、能动性与群体感应(QS),抑制细菌生物膜建立与形成[72]。以细菌生物膜为基础的感染,在所有微生物、动物与人的慢性感染以及食物腐败中,占很大比例[73]。与浮游细菌相比,细菌生物膜对抗菌剂和宿主免疫系统具有很强的抵抗力(对抗菌剂的抵抗力,比浮游细菌提高10到1 000倍),导致严重的临床问题,引起许多慢性和难治感染疾病的反复发作[74]。
细菌生物膜形成是细菌粘附到宿主接触表面的随机事件,由其细胞分裂、发展到成熟所分泌的多糖基质、纤维蛋白、脂质蛋白等活性养分,将自身包绕其中形成的大量细菌聚集三维生物膜[75]。细菌感染通常使用全身抗生素治疗,去除细菌生物膜非常有限。
有趣的是类黄酮支持细菌聚集。Stapleton等[76]在用EGCG (39)和3-O-辛酰-表儿茶素 (40) 培育金黄色葡萄球菌,发现呈现多细胞聚集。黄酮醇导致细菌细胞聚集,尤其是高良姜素(23),然而细菌聚集后,细菌增长被抑制。可能是类黄酮部分分解诱发细菌聚集,产生细胞膜融合,降低了单位膜面积活性养分的吸收,不利于细菌生物膜形成。Awolola 等得出[77],异牡荆苷(14)、EC(37)、5,7,4′-3羟基黄酮醇(41)对金黄色葡萄球菌ATCC 29213,有显著的抗生物膜活性。同样,El-Adawi等[44]观察,在EC 2~15%下,变异链球菌生物膜形成减少55~66%。然而也有报道,来自Acaciakarroo的EC对李斯特氏菌生物膜无降低活性[78]。
大肠杆菌、弧菌spp和鼠伤寒沙门氏菌生物膜的形成,QS尤其是自诱导物-2信号分子被认为是重要的调节因子[79]。研究发现柑橘类黄酮如芹菜素(7)、山柰酚(26)、槲皮素(30)和柚皮素(45),是自诱导物-2信号分子有效拮抗剂[80]。除此,槲皮素以浓度依赖方式抑制海藻酸盐的产生,导致生物膜形成过程中粘附下降,该类类黄酮还能抑制N -高丝氨酸内酯(AHL)介导的QS。
奇特的是,槲皮素上调铜绿假单胞菌数个含铁蛋白表达,限制生物膜形成所需Fe3+[81]。Roy等发现,山柰酚(28)、ECG(38)和EGCG(39)介导从LuxR-type转录激活蛋白中置换AHL分子[82]。白杨素(13)、根皮素(55)和柚皮素(45)可抑制QS合酶/受体对LasI/R和RhlI / R[83]。A型原花青素(62)是铜绿假单胞菌的抗粘附剂,对Fe3+等过渡金属离子优良的螯合,抑制细菌生物膜形成[84]。
亲水性类黄酮能与膜表面相互结合,防止有害物质与细胞膜作用,抑制细菌生物膜形成[85]。黄酮如6-氨基黄酮(1)、7-羟基黄酮(2)、芹菜素(7)、白杨素(13)、异黄酮大豆黃素(20)和染料木素(21)与查耳酮根皮素(55)抑制大肠杆菌O157: H7生物膜形成,抗氧化化合物(维生素C和维生素E)没有这种效果,说明类黄酮阻止生物膜形成,抗氧化性不是唯一原因[86]。此外,根皮素显著降低EO157: H7大肠杆菌生物膜形成,对浮游细菌生长不产生影响。鱼藤酮(63)对大肠杆菌生物膜抑制有类似效果[87]。
菌毛是细菌生物膜形成的重要因素。由于根皮素(68)抑制csgA和csgB基因表达,减少大肠杆菌O157: H7菌毛形成。根皮素抑制两种毒素基因 (溶血素hlyE和志贺毒素2 stx2),诱导抗逆性基因如marRAB和hcsBA表达[86],对抗生素耐药性有积极影响。
槲皮素(30)、乔松素(46)有细菌外排泵抑制剂(EPI)作用。EPI不仅能阻止外排泵,而且阻止生物膜形成[88]。研究表明:EGCG (39)能有效抑制浮游粪球菌生长,还能抑制生物膜形成相关基因的表达。来自淫羊藿物种的异戊二烯化类黄酮,能抑制牙龈卟啉单胞菌生物膜的形成[89]。
此外,类黄酮还可抑制与降低细菌毒素。重要的细菌毒素如透明质酸酶,在细菌发病机理中,介导的透明质酸降解,增加结缔组织的渗透率,降低体液黏度[90]。尤其是黄酮醇,如杨梅酮(25)和槲皮素(30)已被确定为无乳链球菌透明质酸裂解酶抑制剂,其抑制作用与类黄酮羟基数量呈正相关[91]。类黄酮特别是儿茶素和原花青素,能中和霍乱弧菌、创伤弧菌、金黄色葡萄球菌炭疽杆菌、肉毒梭状芽胞杆菌的细菌毒素[92]。类似,桑色素(24)抑制金黄色葡萄球菌的外毒素,山柰酚(26)、山柰酚-3-芦丁糖甙(27)和槲皮素糖苷抑制c肉毒杆菌的神经毒素[93]。乔松素(46),一蜂蜜黄烷酮,以浓度方式减少金黄色葡萄球菌α-溶血毒素产生。EGCG(39)和GCG抑制从肠出血性E大肠杆菌释放志贺样毒素,提示绿茶儿茶素可用来防止大肠杆菌引起的食物中毒。
4 结 论
类黄酮在植物中广泛存在,具有良好的抗菌作用,尤其是对抗生素耐药的细菌依然敏感,并且该类化合物不易产生耐药性。但类黄酮与细胞靶点的作用,仍认识不多,相信随着人们对类黄酮抗菌作用及机制研究的深入,必将对新型抗耐药物的研发提供新的思路和理论依据。
