原发性胆汁性胆管炎的诊断和预后研究进展*
2022-01-05杨敏张钧浙江大学医学院附属邵逸夫医院检验科浙江省医学精准检验与监测研究实验室杭州330016
杨敏,张钧(浙江大学医学院附属邵逸夫医院检验科,浙江省医学精准检验与监测研究实验室, 杭州330016)
原发性胆汁性胆管炎(primary biliary cholangitis, PBC)是常见的胆汁淤积性自身免疫性肝病,因机体对线粒体内膜丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex, PDC)的E2亚基产生免疫应答,引起肝内中小胆管非化脓性炎症,最终导致肝纤维化甚至肝衰竭。PBC患者临床症状有高度异质性,主要表现为瘙痒、乏力、黄疸等,严重者可出现肝功能失代偿。血清学特征为抗线粒体抗体(anti-mitochondrial Antibodies,AMA)或AMA-M2亚基阳性,同时伴有碱性磷酸酶(alkaline phosphatase,ALP)等指标升高。随着对疾病认识不断加深,加之自身抗体检测技术的发展和普及,PBC总体发病率呈逐年上升的趋势。据估计每年全球至少有将近10万人新诊断为PBC,40岁以上女性中PBC患者达1‰以上[1]。目前PBC患者极少数发展成终末期肝病,这主要得益于确诊时间的提前和新型治疗药物的研发,使患者临床症状得到及时、有效的控制,延缓了疾病进展,而该病也从“原发性胆汁性肝硬化”更名为“原发性胆汁性胆管炎”[2]。由此可见,合适的诊断标志物和风险分层方法,对及早明确患者诊断,准确评估风险,合理判断预后,采取相应的干预措施,改善患者临床结局至关重要。
1 发病机制
PBC的发病机制复杂,普遍认为环境因素的诱导、明显的遗传倾向性、各类非编码RNA的调控引起的表观遗传学改变以及自身免疫应答紊乱等一系列因素共同作用于肝内胆管上皮细胞,最终导致疾病的发生、发展[3]。
1.1环境、遗传因素 特定的环境暴露(如反复感染、生物制剂应用等)可通过打破自身耐受、分子模拟等机制诱导PBC的发生,如大肠埃希菌引起的尿路感染可通过细菌和人体的PDC-E2抗原间的分子模拟作用,增加机体罹患PBC的风险[4]。全基因组关联分析发现,人类白细胞抗原(human leukocyte antigen, HLA)Ⅱ类抗原、IL-12A、IL-12RB2等基因存在PBC遗传易感相关的多个单核苷酸多态性(single nucleotide polymorphism, SNP)位点[5-6]。PBC全X染色体关联研究发现,OTUD5、GRIPAP1基因内rs3027490、rs7059064位点与其显著相关[7]。目前,关于PBC自身抗体的全基因组关联分析(genome wide association study,GWAS)研究表明,HLA Ⅱ类基因编码的氨基酸与抗核斑点蛋白(speckled protein 100, sp100)抗体的产生有关[8]。
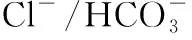
1.3非编码RNA及表观遗传因素 Banales等[12]研究发现,miR-506表达水平在PBC患者肝组织中升高,异常表达的miR-506可结合于mRNA的3′端非翻译区并下调AE2表达;miR-506基因位于X染色体,或许也与该病女性多发有一定相关性。MicroRNA-34a通过调节转化生长因子-β1(transforming growth factor-β1,TGF-β1)/smad信号通路,促进PBC患者上皮间质转化(epithelial-mesenchymal transition,EMT)及肝纤维化[13]。Wasik等[14]发现在AMA阴性的PBC患者中,miR-21和miR-150的表达水平上调,下游靶基因表达下调,并在肝纤维化进展中发挥作用。笔者课题组前期通过表达谱芯片技术,初步发现了PBC中差异表达的lncRNA LOC441461可能通过结合多梳蛋白抑制性复合物PRC 2,下调NR4A3基因的表达,进一步引起下游靶基因FOXP3的表达下调[15]。腺苷甲硫氨酸可通过其抗氧化作用,增加蛋白质的谷胱甘肽化水平,降低患者体内AMA滴度,改善肝功能生化指标。这些发现也为PBC发病的分子机制提供了新的见解,并提示其潜在的治疗价值[16]。
2 临床指南与诊断标志物
随着新型诊断实验和技术的发展和对PBC致病机理认识的加深,国内外专家对先前的诊疗指南进行了修订(表1)。国内指南《原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)》中虽提及可将sp100、gp210抗体等作为AMA阴性PBC患者的重要诊断标志物,但并未将二者纳入最终的诊断标准中[17]。而国外2个指南《EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis(2017)》和《Primary Biliary Cholangitis: 2018 Practice Guidance from the American Association for the Study of Liver Diseases》则明确了这些抗体的诊断价值[18-19]。目前3个指南均不推荐对可疑PBC患者常规行肝组织活检,除非AMA及其他PBC特异性抗核抗体阴性,且高度怀疑患者合并自身免疫性肝炎或者非酒精性肝炎。此外,欧洲和国内的指南也明确指出,仅AMA阳性而血清肝功能及酶学指标正常的患者,不足以诊断PBC。但临床中经常可见AMA阳性或呈典型PBC抗核抗体核型的患者血清ALP正常,对此类患者的管理也向目前的指南提出了一定的挑战[20]。针对此类患者,建议临床定期随访,动态监测肝功能状态[ALP、γ-谷氨酰基转移酶(γ-glutamyltransferase,GGT)、胆红素等]并进行评估,以便做到早诊断、早干预。
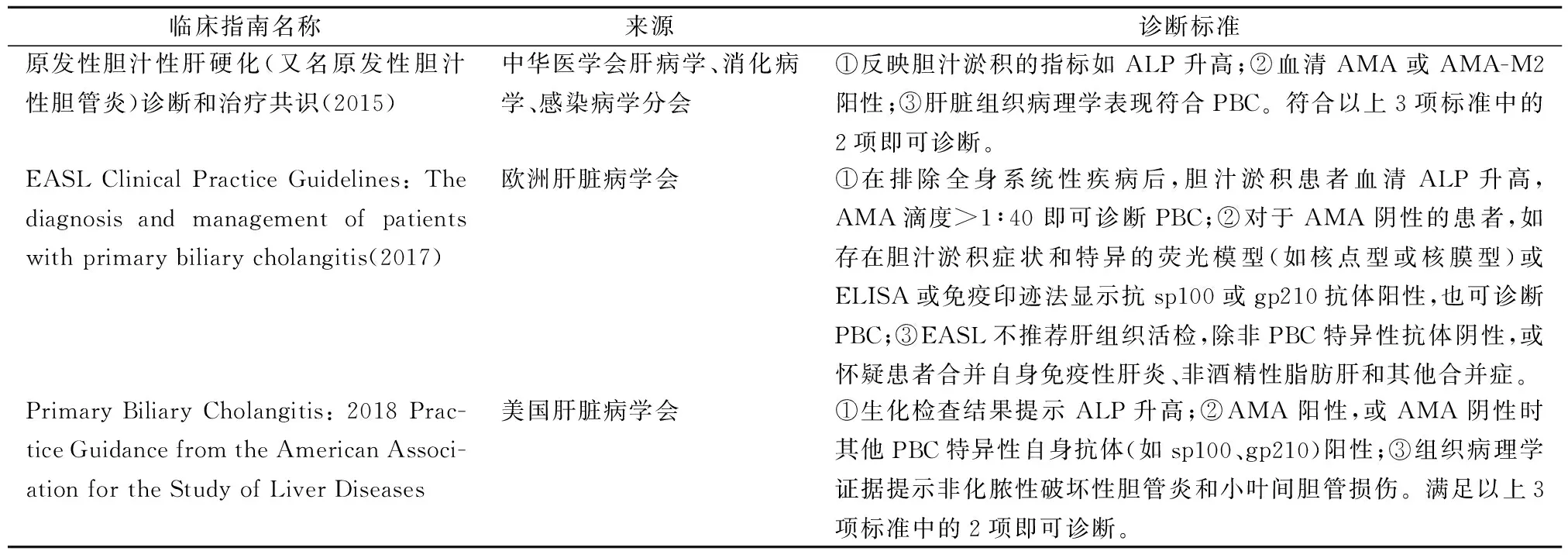
表1 国内外PBC最新诊疗指南对比
近年来,许多临床研究也发现了一些新的诊断标志物。Mu等[21]运用多重免疫分析法研究PBC患者的血清趋化因子谱,发现绝大多数趋化因子水平均高于健康对照组,且在PBC进程中不断上升。对于AMA阴性PBC患者, 血清IL-31诊断PBC的ROC曲线下面积可达0.900,敏感性为87.5%,特异性为83.9%,且与PBC的纤维化进展呈负相关[22]。Hayashi等[23]发现血清中高水平的Gas6和Axl与组织学分期密切相关,Gas6/清蛋白比值和Axl/清蛋白比值在诊断晚期PBC时具有较高的ROC曲线下面积,或可作为非侵入性检查的替代指标。Vesterhus等[24]首次研究了PBC、原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)和自身免疫性肝炎(autoimmune hepatitis, AIH)患者的血清细胞外基质(extracellular matrix,ECM)谱,结果发现与AIH和PSC相比,PBC患者绝大多数ECM标志物表达增加,且与熊脱氧胆酸(ursodeoxycholic acid, UDCA)治疗反应呈负相关。还有研究者利用斑点印迹法探索AMA亚基(PDC-E2、BCOADC-E2、OGDC-E2及天然的M2亚基nPDC)阳性个数对PBC的诊断价值,发现AMA亚基的个数比特异的靶抗原位点更有意义;与1种亚基阳性相比,2种、3种和4种亚基阳性分别使PBC优势比(odds ratio,OR)增加了2.05、4.63和21.53[25]。抗己糖激酶(anti-hexokinase 1, HK1)和抗kelch样12(anti-kelch-like 12, KLHL12)抗体已被鉴定为PBC患者的2个重要生物标志物:AMA阳性和阴性的PBC患者中,抗HK1抗体的阳性率分别为44.7%和33.3%,而抗KLHL12抗体阳性率分别为41.2%和22.2%;这2种抗体阳性的患者血清ALP、GGT、胆红素水平均高于阴性患者,与疾病的严重程度相关[26]。此外,血浆蛋白和非编码RNA分子或许也可作为PBC诊断和分期的生物标志物。Dong等[27]发现血浆S100钙结合蛋白A6(S100 A6)、LINC00312、LINC00472在PBC中表达上调,LINC01257表达下调,这4个基因作为诊断标志物的ROC曲线下面积分别为0.759、0.729、0.694和0.715,而作为PBC疾病分期的标志物ROC曲线下面积分别为0.666、0.661、0.839和0.554。利用高通量凝集素微阵列芯片研究PBC患者及各种自身抗体阳性的PBC亚组之间的差异,发现与对照组相比,PBC患者血清IgG唾液酸聚糖水平升高;而在PBC亚组中,与AMA-M2阴性组相比,M2阳性PBC患者甘露糖和半乳糖水平降低;抗磷脂抗体阳性患者甘露糖水平降低;抗sp100阳性患者IgG N-乙酰半乳糖胺和岩藻糖水平降低;而抗gp210阳性患者半乳糖水平升高;不同自身抗体阳性的PBC患者表现出不同的聚糖谱,提示糖基化水平的改变可能与疾病的发生发展有关,也为发现新的标志物提供方向[28]。使用16S rRNA测序和核磁共振波谱法测定PBC患者粪便微生物菌群和短链脂肪酸(short chain fatty acids, SCFAs),发现晚期患者粪乙酸和SCFAs含量较高,菌群alpha多样性降低,Weisella增加,群落组成明显不同,提示肠道菌群和代谢产物可能在PBC进展中发挥作用[29]。
3 风险分层与预后模型
UDCA可以改善患者的肝功能生化指标,延缓肝纤维化进展,是目前治疗PBC的标准方法。然而,部分患者对UDCA的反应却并不理想。确定UDCA是否对患者有效非常有必要,因为治疗的反应性决定了疾病转归[30]。已有的几个UDCA应答标准,均是基于生化指标的分层方法,包括:Barcelona、Paris Ⅰ、Rotterdam、Toronto和Paris Ⅱ标准等(表2)。大部分方法是根据UDCA治疗1年后ALP、GGT、清蛋白或胆红素的变化进行判断。
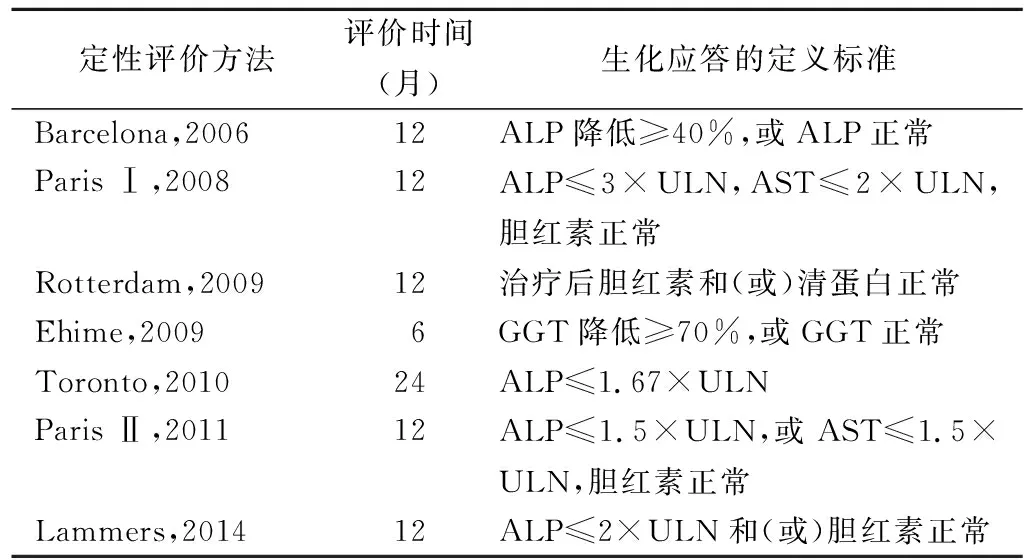
表2 PBC患者对UDCA治疗应答的评价方法
2017年EASL指南阐述了PBC患者风险分层的方法及意义,并推荐使用危险评分系统(如GLOBE和UK-PBC),以确定患者未来发生晚期肝病和并发症的风险。2个模型均来自大样本的队列研究,并结合了UDCA反应指标和肝病分期特征,在内部验证试验中均表现优异。而最新的2项多中心研究通过比较Kaplan-Meier分析中的预测生存期和实际生存期,来评估Mayo风险评分(MRS, 1989和1994)、UK-PBC评分和GLOBE评分的预后价值:共纳入1 100例UDCA治疗的PBC患者,1年后,UK-PBC评分的一致性统计量为0.74(95%CI:0.67~0.80),MRS(1989和1994)为0.76(95%CI:0.72~0.81),GLOBE评分为0.80(95%CI:0.76~0.84);GLOBE评分表现出优越的区分性能,但三者差异并无统计学意义;所有PBC预后评分均显示出对肝移植或死亡具有良好的预测准确性,且明显优于传统的定性评价方法[31-32]。
Murillo Perez等[33]使用年龄(A)、胆红素(B)和ALP(A),开发了一种简化的非专家级人员PBC分层工具(“ABA”),以帮助PBC患者选择合适的护理方法。与传统应用生化指标进行分层的方法比较,“ABA”更有助于年轻患者的风险识别。一项来自日本的研究使用时间依赖的ROC分析比较清蛋白-胆红素(ALBI)评分的预测性能,发现ALBI评分在观察开始后2年内ROC曲线下面积最高;超过2年,Mayo评分对死亡率和肝移植有更好的预后能力[34]。来自英国PBC队列的靶向多重验证蛋白质组学研究发现,未经治疗的PBC患者(68例)呈现出炎症蛋白组,而UDCA治疗患者(416例)炎症蛋白组的规模减少。接受UDCA治疗的患者差异表达的19种蛋白质中有6种与趋化因子密切相关。使用血清CXCL11和CCL20水平作为应答状态的标志物,ROC曲线下面积可达0.91(95%CI:0.83~0.91)。UDCA应答不足的患者血清趋化因子升高,推测胆道上皮细胞释放的趋化因子可能在高危患者致病中发挥重要作用,其作为识别高危患者的生物标志物还有待前瞻性研究进一步确认[35]。
4 总结与展望
基于质谱技术、芯片技术、大数据平台和人工智能技术的应用,以及单中心、多中心研究的发展,更多的遗传和分子免疫学机制在PBC中被阐明,涌现出许多潜在的与病理生理过程密切相关的新标志物,并纳入到未来的预后评分系统中。与此同时,研究人员也可以运用合适的算法,探索和挖掘目前已有的常规检测指标在PBC诊断和预后中的价值。早期诊断和正确的风险分层不仅可以使低风险的PBC患者得到更为规范的治疗, 而且可根据患者的特征将高风险者纳入到相应的临床研究中,使他们从这些设计精良的研究中获益。由剑桥大学与UK-PBC团队共同研发的评分系统可下载至电脑端使用,对患者进行风险分层、预后评估也将更加便捷。此外,机器学习和神经网络等方法的创新,也将进一步提高预测模型的准确性。这些高度优化的模型将指导临床管理,最终造福PBC患者。
