Lnc-FAM83D-3通过miR-504-3p-FAM83D轴调控三阴性乳腺癌的机制研究
2022-01-05崔一尧赵承承张工黄汇李晨赵晖巫玉云赵洁
崔一尧,赵承承,张工,黄汇,李晨,赵晖,巫玉云,赵洁
2020年女性乳腺癌首次超过肺癌成为全球女性最常见的恶性肿瘤,也是女性死亡的首要原因[1]。其中,三阴性乳腺癌(triple negative breast cancer,TNBC)的发病率约占乳腺癌整体发病率的15%[2-3]。由于TNBC具有增生相对活跃及转移率高的特点[4],早期即可能发生腹腔脏器转移或脑转移,部分患者初诊即为晚期[5]。尽管在诊治方面取得了一些进展,但由于其高增殖能力和治疗靶点的相对缺少,治疗选择比较有限,5年生存率仅为77%[6]。近年来的研究发现,长链非编码RNAs(long non-coding RNAs,lncRNAs)在多种疾病病理生理过程中发挥重要功能,比如癌症、帕金森病、糖尿病等[7-9]。lncRNAs可作为多种恶性肿瘤的竞争性内源性RNA 来参与其发生发展与耐药。例如,Sharma 等[10]发现lncRNA通过调节上皮-间质转化影响头颈部鳞状细胞癌的内源性活动。Zhang等[11]发现GATA3-as1通过稳定PD-L1蛋白和降解GATA3蛋白促进TNBC进展和免疫逃逸。我们通过TCGA数据库的分析,发现lnc-FAM83D-3基因的表达水平对乳腺癌患者的生存时间有影响。然而,lnc-FAM83D-3在乳腺癌中的表达模式和功能尚不清楚。因此,对lnc-FAM83D-3的研究有助于探索TNBC的发病机制以及评估患者的预后。本研究通过观察lnc-FAM83D-3对TNBC细胞株HCC1937、MDA-MB-231增殖、侵袭、迁移和凋亡活动的影响,探讨lnc-FAM83D-3影响乳腺癌发展的机制。
1 资料与方法
1.1 主要试剂 TNBC细胞株HCC1937、MDA-MB-231、MCF-10A均购于中科院上海细胞库。DMEM培养基、RPMI1640培养基血清、双抗购于美国Gibco公司。Trizol由上海普飞提供。实时荧光定量PCR试剂盒购于TAKARA公司。引物、慢病毒由吉凯基因合成。质粒提取试剂盒购于美国OMEGA公司。MTT试剂盒购于美国MCE公司。凋亡试剂盒购于中国福麦斯公司。双荧光素酶活性检测,试剂盒购于美国Promega公司。Transwell小室购于美国Corning公司。Matrigel购于美国BD公司。FAM83D抗体、GAPDH抗体购英国Abcam公司。
1.2 乳腺癌组织来源 收集南京医科大学附属江宁医院2017年1月至2020年5月保存的三阴性乳腺癌石蜡组织6例,及对应的癌旁正常组织(距离癌组织边缘>5 cm)。患者术后病理组织学确诊为TNBC,排除术前放疗、化疗或内分泌治疗者。本研究经医院伦理委员会批准,患者知情且签署同意书。
1.3 数据资料收集 通过cBioPortal网站(http://www.cbioportal.org)从TCGA数据集下载并预处理乳腺癌数据集,采用Mann-Whitney U检验法对目的基因在不同临床资料的表达水平差异进行分析。采用Kaplan-Meier方法检验lnc-FAM83D-3基因的表达与乳腺癌患者生存期的关系。
1.4 慢病毒感染细胞 将细胞置于含有10%胎牛血清和1%双抗的1640或DMEM培养基中,在37 ℃、5%CO2的环境中贴壁培养。使用携带目的基因RNA干扰序列的慢病毒感染HCC1937、MDA-MB-231 细胞作为shlncRNA实验组,携带空载片段的慢病毒载体为shNC对照组。在细胞感染慢病毒72 h后按 2 μg/mL 的浓度添加嘌呤霉素,按时更换培养基,2周后于显微镜下挑取单克隆细胞团于96孔板中,继续培养、传代。
1.5 实时荧光定量PCR(RT-qPCR)TRIzol试剂提取总RNA后,首先使用逆转录试剂盒合成cDNA,用Nano-Drop2000c测定RNA浓度和质量,-20 ℃保存备用。在罗氏仪器上进行聚合酶链式反应,用于靶标扩增。qPCR反应体系为12 μl,其中1 μlcDNA,上下游引物各0.5 μl,SYBR 6 μl,加无酶水至12 μl,反应条件为95 ℃、30 s,变性:95 ℃、5 s,退火:60 ℃、30 s,延伸:60 ℃、30 s。引物序列,lnc-FAM83D-3正向引物:5′-GCCATCGCAGACTTAGCT-3′,反向引物:5′-CACCACAACCTCCACCTC-3′;GAPDH作内参,正向引物:5′-TGACTTCAACAGCGACACCCA-3′,反向引物:5′-CACCCTGTTGCTGTAGCCAAA-3′。以2-ΔΔCt表示目的基因的相对表达量。
1.6 四甲基偶氮唑蓝(MTT)将细胞消化后,完全培养基重悬成细胞悬液,并计数;铺板后再观察各实验组的细胞密度,放入细胞培养箱中培养;从铺板后第2天开始,培养终止前4 h加入20 μl 5 mg/ml的MTT于孔中;4 h后完全吸去培养液,加100 μl DMSO溶解甲瓒颗粒;振荡器振荡2~5 min,酶标仪490/570 nm检测OD值。
1.7 侵袭实验 在含有基质胶的24孔板中加入细胞悬液200 μL,经过48 h后进行4%多聚甲醛固定,0.1%结晶紫染色,倒置显微镜观察计数实验组和对照组的细胞。
1.8 细胞计数 各实验组细胞胰酶消化后,完全培养基重悬成细胞悬液,计数;根据细胞生长快慢决定铺板细胞密度,37 ℃、5% CO2培养箱培养;从铺板后第2天开始,每天Celigo检测读板1次,连续检测读板5 d;计算出每次扫描孔板中带绿色荧光的细胞的数量;绘制5 d的细胞增殖曲线。
1.9 划痕实验 细胞铺板后37 ℃过夜培养,使用划痕仪对准96孔板的上端中央部位,向上轻推形成划痕;漂洗后37 ℃继续培养,根据愈合程度使用Celigo扫板,分析迁移面积。
1.10 荧光原位杂交(FISH)根据待杂交目的基因信息序列设计合成特异性的寡核苷酸探针并做相应荧光素标记,具体如下:Lnc-FAM83D-3:5′-CY3-CAGUGGCGCAAUCUUGGCUCACCACAACCUC-3′;U6:5′-CY3-CACGAAUUUGCGUGUCAUCCUU-3′。目的细胞经固定和透化后与探针杂交液37 ℃过夜孵育。DAPI复染核后,于正置荧光显微镜下观察并采集图像。
1.11 流式细胞术 按细胞凋亡试剂盒说明书,收集处理后的实验组与对照组细胞,与AnnexinⅤ和碘化丙啶 (PI)避光孵育15 min,经BD流式细胞仪鉴定并计数不同分裂周期中的细胞。
1.12 双荧光素酶报告基因实验 按照3×104个/孔的密度将 293T 细胞接种于 96 孔板,24 h 后按试剂说明书转染 miR-504-3p mimics 或 NC 和含 lnc-FAM83D-3 野生序列或突变序列的质粒,48 h 后通过荧光素酶报告基因检测系统测定萤火虫荧光素酶和海肾荧光素酶的活性。
1.13 Western bolt 用RIPA裂解液提取细胞总蛋白,经BCA蛋白检测试剂盒测定蛋白浓度。加入上样缓冲液,10 min后,取50 μg样品进行SDS-PAGE,再转移至PVDF膜上;用封闭液(5%脱脂奶粉)封闭2 h,TBST洗涤3次,加入一抗,4 ℃孵育过夜,TBST洗涤3次后加入二抗,摇床孵育2 h,清洗后进行蛋白曝光,应用Image J软件进行灰度值检测分析。
1.14 统计学方法 采用SPSS 22.0 版软件进行处理。数据采用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 lnc-FAM83D-3表达与预后相关性分析 乳腺癌在TCGA数据库中现存1 097例有可用数据的样本,其中成对组织(癌组织与癌旁组织)数据一共有112例,有病理信息且有癌组织RNAseq数据的样本有1 090例。与癌旁组织相比,lnc-FAM83D-3在乳腺癌组织中表达水平较高,见图1。进一步采用Kaplan-Meier生存分析显示,lnc-FAM83D-3高表达患者的10年总生存率低,差异有统计学意义(P=0.037),见图2。

图1 乳腺癌和癌旁组织中Lnc-FAM83D-3相对表达水平

图2 lnc-FAM83D-3表达水平与患者生存期的关系
2.2 TNBC组织及乳腺癌细胞的lnc-FAM83D-3表达水平 本院6例TNBC患者的癌旁组织与癌组织中lnc-FAM83D-3表达量分别为(0.25±0.06)和(0.49±0.11),P=0.002,见图3A。
正常乳腺上皮细胞系MCF-10A、TNBC细胞系HCC-1973及TNBC细胞系MDA-MB-231中lnc-FAM83D-3表达水平分别为(0.08±0.01)、(0.36±0.11)、(0.42±0.09),两组TNBC细胞系中lnc-FAM83D-3表达量相较正常乳腺上皮细胞中的表达量MCF-10Avs.HCC-1973,P=0.009;MCF-10Avs.MDA-MB-231,P=0.003,见图3B。

3A:TNBC癌旁组织与癌组织中lnc-FAM83D-3的相对表达水平,**P<0.01;3B:MCF-10A,HCC1973和MDA-MB-231细胞系中lnc-FAM83D-3的相对表达水平,**P<0.01图3 Lnc-FAM83D-3的相对表达水平
2.3 lnc-FAM83D-3在细胞内的定位情况 FISH结果显示,lnc-FAM83D-3几乎均表达于HCC1973细胞的胞浆中,见图4。
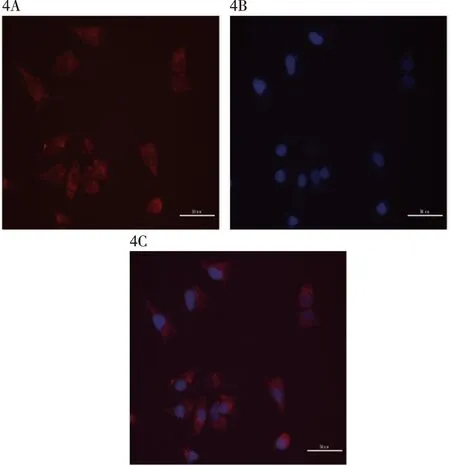
4A:红色荧光标记的lnc-FAM83D-3;4B:DAPI标记的细胞核;4C:Merge显示lnc-FAM83D-3定位图4 lnc-FAM83D-3在细胞内定位情况
2.4 lnc-FAM83D-3的表达水平与临床病理特征的关系 lnc-FAM83D-3的表达水平在不同肿瘤分期、远处转移以及病理分期的患者中表达差异有统计学意义(P<0.05),而lnc-FAM83D-3水平与淋巴结转移无关,差异无统计学意义(P>0.05),见表1。
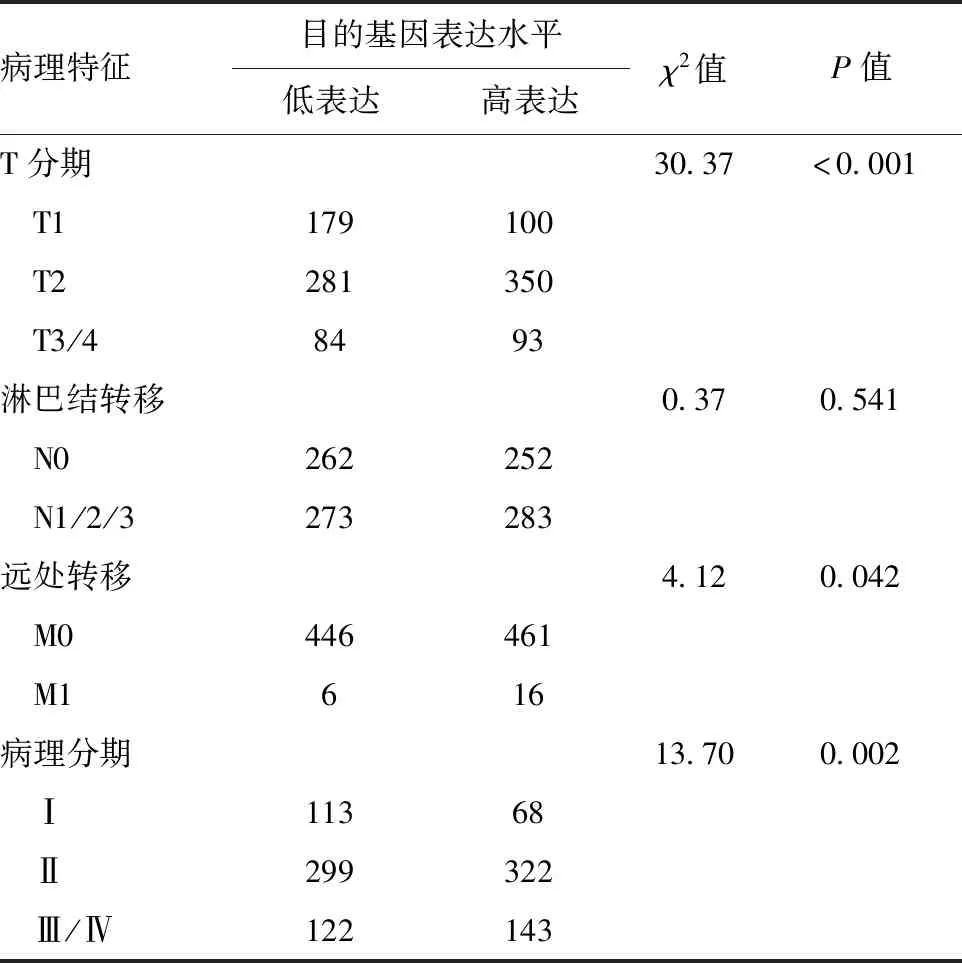
表1 lnc-FAM83D-3表达水平与乳腺癌患者临床病理特征的关系
2.5 干扰lnc-FAM83D-3表达对乳腺癌细胞增殖能力的影响 使用慢病毒lnc-FAM83D-3 siRNA分别转染HCC1937细胞和MB-231细胞。筛选后继续培养,第4天shNC、携带shlncRNA干扰片段的shlncRNA组HCC1937的细胞计数分别为(6 328±243)vs.(4 692±541),P=0.003,见图5A;MTT试验中两组OD值分别为(0.552±0.001)vs.(0.403±0.001),P<0.001,见图5B;shNC、shlncRNA组MDA-MB-231的增殖细胞计数分别为(3 587±69)vs.(613±20),P<0.001,见图5C;MTT试验中,两组OD值分别为(0.555±0.003)vs.(0.307±0.003),P<0.001,见图5D。提示降低lnc-FAM83D-3表达可削弱乳腺癌细胞的增殖能力。
2.6 lnc-FAM83D-3与TNBC细胞株凋亡的关系 FACS检测发现HCC1937细胞在shNC、shlncRNA组的凋亡比例分别为(3.17±0.06)vs.(9.60±0.20),P<0.001,见图6A;MDA-MB-231细胞在shNC、shlncRNA组中凋亡比例为(2.47±0.06 )vs.(10.70±0.10),P<0.001,见图6B。上述结果表明抑制lnc-FAM83D-3表达可促进HCC1937和MDA-MB-231细胞的凋亡。
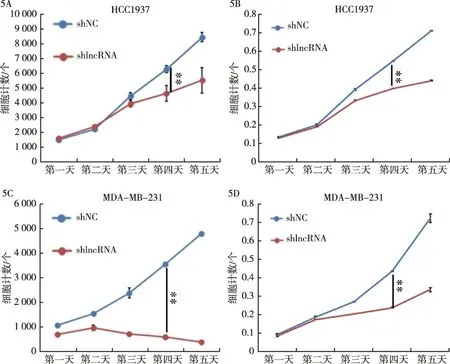
5A:shNC、shlncRNA组HCC1937细胞的计数,**P<0.01;5B:shNC、shlncRNA组HCC1937细胞的MTT试验,**P<0.01;5C:shNC、shlncRNA组MDA-MB-231细胞的计数,**P<0.01;5D:shNC、shlncRNA组MDA-MB-231细胞的MTT试验,**P<0.01图5 lnc-FAM83D-3表达对癌细胞增殖的影响
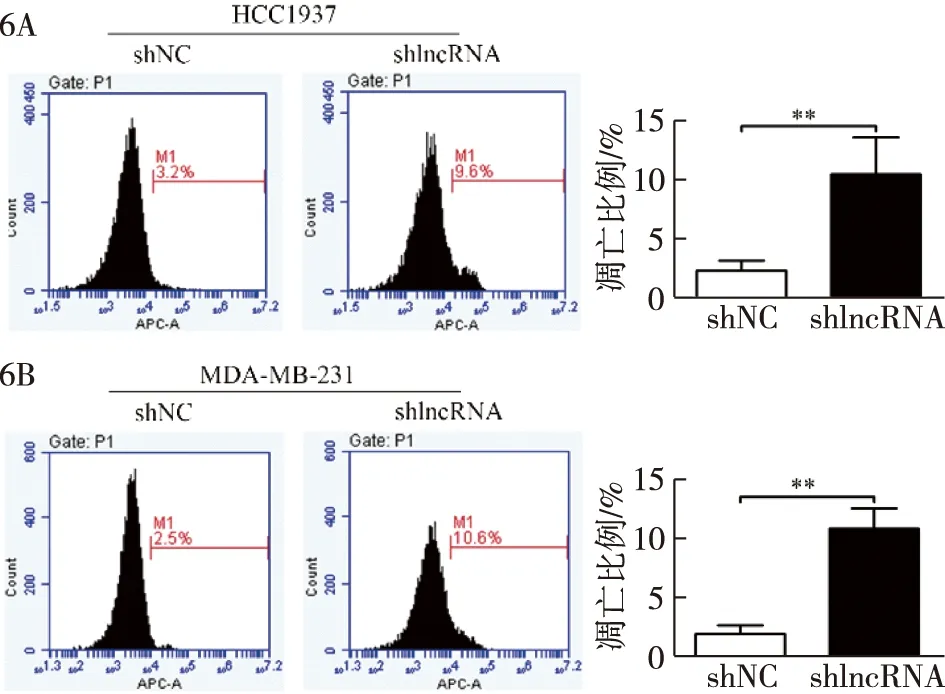
6A:shNC、shlncRNA组HCC1937细胞的凋亡比例,**P<0.01;6B:shNC、shlncRNA组MDA-MB-231细胞的凋亡比例,**P<0.01图6 lnc-FAM83D-3表达对癌细胞凋亡的影响
2.7 lnc-FAM83D-3对TNBC细胞株迁移和侵袭能力的影响 shNC、shlncRNA组HCC1937、的迁移率为(97.50%±2.70%)vs.(63.59%±2.59%),P<0.001,见图7A;shNC、shlncRNA组MDA-MB-231的迁移率为(50.08%±2.44%)vs.(27.40%±6.23%),P=0.004,见图7B。
侵袭实验中shNC、shlncRNA组HCC1937的侵袭细胞计数为(299.53±6.29)vs.(94.67±2.54),P<0.001,见图8A;shNC、shlncRNA组MDA-MB-231的侵袭细胞计数为(201.34±2.80)vs.(63.52±1.22),P<0.001,见图8B。上述实验结果证实lnc-FAM83D-3表达降低,TNBC细胞的迁移能力与侵袭能力降低。
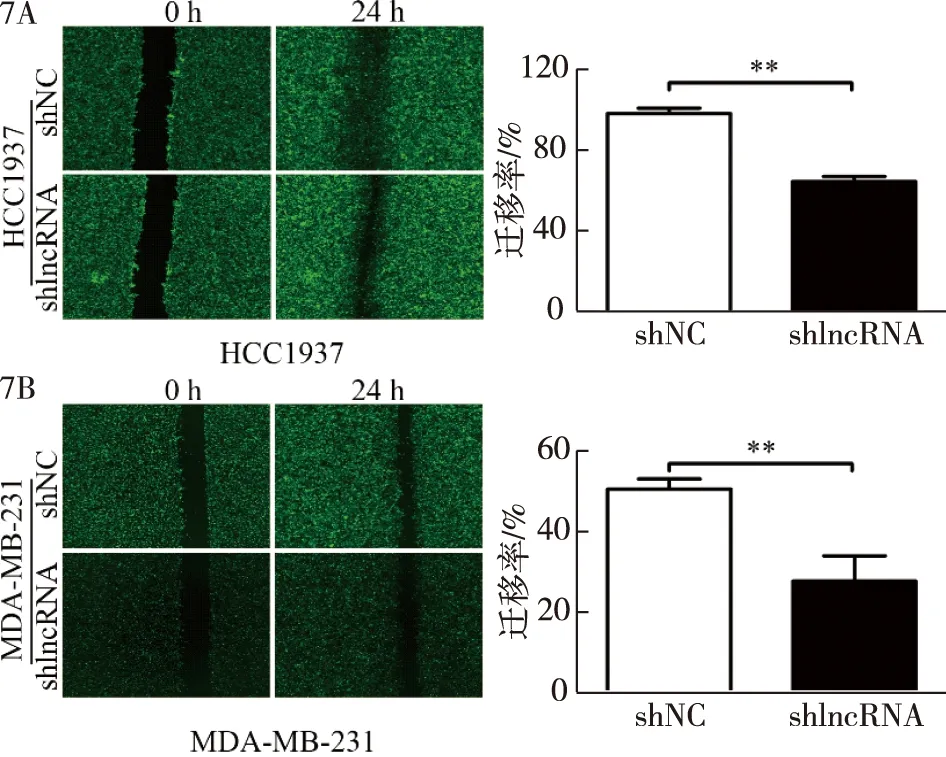
7A:shNC、shlncRNA组HCC1937细胞的迁移率,**P<0.01;7B:shNC、shlncRNA组MDA-MB-231细胞的迁移率,**P<0.01图7 lnc-FAM83D-3水平对TNBC细胞迁移能力的影响

8A:侵袭实验中,shNC、shlncRNA组HCC1937细胞的计数,**P<0.01;8B:侵袭实验中,shNC、shlncRNA组MDA-MB-231细胞的计数,**P<0.01图8 Lnc-FAM83D-3水平对TNBC细胞侵袭能力的影响
2.8 lnc-FAM83D-3和miR-504-3p的靶向关系
使用DIANA、miRDB、RNA22等生物信息学预测软件分析,miR-504-3p可能是lnc-FAM83D-3下游潜在作用靶点,见图9A。starBase预测显示lnc-FAM83D-3与miR-504-3p间的结合位点,见图9B。
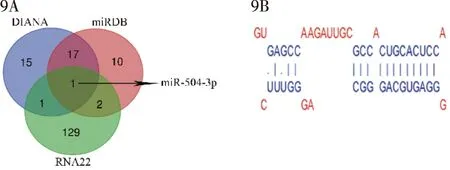
9A:生物信息学预测lnc-FAM83D-3潜在作用的miRNA;9B:lnc-FAM83D-3和miR-504-3p的结合位点图9 lnc-FAM83D-3与miRNA-504-3p的潜在结合位点
shNC组和shlncRNA组HCC1937、MDA-MB-231的miR-504-3p相对表达量分别为(0.19±0.05)vs.(0.48±0.04),P=0.002;(0.25±0.05)vs.(0.53±0.13),P=0.02,见图10。双荧光素酶报告基因实验结果显示,与单转染野生型lnc-FAM83D-3的细胞相比,共转染野生型lnc-FAM83D-3和miR-504-3p载体的细胞(1.00±0.21)vs.(0.51±0.07),P=0.018,荧光素酶活性降低,见图11。
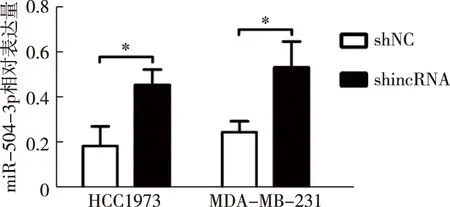
图10 lnc-FAM83D-3水平对miR-504-3p表达的影响,*P<0.05

图11 双荧光素酶报告基因,*P<0.05
2.9 lnc-FAM83D-3调控miR-504-3p对TNBC细胞功能的影响 将细胞分为同时干扰lnc-FAM83D-3表达和使用miR-504-3p抑制剂的shlncRNA+miR-inhibitor组、仅使用miR-504-3p抑制剂的miR-inhibitor组和对照miR-NC组。FACS发现,shlncRNA组相比shlncRNA+miR-inhibitor组,HCC1937的凋亡比例为(2.50±0.30)vs.(10.80±1.67),P=0.001;MDA-MB-231的凋亡比例为(2.51±0.30)vs.(10.08 ±1.80),P=0.002,见图12。
MTT试验第4天,shlncRNA+miR-inhibitor组与shlncRNA组HCC1937的OD值分别为(0.64±0.08)vs.(0.42±0.07),P=0.024;shlncRNA+miR-inhibitor组与shlncRNA组MDA-MB-231的OD值分别为(0.72±0.13)vs.(0.30±0.04),P=0.005。结果显示,在干扰lnc-FAM83D-3表达的细胞株中,抑制miR-504-3p表达会增强细胞的增殖能力,见图13。
划痕实验中,shlncRNA组对比shlncRNA+miR-inhibitor组,HCC1937迁移率分别为(60.1±13.0)vs.(93.5±12.2),P=0.033和MDA-MB-231迁移率分别为(27.3±4.2)vs.(53.3±12.7),P=0.028,迁移细胞计数差异有统计学意义,见图14。
侵袭实验中,shlncRNA+miR inhibitor组与shlncRNA组HCC1937细胞株侵袭细胞的计数分别为(106.2±15.5)vs.(230.3±30.4),P=0.003,MDA-MB-231细胞株中,两组的计数分别为(59.1±12.2)vs.(150.8±13.0),P=0.001,见图15。由此可见,lnc-FAM83D-3通过负向调控miR-504-3p表达,抑制TNBC细胞的凋亡,促进TNBC细胞增殖、迁移和侵袭。

12A:shNC组、shlncRNA组、shlncRNA+miR-inhibitor组、shlncRNA+miR NC组HCC1937细胞的凋亡比例,** P<0.01;12B:shNC组、shlncRNA组、shlncRNA+miR-inhibitor组、shlncRNA+miR NC组MDA-MB-231细胞的凋亡比例,** P<0.01图12 lnc-FAM83D-3与miR-504-3p对乳腺癌细胞凋亡的影响

13A:MTT试验中shNC组、shlncRNA组、shlncRNA+miR-inhibitor组、shlncRNA+miR NC组HCC1937细胞的OD值,*P<0.05;13B:MTT试验中shNC组、shlncRNA组、shlncRNA+miR-inhibitor组、shlncRNA+miR NC组MDA-MB-231细胞的OD值,** P<0.01图13 lnc-FAM83D-3与miR-504-3p对乳腺癌细胞增殖的影响
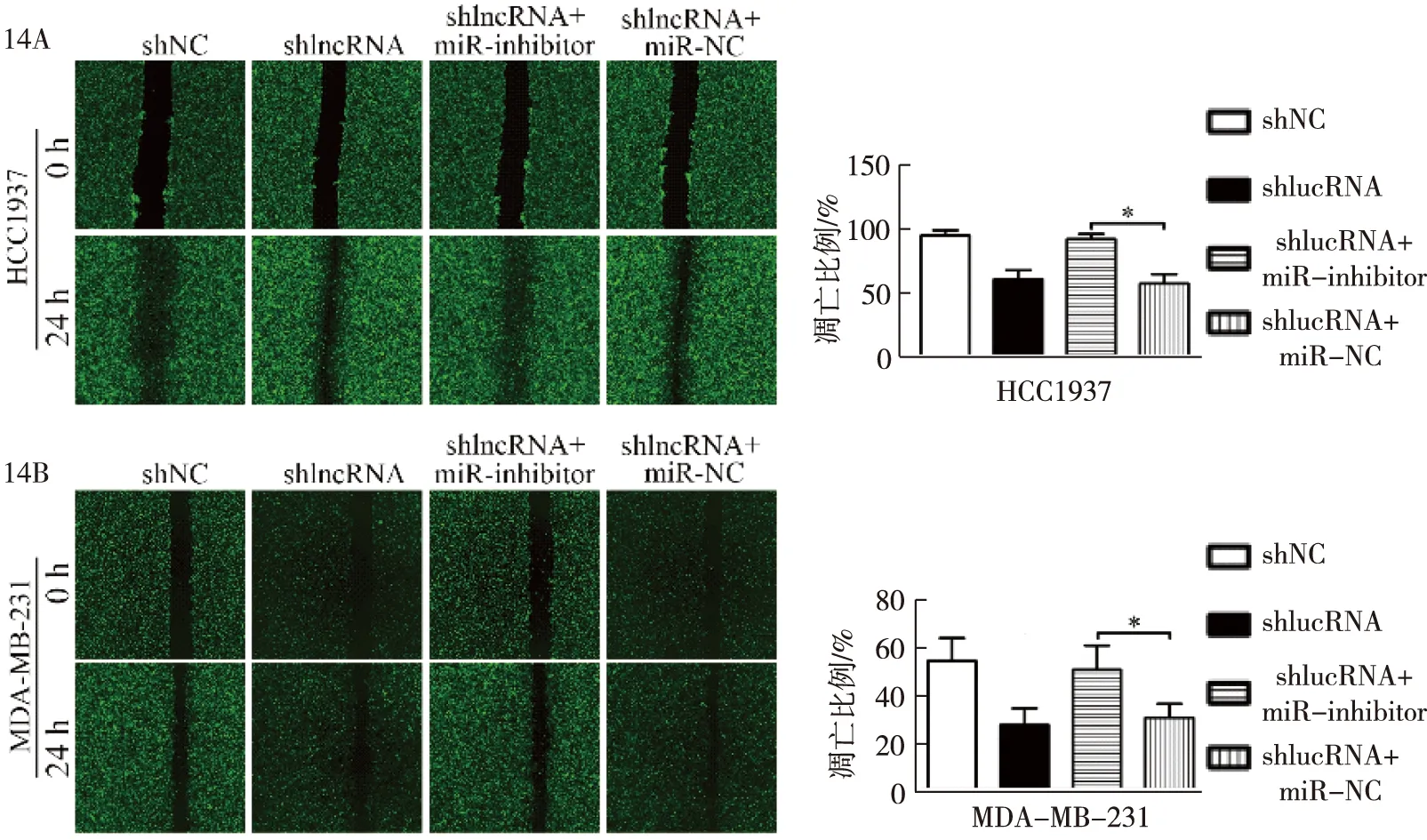
14A:shNC组、shlncRNA组、shlncRNA+miR-inhibitor组、shlncRNA+miR NC组HCC1937细胞的迁移率,*P<0.05;14B:shNC组、shlncRNA组、shlncRNA+miR-inhibitor组、shlncRNA+miR NC组MDA-MB-231细胞的迁移率,*P<0.05图14 lnc-FAM83D-3与miR-504-3p对乳腺癌细胞迁移的影响

图15 lnc-FAM83D-3与miR-504-3p对乳腺癌细胞侵袭的影响**P<0.01
2.10 miR-504-3p对FAM83D蛋白表达的影响 经Targetscan软件预测发现,FAM83D可能是miR-504-3p下游的潜在作用靶点,见图16。

图16 Targetscan软件预测FAM83D为下游作用靶点
双荧光素酶报告基因实验进一步证实,与FAM83D 3′UTR 突变型细胞相比,转染miR-504-3p载体的FAM83D 3′UTR 野生型细胞荧光素酶活性降低(P=0.000 5),见图17。
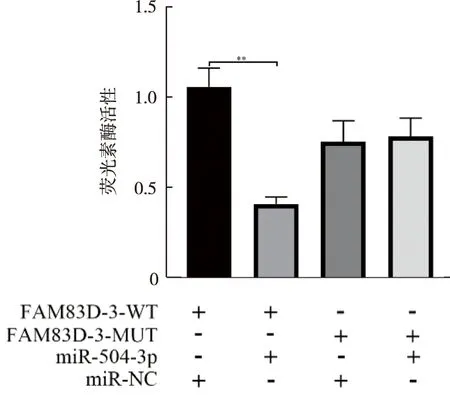
图17 双荧光素酶报告基因
Western bolt结果显示,减少miR-504-3p表达后FAM83D的蛋白表达水平增加,干扰Lnc-FAM83D-3表达后FAM83D的表达明显降低,而shlncRNA+miR-inhibitor组较shlncRNA组FAM83D表达上升,见图18。
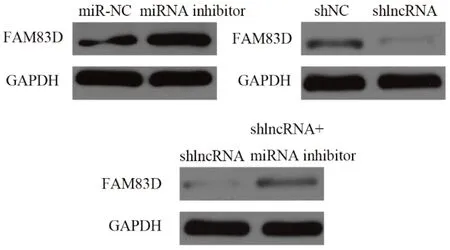
图18 各组HCC1937细胞的FAM83D水平
3 讨论
乳腺癌的发生及转移过程涉及诸多基因及信号通路的异常。其中部分lncRNAs已被证实参与乳腺癌发生发展的多个过程,还可调控细胞增殖、迁移及凋亡等多种生物信息学过程。但仍有部分lncRNAs在乳腺癌发生及发展过程中的作用机制尚未阐明,因而本研究积极探寻与乳腺癌患者生存相关的lncRNAs并探究其可能调控机制,为三阴性乳腺癌的靶向治疗提供潜在靶点。
本研究结果显示,lnc-FAM83D-3在三阴性乳腺癌患者癌组织、三阴性乳腺癌细胞HCC1937、MDA-MB-231中的表达量较癌旁组织、正常人乳腺上皮细胞系MCF-10A的表达量增加,这与既往在TCGA数据库样本中的统计结论基本一致。干扰lnc-FAM83D-3的表达后,HCC1937、MDA-MB-231细胞的增殖、迁移和侵袭能力明显降低,凋亡比例增加。说明lnc-FAM83D-3在乳腺癌的发生、发展过程中可能发挥着促癌的作用。
对于miR-504-3p的作用,目前还不明确,但一些研究证实在肾胚细胞瘤中,BLACAT2 能够通过降低miR-504-3p表达来促进肿瘤细胞的增殖和生长,抑制其凋亡[12]。在急性髓系白血病中,miR-504-3p通过抑制MTHFD2表达发挥抑癌作用[13]。综上所述,miR-504-3p在肾胚细胞瘤、急性髓性白血病中都发挥了抑癌作用,并可能作为判断患者预后的独立因子。本研究通过生物信息学预测显示miR-504-3p可能是lnc-FAM83D-3的下游潜在作用位点,采用双荧光素酶报告基因实验证实lnc-FAM83D-3竞争性结合并吸附miR-504-3p。进一步研究发现降低miR-504-3p表达可明显促进乳腺癌细胞增殖并抑制其凋亡,提示miR-504-3p可通过调控乳腺癌细胞增殖及凋亡过程进而参与其发展过程。
FAM83家族(Family with sequence similarity 83)与多种肿瘤的发生发展相关。其中研究较多的是微管结合蛋白FAM83D。Yan等[14]阐述了miRNA-495通过靶向调节FAM83D抑制结直肠癌细胞增殖和迁移的作用。Yin等[15]证实FAM83D可以诱导非小细胞肺癌的上皮-间质转化和顺铂耐药。除此以外,还有研究[16-17]证明FAM83D的过度表达与肝癌、卵巢癌、食管癌的恶性生物学活性相关。在既往的生物信息学研究[18]与RNA序列和微阵列数据挖掘[19]中,都提示FAM83D可能与三阴性乳腺癌的不良预后相关。这与本研究的结果相吻合。
综上,lnc-FAM83D-3在HCC1937和MDA-MB-231细胞中高表达,lnc-FAM83D-3可通过靶向调控miR-504-3p-FAM83D轴而影响乳腺癌细胞增殖、侵袭、迁移及凋亡。该分子的表达水平可以作为预后判断以及疾病转归的预测指标,也为三阴性乳腺癌的治疗提供了新的靶点。但关于lnc-FAM83D-3 的体内试验及其在临床诊断中的应用仍需深入研究。
