抗肿瘤“外泌体肽”的制备及在三阴性乳腺癌治疗中的应用研究
2022-01-05张薇吴旸董丽平唐金海
张薇,吴旸,董丽平,唐金海
近年来,乳腺癌已超过肺癌成为全球女性发病率最高,病死率第二的癌症[1]。三阴性乳腺癌是一种特殊亚型的高侵袭性乳腺癌,具有常规治疗疗效差、患者预后差、复发耐药率高、总体生存率低的特点。目前,手术、化疗、放疗、内分泌治疗、分子靶向治疗及免疫治疗仍是乳腺癌最常用的治疗方案[2-4]。其中,新辅助化疗已经成为三阴性乳腺癌标准治疗方案之一。临床常用的乳腺癌化疗药包括小分子类和蛋白类,其作用机制是通过干预核酸和蛋白质的生物合成和功能,从而抑制肿瘤细胞增殖,诱导细胞凋亡。其中,乳腺癌治疗常用的小分子类药物如他莫昔芬、依西美坦、紫杉醇等可以特异性地阻断肿瘤生长、增殖过程中所必需的信号转导通路[5-6]。蛋白质类药物主要是指抗体药,如曲妥珠单抗、拉帕替尼等,它们通过与靶细胞抗原结合进入肿瘤细胞,经裂解后释放细胞毒药物杀伤细胞。然而,由于广泛联合用药和乳腺癌细胞周期的失调,不良反应及乳腺癌耐药率不断上升[7]。三阴性乳腺癌的激素受体和人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)基因为阴性,常规的内分泌和靶向治疗更是无从应用,因此亟需发现新的安全有效的治疗药物。
与小分子药物相比,多肽类药物对目标肿瘤具有更高的亲和力和特异性,不良反应较低,可以增加肿瘤对其他治疗方法的敏感度。与抗体药物相比,多肽类药物体积小,更易渗透到组织,更容易改造[8]。多肽类药物主要通过诱导肿瘤细胞凋亡和坏死,抑制肿瘤血管生成,激活抗肿瘤免疫应答等机制发挥作用[9]。2018年,美国食品药物管理局(FDA)批准了第1个专门用于治疗胃肠胰腺神经内分泌肿瘤患者的药物177Lu-dotatate,它是一种生长抑素类似物和放射性核素的螯合物,通过多肽受体介导的放射性核素靶向治疗(PRRT)治疗肿瘤患者。Melflufen(Melphalan Flufenamide,又名Pepaxto)则是FDA批准的首个抗癌肽偶联药物,被用于治疗复发性/难治性多发性骨髓瘤成年患者。FK506结合蛋白样蛋白(FK506-binding protein like,FKBPL),作为免疫亲和蛋白家族的成员,是一种有效的分泌型抗血管生成蛋白[10]。FKBPL的高度有效的抗血管生成作用是由于N-末端区域内的一个独特序列,即FKBPL氨基酸34-58的24肽,通过CD44依赖机制抑制血管生成[11]。同时,FKBPL也是乳腺癌的预后生物标志物,能够有效预测乳腺癌内分泌治疗的敏感度[12-13]。因此,FKBPL有潜力通过抗血管生成来治疗三阴性乳腺癌。
尽管多肽药物在抗肿瘤过程中疗效显著,但其易被蛋白酶水解、理化稳定性较差、体内半衰期短、口服生物利用度低等缺点导致多肽类药物不能稳定地发挥作用。因此,需要借助药物载体将多肽药物递送到三阴性乳腺癌细胞,稳、准、狠地杀伤肿瘤细胞。外泌体是细胞分泌的直径在100~1 000 nm之间的细胞外囊泡,包裹丰富的内容物如RNA、蛋白和脂质等[14-16]。外泌体不仅可以作为肿瘤诊断的标志物,还可以作为肿瘤治疗药物的重要载体[17-22]。对外泌体进行基因修饰形成多价抗体重定向外泌体,可识别CD36和HER2,从而激活细胞毒T细胞,特异性攻击HER2阳性乳腺癌细胞[23]。多项研究表明外泌体装载多肽在多种疾病的动物模型中都有较好的治疗效果,在获得良好的疗效的同时均未发现明显的不良反应[24-26]。与外源性生物材料相比,外泌体可以避免免疫识别、炎症毒性、快速清除等难题[27-31]。本研究制备了一种细胞自然分泌的携带抗肿瘤多肽药物的外泌体,命名为“外泌体肽”,评估其在三阴性乳腺癌治疗中的应用效果。结果显示,“外泌体肽”表现出了较好的抗血管生成能力从而可以有效杀伤三阴性乳腺癌细胞,有望实现高效三阴性乳腺癌疗效。
1 资料与方法
1.1 实验试剂及材料 人肾上皮细胞293T细胞购自中国上海中科院细胞库,培养于含有10%胎牛血清、1%青霉素-链霉素的DMEM培养基中。人脐静脉内皮细胞HUVEC细胞和人三阴性乳腺癌细胞HCC1937细胞购自中国上海中科院细胞库,培养于含有10%胎牛血清、1%青霉素-链霉素的RPMI-1640培养基中。DMEM培养基、RPMI-1640培养基、胰蛋白酶、磷酸缓冲液(PBS)、多聚甲醛均购自于江苏凯基生物技术有限公司。胎牛血清(FBS)购自于美国Gibco公司。
1.2 表达FKBPL多肽的载体构建 将质粒载体PCDNA3.1与合成的目的基因分别加入含16 μl(1 μg)载体质粒/目的基因、2 μl 10×Buffer Cut S、1 μl(15 U)EcoRI和1 μl(15 U)NotI的酶切反应体系,37 ℃反应1 h后,切胶回收载体和目的基因片段。酶切后载体DNA片段经切胶纯化后,与上述目的基因段建立如下含有1 μl10× T4 DNA连接酶Buffer、3 μl酶切后的载体片段、5.5 μl酶切后的目的基因片段及0.5 μl T4 DNA连接酶的T4连接酶反应液体系,在37 ℃下反应1 h。随后,将甘油冻存保存的Stbl3菌接种划平板,37 ℃倒置培养过夜。挑取单克隆至装有3 ml LB的试管中,37 ℃ 220 rpm振摇12 h,吸取1 ml菌液至1.5 ml离心管中,4 ℃条件下12 000 g离心3 min,弃上清,用400 μl预冷的CaCl2重悬菌体沉淀,12 000 g离心3 min,弃上清,用200 μl预冷的CaCl2再次重悬菌体沉淀,置冰上过夜。将上述重组完的20 μl反应液全部加入200 μl感受态细菌中,置冰上1 h,42 ℃热激90 s,迅速置冰中5 min,加入600 μl经过37 ℃预热的LB培养液,37 ℃条件下以220 rpm速度振摇1 h,离心后全部涂布于含100 μg/ml Amp的LB平板,37 ℃倒置培养过夜。随机挑取4个单克隆至含,100 μg/ml Amp的3 ml LB培养液的试管中,37 ℃条件下以220 rpm振摇4 h,取100 μl离心,取菌体沉淀,用50 μl ddH2O重悬,沸水浴5 min,离心取1 μl上清液做模板,进行PCR鉴定,反应结束后,取10 μl进行1.0% Agarose电泳鉴定,将经菌落PCR鉴定为阳性克隆进行测序验证。最终得到3个表达FKBPL多肽的质粒载体,命名为FK1、FK2和FK3质粒。
1.3 FKBPL多肽的细胞表达和鉴定 用上述FK1、FK2和FK3 3种质粒转染人胚肾细胞株293T。首先,将293T细胞接种至6孔板中,待细胞汇合度达到70%~80%时,根据Lipo3000转染试剂(Thermo Fisher Science,美国)的试剂盒步骤进行质粒转染,转染体系包括充分混匀的125 μl Opti-MEM培养基和3.75 μl Lipo3000试剂(A管);充分混匀的125 μl Opti-MEM培养基、2.5 μg 质粒DNA(含有目的蛋白的质粒/对应空载质粒)及5 μl P3000试剂(B管)。将B管内容物加入A管,轻柔混匀后室温孵育10 min,滴加到含有1.75 ml无血清无抗培养基的六孔板中,待转染6 h后换成2 ml完全培养基继续培养48 h。随后,收集细胞,加入组织裂解液(RIPA,碧云天,中国)、蛋白酶抑制剂(PMSF,索莱宝,中国)裂解后,加入FKBPL多克隆抗体(Proteintech,中国)抗体。使用BIO-RAD曝光仪(ChemiDOCTm XRS+,BioRAD,USA)曝光,使用Image Lab采集图像并进行相应调整分析。
1.4 外泌体肽的制备 使用转染了FKBPL多肽基因的293T细胞进行FKBPL外泌体肽制备。所有细胞均置于37 ℃,5%CO2饱和湿度下。待细胞达到70%~80%的融合时,弃去旧培养基,加入适量PBS润洗后弃去,重复两次。使用含EDTA胰酶消化细胞,收集液体,4 ℃下500 g转速离心10 min弃去上清。加入1 ml PBS重新悬浮细胞沉淀,取10 μl细胞悬液,使用台盼蓝染料进行染色,并通过细胞计数仪计数。取2×107个细胞于新的15 ml无菌管中,加入适量PBS清洗细胞,4 ℃下以500 g速度离心10 min,重复2次,将细胞重悬至浓度含蛋白酶抑制剂(Protease inhibitor cocktail,04693132001,Roche,瑞士)。
本研究准备了10 μm、5 μm和1 μm的聚碳酸酯膜过滤膜(Nuclepore;Whatman Inc.,美国),通过不同孔径的过滤膜将细胞连续挤出。首先,将10 μm膜置于微型挤出仪(Avanti Polar Lipides,英国)中,加入准备好的细胞悬液,使用挤出仪挤出5次。随后,将收集液依次通过5 μm和1 μm的聚碳酸酯膜过滤膜,使用微型挤出仪分别挤出5次。以上收集到的液体中包含细胞衍生的外泌体和较大的细胞碎片,因此需要进一步纯化获得均匀尺寸的外泌体。使用超速离心机,通过密度梯度离心法对收集的外泌体进行纯化。使用碘克沙醇(OptiPrepTM,Sigma-Aldrich,美国)作为密度梯度离心介质,分别配制10%和50%碘克沙醇溶液。将1 ml 50%碘克沙醇溶液,2 ml和7 ml 10%碘克沙醇收集样本依次加入超速离心管中(收集样本在最上层),4 ℃ 100 000 g离心2 h。回收10%和50%碘克沙醇液面间富集的细胞外泌体,4 ℃下100 000 g离心2 h。弃去上清,加入100 μl PBS重悬,样本置于-80 ℃冰箱储存。
1.5 透射电镜(TEM)鉴定外泌体形态 取适当浓度的样品滴于电镜铜网上,孵育2 min后,用蒸馏水清洗,再将样品置于2%醋酸铀(SPI,美国)负染2 min,待样本干燥后,使用透射电子显微镜(Tecnai G2 Spirit Bio Twoic,Fei,美国)进行形态表征。
1.6 纳米颗粒跟踪分析仪(NTA)鉴定外泌体尺寸
为了分析外泌体的粒径分布和数量,使用ZetaView®PMX120纳米颗粒跟踪分析仪(ZetaView®PMX120,Particle Metrix,德国)。使用标准品校准后NTA后,用PBS将外泌体样品稀释至适当倍数后泵入测定。ZetaView的摄像机以60 s视频的形式记录单个粒子的散射,以确定平均速度和扩散率。最后,使用ZetaView®软件用于仪器控制和数据分析。
1.7 Western blot分析外泌体蛋白标志物 选择CD9和CD63作为表面标志物对外泌体进行鉴定。组织裂解液(RIPA,碧云天,中国)、蛋白酶抑制剂(PMSF,索莱宝,中国)以100∶1的比例配置外泌体裂解液。向离心收集的外泌体沉淀中加入10~20 μl裂解液,充分裂解外泌体后得到外泌体蛋白样品。加入SDS-PAGE Loding Buffer(新赛美,中国)混匀,99 ℃变性10 min。在PAGE凝胶的每个泳道中加入同等质量的蛋白样品,电泳分离,转至0.22 μm PVDF膜上。加入Anti-CD9抗体(1∶1 000,ab223 052,Abcam,美国)、CD63(1∶1 000,ab68 418,Abcam,美国)于4 ℃孵育过夜后,加入辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天,中国)在室温下孵育1 h。使用BIO-RAD曝光仪(ChemiDOCTm XRS+,BioRAD,USA)曝光,使用Image Lab采集图像并进行相应调整分析。
1.8 FKBPL多肽的细胞表达及鉴定 首先,合成24个氨基酸的人内源性FKBPL多肽(QIRQQPRDPPTETLELEVSPDPAS),其序列中A位氨基酸为重标氨基酸,作为标准品用于FKBPL多肽的质谱鉴定。首先,取定量内标FKBPL多肽溶解于预先配制好的0.1%的甲酸水溶液中(甲酸,水;V∶V,1∶1 000)使其浓度为1 pM。用0.1%甲酸溶液稀释配制中间稀释溶液,终浓度为100 fM。加入适量预先配制好0.1%的甲酸水溶液于100 KD、10 KD的滤膜中,在4 ℃、3 000 rpm条件下离心5 min,弃套管中液体。吸取50 μg的小肽实际样本或通过超声破碎的含FKBPL外泌体于100 KD超滤膜中,添加380 μl 0.1%的甲酸水溶液,充分混匀后在4 ℃、13 000 rpm离心20 min,该步操作重复2次。取超滤膜套管中的液体于10 KD的超滤膜中,在4 ℃、13 000rpm离心20 min,待100 KDa超滤膜套管中的液体用完后,在10 KDa的超滤膜中加入适量的 0.1%的甲酸水溶液,充分混匀后,在4 ℃、13 000 rpm离心20 min,该步操作重复2次。将10 KD超滤膜套管中截留的液体转移到EP管中,于真空浓缩仪中浓缩。后用0.1%甲酸溶液复溶为25 μl。步骤浓缩后干粉用0.1%甲酸溶液复溶为25 μl;取10 μl复溶样品和10 μl内标中间稀释液,内标终浓度为50 fM/μl,蛋白浓度为1 μg/μl。
随后,以色谱柱:ACQUITY UPLC BEH C18 1.7 μm 2.1×100 mm(Waters);流动相A:0.1%甲酸水(甲酸,水;V∶V,1∶1 000),流动相B:0.1%甲酸乙腈(甲酸,乙腈;V∶V,1∶1 000)。液相方法为0~1.0 min,10%B相;1.0~3.0 min,10%~90%B相;3.0~3.5 min,90%B相;3.5~3.8 min,90%~10%B相;3.8~5.0 min,90%~10%B相。采用正离子对数据采集,电喷雾电压5 500 V,离子传输管温度为400 ℃,Gas1、Gas2均为50 arb,碰撞能量均为30 eV为质谱条件,应用skyline计算方法对小肽及内标预测的b离子和y离子转移到质谱仪(QTRAP 6500+,SCIEX,美国),并采用多反应监测(MRM)对数据进行采集与分析。
质谱法检测并计算外泌体肽携带的FKBPL短肽含量的具体方法为,将定量的含FKBPL短肽的外泌体置于含1%体积比的Triton X-100(碧云天,中国)水溶液中并超声破碎5 min,随后加入总体积量0.1%的甲酸溶液并按上述方法检测其质谱峰强度并计算其所含FKBPL短肽的量。
1.9 FKBPL对乳腺癌患者影响的生信分析 首先,从UCSC Xena(https://tcga.xenahubs.net)下载癌症基因组图谱(the cancer genome alas,TCGA)泛癌标准化数据和临床信息。随后,从基因集富集分析(GSEA)数据库(http://software.broadinstitute.org/gsea/index.jsp)下载了50个标志性基因集。基因组变异分析(GSVA)谱转换R的GSVA(V1.25.4)软件包被用作估计关键基因集变异的非参数、无监督方法[32]。GSVA 算法的输入是log2微阵列表达值的基因表达矩阵和预先定义的基因集或预先存在的基因集(MSig)数据库的集合。GSVA 分数使用类似Kolmogorov-Smirnoff(KS)的随机游走统计和特定样本和基因集的负值以非参数方式计算。最后,将标准化的FKBPL表达值与H通过转换所得的HALLMARK_ANGIOGENESIS通路的GSVA分数进行相关性分析。P<0.05表示差异有统计学意义。
1.10 细胞对FKBPL外泌体肽的摄取 为了评估HCC1937细胞对FKBPL外泌体肽的摄取情况,首先,将HCC1937细胞以每孔2×105个细胞接种在35 mm培养皿中,在5%CO2的37 ℃培养箱中过夜培养。随后,向含FKBPL外泌体肽溶液中加入染色液(PKH26,Sigma-aldrich,美国),混匀后在4 ℃下,以100 000 g转速超速离心1 h,清洗2次。重悬后,加入到HCC1937细胞中共孵育6 h,取出培养皿加入细胞固定液即4%多聚甲醛固定30 min。加入2 mg/ml甘氨酸(碧云天,中国)中和过量醛基,摇床孵育5 min,后加入1 ml渗透剂(碧云天,中国)孵育10 min,再加入体积比为1∶1 000的DAPI染色液(碧云天,中国),用PBS清洗后置于激光共聚焦显微镜(LSM5 Live Carl Zeiss,德国)下拍摄。
1.11 外泌体肽影响三阴乳腺癌增殖分化实验 通过流式细胞法检测HEMA包被的培养板上HCC1937细胞中Delta样配体4(DLL4)和CD44的表达。具体地,用1.2%的聚甲基丙烯酸-2-羟乙酯(poly-HEMA,默克,中国)包被低黏附培养皿(NUNC,Thermo Scientific,美国),经PBS清洗2次后,每皿加入1 000个HCC1937细胞在37 ℃,5%CO2下培养24 h。随后,分别向培养皿中的培养基中加入FKBPL短肽含量为0、100和500 nM的外泌体肽并继续培养5 d。实验结束后,用1.5%的胰蛋白酶消化细胞并重悬于1 ml PBS中,加入DLL4(MA5-17068,Invitrogen,美国)和CD44流式抗体(11~0441~82,Invitrogen,美国)孵育15 min。最后,通过流式细胞仪(BD FACS,美国)检测DLL4和CD44的表达情况并统计。
1.12 HUVEC成管实验 为了探讨外泌体肽与肿瘤细胞血管生成关系,研究了外泌体肽对HUVEC细胞成管能力的影响。首先,在96孔板中每孔加入50 μl基质胶(Corning,美国),置于37 ℃细胞培养箱中孵育30 min使其形成凝胶。在每孔中加入100 μl HUVEC细胞悬液(约含10 000个细胞)后,向培养基中加入相当于FKBPL短肽含量分别0 nM、100 nM和500 nM的外泌体肽。在细胞培养箱中继续孵育24 h后至倒置显微镜(Primovert,Carl Zeiss,德国)下拍摄细胞形态。
2 结果与讨论
2.1 外泌体肽的制备及表征 由于免疫细胞衍生的外泌体含有免疫细胞依赖性肿瘤排斥反应的功能性MHC/肽复合物,工程化外泌体主要通过免疫细胞分泌获得。常见的获得外泌体的免疫细胞包括:NK细胞[28]、T细胞[33-35]、巨噬细胞[36]以及DC细胞[37-39]。工程化外泌体可来源于转染后的细胞分泌,但分离外泌体时大量多次离心会破坏外泌体结构,降低样品质量,且重复纯化必然导致外泌体损耗[40]。另一种方法是通过对细胞机械挤压法获得外泌体,仅1次纯化可以快速获得大量外泌体[41]。在此背景下,本研究选择了挤压法制备外泌体肽,流程如图1所示。首先,对工具细胞进行FKBPL转染,48 h后收集细胞,通过挤压法制备外泌体肽。
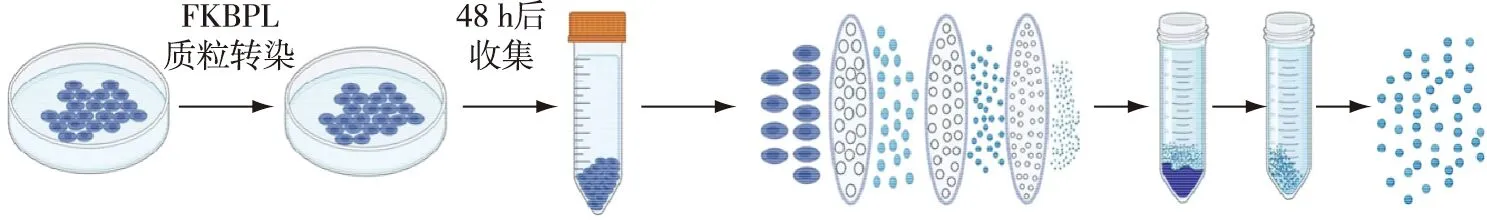
图1 外泌体肽制备流程示意图
如图2A所示,将目的基因序列片段通过酶切反应,克隆进入PCDNA3.1质粒载体中,成功制备了FKBPL基因目的短肽表达载体。图2B中测序结果表明FKBPL基因全长、85个氨基酸基因片段和150个氨基酸的3种基因片段,通过Kpn1/BamH1酶切位点正确克隆进入PCDNA3.1质粒表达载体中。图2C琼脂糖凝胶电泳实验表明,通过Kpn1/BamH1双酶切实验成功得到设计大小的目的基因片段,FKBPL基因目的短肽表达载体构建成功。质粒表达载体的成功构建,是FKBPL基因目的短肽表达的前提,实验参考多篇成功表达FKBPL基因目的短肽的文献,选取FKBPL基因全长、85个氨基酸基因片段和150个氨基酸基因片段构建了FK1、FK2和FK3质粒载体,以期后续成功得到目的短肽。随后,通过Western blot检测了这3种质粒转染后的293T细胞中FKBPL基因的表达水平,结果显示FKBPL基因全长(FK1)成功表达,FK2和FK3为短肽链,则无法通过Western blot法检出,因此条带与对照组无显著性差异(图2D)图2Ea为未装载多肽的外泌体。图2Eb所示TEM照片中清晰显示出外泌体的囊泡状结构,其形态与图2Ea一致。未表达FKBPL的外泌体肽的平均尺寸为(109.68±2.37)nm(图2Fa),NTA捕获的FKBPL外泌体肽的平均粒子尺寸为(141.16±4.44)nm(图2Fb),符合预期的外泌体特征。图2G中Western blot检测表明,CD9和CD63在外泌体提取物中表达丰度高,而在细胞中没有检测到表达。这些数据表明,本研究成功获取了具有完整外泌体结构的外泌体肽。
2.2 外泌体肽中的FKBPL短肽鉴定 通过液质联用质谱的方法鉴定了由质粒转染的293T细胞所制备的外泌体肽中的目的短肽FKBPL。根据阳性合成的重标短肽FKBPL的质谱结果,实验分析出5个不同分子质量的b离子和y离子作为FKBPL短肽的鉴定内标物来检测外泌体中的目的FKBPL短肽,该实验方法为多肽定性定量的通用检测方法,且具有优异的准确性。结果如图3A所示,与阳性重标的化学合成短肽FKBPL一致,FK1、FK2和FK3 3种质粒转染的293T细胞制备的FKBPL外泌体肽样本在质谱保留时间3.0 s处出现特征峰。在同样取10 000个由FK1、FK2和FK3质粒转染制备的外泌体肽样本中,FK2的质谱峰强度最大。说明FK2质粒转染293T细胞后,外泌体负载的目的FKBPL短肽含量最高。随后,通过质谱加内标方法检测了所制备的外泌体肽中FKBPL短肽含量。如图3B所示,递增浓度(1 000、2 000、4 000、8 000、16 000、32 000个外泌体)的外泌体肽溶液中FKBPL短肽的含量数据显示,随着外泌体量的增加,FKBPL短肽含量由55.27 nM增加至655.69 nM并达到了一个平台值。
2.3 外泌体肽的抗癌效应 图3C对32种TCGA癌症类型的血管生成相关通路进行Pearson相关性分析结果显示,FKBPL与胸腺瘤(r-0.505)、间皮瘤(r-0.396)、乳腺癌(r-0.353)的血管生成呈负相关(r-0.353,P<0.01)。为了验证FKBPL外泌体肽对三阴性乳腺癌的疗效,首先用PKH26染色液、DAPI染色液分别将FKBPL外泌体肽和细胞核染成了红色和蓝色,通过激光共聚焦显微镜拍摄的照片(图3D)可观察到外泌体肽被三阴性乳腺癌细胞HCC1937细胞大量摄取,有望提高FKBPL多肽的生物利用度。随后,为了评估外泌体肽对HCC1937细胞功能的影响,本研究通过流式细胞术检测poly-HEMA包被的培养皿上HCC1937细胞DLL4和CD44表达情况。实验结果如图3E所示,向HCC1937细胞加入等同于100 nM和500 nM FKBPL短肽的外泌体肽后,HCC1937细胞的DLL4表达显著降低至57.4%和25.4%,说明外泌体肽干扰了肿瘤细胞的干性维持。同时,肿瘤干性标志物CD44表达也显著性降低至至32.7%和28.4%。肿瘤细胞的增殖分化与肿瘤血管生成密切相关,大量新生血管的出现往往是肿瘤恶性增殖的前提。肿瘤新生血管的生成过程中往往伴随着DLL4和CD44表达的增加。CD44与其主要配体透明质酸(HA)结合后,会触发特异性信号通路促进肿瘤血管生成[42-44]。有研究发现,CD44+/CD24-乳腺癌细胞促进血管生成的能力更强。古老的抗蠕虫药物可减少三阴性乳腺癌中CD44+/CD24-细胞群数量,抑制肿瘤生长、血管生成以及肺和肝转移,降低循环血液中MMP-2和MMP-9水平[45]。DLL4是Notch信号通路的重要组成部分,介导干细胞的自我更新和血管发育,抗DLL4药物可通过干扰DLL4/Notch通路靶向肿瘤干细胞和肿瘤血管来改善肿瘤治疗效果。在三阴性乳腺癌中,抗DLL4药物和与紫杉醇(Taxol)联合治疗是有效的。基因表达分析显示,抗DLL4影响间质血管相关基因及肿瘤和间质中Notch靶基因。在紫杉醇治疗终止后,抗DLL4的纳入可延迟乳腺癌复发。Zang等[46]采用RT-PCR对62例乳腺组织和22例癌旁正常组织进行研究,结果显示,DLL4在乳腺癌组织中的表达量高于癌旁组织。他们指出DLL4表达水平与患者的淋巴结转移、组织学分级、肿瘤直径及临床分期有关,并预测DLL4可能诱导肿瘤血管生成,促进乳腺癌的侵袭和转移。肿瘤细胞FKBPL蛋白的表达量与其血管生成呈负相关关系,本研究数据提示,FKBPL外泌体肽可能通过HCC1937细胞的DLL4和CD44表达水平,抑制三阴乳腺癌的血管生成从而发挥抗癌效应。为了考察FKBPL短肽的外泌体肽对细胞血管生成的影响,进行了HUVEC细胞成管实验。血管内皮细胞的快速生长是血管生成的一个必要条件,HUVEC细胞在培养板中往往形成环状类血管结构。在基质胶上培养24 h后,HUVEC细胞形成了类圆形结构,表明其具有很好的血管生成能力(图3F-a)。加入100 nM外泌体肽处理后,HUVEC细胞成散列线状,无环形结构出现(图3F-b)。而加入500 nM外泌体肽后,HUVEC细胞成块状聚集,细胞生长受到严重影响(图3F-c)。据文献报道,FKBPL基因通过影响通路上Notch4基因而影响肿瘤的血管生成。研究数据验证了FKBPL外泌体肽具有同样的抗血管生成活性,因此具有通过抑制血管生成进而抗癌的潜力。

2A:FKBPL质粒结构图谱;2B:FKBPL质粒测序峰图;2C:FKBPL质粒酶切图;2D:FKBPL的Western blot分析;2E:外泌体(a)及外泌体肽(b)的代表性TEM照片,标尺为500 nm;2F:外泌体(a)及外泌体肽(b)的粒径分布;2G:外泌体标志蛋白CD9和CD63的Western blot验证图2 外泌体肽的制备及表征

3A:液相高分辨高精密度质谱(LC-HRMS)分析谱图;3B:外泌体肽的FKBPL多肽含量,a-f分别为1 000、2 000、4 000、8 000、16 000、32 000个外泌体的实验组;3C:癌症患者血管生成与FKBPL的相关性;3D:HCC1937细胞摄取外泌体肽的代表性共聚焦照片;3E:流式细胞术检测poly-HEMA包被的培养皿上HCC1937细胞DLL4和CD44表达情况;3F:内皮细胞成环实验的代表性照片(a为对照组,b和c分别为含100 nM和500 nM FKBPL短肽的外泌体肽处理组)图3 FKBPL外泌体肽的表达鉴定及抗癌效应
3 结论
当前,临床中治疗三阴性乳腺癌是不用抗血管治疗方案的。在三阴性乳腺癌的新辅助化疗方案中,联合贝伐单抗可显著提高患者的完全缓解率。但是,贝伐单抗虽延长了晚期患者的无病生存期,并未使总生存率发生明显改善。其他小分子酪氨酸激酶抑制剂如索拉非尼、阿帕替尼也未获得有利结果,多靶点抑制剂靶点较多,容易产生“脱靶效应”,且并发症明显,以血液学毒性、手足综合征、蛋白尿和高血压最常见[47]。根据2019年ASCO会议报道的中山大学孙逸仙纪念医院宋尔卫、刘强教授团队开展的一项Ⅱ期临床研究,阿帕替尼联合PD-1抑制剂卡瑞利珠单抗的无化疗方案在晚期TNBC患者中的应用可取得惊人疗效,表明抗血管治疗结合免疫治疗可给三阴性乳腺癌患者带来无需化疗的创新治疗方案。
Adam等[48]系统性地研究了抗血管肽AXT201对三阴性乳腺癌的治疗效果,发现AXT201可调控三阴性乳腺癌血管正常化,并具有免疫激活功能。在此背景下,本研究以抗血管生成类多肽FKBPL为抗癌药物,以外泌体为载体,构建了一种细胞自然分泌的携带抗肿瘤多肽药物的外泌体载药系统,提高了药物生物利用度和靶向性,从而实现了对三阴性乳腺癌的治疗,具有较好的应用前景,有望促进多肽类药物的发展和临床应用转化。本研究筛选了目的多肽的种类、长度等参数,最终选择了适合细胞自分泌的氨基酸长度的FKBPL多肽克隆至慢病毒载体中,最终使细胞稳定产生目标药物多肽而不被细胞内酶降解。实验制备的FKBPL外泌体肽表现出较好的进入细胞能力,最终表现出良好的抗血管生成和抗癌效应。当前,可装载的药物种类少、不可装载大分子靶向药物、潜在的免疫原性和促进转移的风险限制了外泌体作为药物载体的发展。本研究提出了一种新型载药方案,为外泌体载药方案提供了新的思路,为外泌体的抗癌治疗提供了方向。
