促红细胞生成素衍生肽腹腔注射对小鼠阿基霉素诱发的心脏毒性作用防治效果及其机制
2022-01-04安慧仙刘鹏云纪兆乐秦超师周海佳孙闯李炜曾广伟
安慧仙,刘鹏云,纪兆乐,秦超师,周海佳,孙闯,李炜,曾广伟
1西安国际医学中心医院心内科,西安 710100;2空军军医大学唐都医院心内科
促红细胞生成素衍生肽腹腔注射对小鼠阿霉素的阿霉素(DOX)是一种被广泛使用的一线抗癌药物,常与其他药物合用联合治疗各种癌症如血液系统癌(白血病、淋巴瘤、霍奇金淋巴瘤和非霍奇金淋巴瘤)和实体器官癌(乳腺癌、甲状腺癌、肉瘤、骨肉瘤等)[1-4]。然而,DOX存在剂量依赖的耐药性和容易引起严重心脏毒性反应,限制了其临床应用[5]。因此,寻找防治DOX心脏毒性的药物成为拓展DOX临床应用的重点和热点。
促红细胞生成素(EPO)是一种内源性糖蛋白激素,刺激红细胞生成,在临床上常用于治疗由慢性肾病、人类免疫缺陷病毒和化疗引起的贫血[6]。大剂量的EPO对组织器官具有保护作用,但会导致血栓形成、中风或高血压等严重不良作用。促红细胞生成素衍生肽即螺旋B表面肽(HBSP)是从促红细胞生成素(EPO)螺旋B的水表面衍生出来的11个氨基酸序列,其在多种组织中具有保护作用[7]。长期服用HBSP可预防心肌梗死后扩张型心肌病[8]。同时,研究表明HBSP能通过激活PI3K/Akt信号改善心肌细胞缺氧/复氧损伤[9]。然而HBSP在改善DOX诱发的心脏毒性作用的机制还不清楚。2020年5月—2021年6月,我们在对小鼠腹腔注射DOX的同时,注射HBSP,观察小鼠的心脏功能及心肌结构以评估HBSP对DOX心脏毒性作用的防治效果;检测心肌组织中凋亡及自噬相关蛋白(Cleaved Caspase-3、Cytochrome C、LC3B、Beclin1、LAMP2、p62)和信号通路相关蛋白(p-PI3K、p-Akt)以探讨HBSP对DOX心脏毒性作用的防治作用机制。
1 材料与方法
1.1 实验动物和试剂 40只8周龄健康雄性C57/bl6小鼠购于西安交通大学实验动物中心,体质量25~30 g,生产许可证号:SCXK(陕)2018-001。DOX购于Sigma公司,HBSP购于上海科肽生物科技有限公司,肌钙蛋白T(cTnT)试剂盒购于南京建成生物公司,Cleaved Caspase-3、Cytochrome C、LC3B、Be‐clin1、LAMP2和p62抗体均购于Cell Signaling Tech‐nology公司,GAPDH、山羊抗鼠和山羊抗兔抗体购于北京中衫金桥生物技术公司。多道生理记录仪MP150购自美国BIOPAC公司,蛋白免疫印迹化学发光仪购自美国伯乐公司,酶标仪购自美国赛默飞公司。
1.2 C57BL/6小鼠分组及DOX、HBSP、LY294002的腹腔注射方法 40只C57BL/6小鼠在动物房适应性喂养3 d后,随机分为4组,每组10只。药物的腹腔注射方法参照文献[7,10]进行。HBSP+LY294002组:一次性腹腔注射DOX(15 mg/kg),并腹腔注射30μg/(kg·d)的HBSP和20 mg/(kg·d)的LY294002,连续7 d;HBSP组:一次性腹腔注射DOX(15 mg/kg),并腹腔注射30μg/(kg·d)的HBSP,连续7 d;DOX组:一次性腹腔注射DOX(15 mg/kg);对照组(Con‐trol):腹腔注射生理盐水。
1.3 小鼠心脏功能的检测
1.3.1 小鼠心脏收缩和舒张功能的检测 DOX腹腔注射7 d后,将各组小鼠麻醉并固定在动物手术台,体视显微镜下辨别颈动脉并分离,穿线结扎远端,在颈动脉做一小切口,将连有压力传感器的动脉套管针沿切口插入颈动脉直至左心室,采用多道生理记录仪测量左室压力上升最大速率(+dp/dtmax)和左室压力下降最大速率(-dp/dtmax)。
1.3.2 小鼠血清中cTnT的检测 采用ELISA法。DOX腹腔注射7 d后,将各组小鼠麻醉并固定在动物手术台,剪开颈部皮肤,分离颈动脉并剪口取血;低温2 000 g离心10 min,取上清冻存于–80℃冰箱备用。按照ELISA检测试剂盒说明书步骤,酶标仪读取各组血清的吸光值并根据公式计算出各组血清cTnT的含量。
1.4 小鼠心肌结构的观察 采用HE染色法。DOX腹腔注射7 d后,将各组小鼠麻醉并固定在动物手术台,开胸游离心脏放入预冷PBS中冲洗以去除血液,然后将心脏放入4%多聚甲醛中室温固定48 h;行常规石蜡包埋和切片方法;将石蜡切片在二甲苯和梯度乙醇中脱蜡复水,再行苏木精和尹红染色,中性树胶封片。光学显微镜下观察各组心肌纤维结构。
1.5 小鼠心肌组织凋亡蛋白(Cleaved Caspase-3、Cytochrome C)、自噬相关蛋白(Beclin1、p62、LAMP2、LC3B、p-PI3K和p-Akt)、信号通路(p-PI3K、p-Akt)相关蛋白的检测 采用Western blotting法。剪取各组小鼠左室心肌组织并称重,用预冷PBS冲洗残余血液,2 000 g、4℃离心10 min,弃上清,并向沉淀中按照1∶5的比例加入裂解液(含蛋白酶抑制剂、磷酸酶抑制剂和RIPA),冰上研磨裂解30 min后,12 000 g、4℃离心30 min,取上清,行BCA法蛋白定量;常规SDS-PAGE胶电泳、湿转,室温下5 %脱脂奶粉封闭2 h,将目的蛋白条带放入相应的抗体管中孵育:Cleaved Caspase-3(1∶1 000)、Cytochrome C(1∶1 000)、Beclin1(1∶1 000)、p62(1∶1 000)、LAMP2(1∶1 000)、LC3B(1∶1 000)、p-PI3K(1∶1 000)、p-Akt(1∶1 000)和GAPDH(1∶5 000),4℃摇床过夜;次日,TBST室温洗涤3次,每次10 min,用HRP标记的山羊抗兔和山羊抗鼠二抗(1∶5 000)室温摇床孵育2 h,TBST洗涤3次,每次10 min;Bio-rad化学发光仪检测目的条带的灰度,并用Image Lab软件对条带灰度进行分析统计,以目的蛋白与相应GAPDH条带灰度的比值表示各组蛋白相对表达水平。
1.6 统计学方法 采用GraphPad Prism 8.0统计软件。符合正态分布的计量资料以±s表示,组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组心脏功能比较 与Control组相比,DOX组+dp/dt、–dp/dt降低,血清cTnT的含量增加(P<0.05);与DOX组相比,HBSP组+dp/dt、–dp/dt增加,血清中cTnT含量降低(P<0.05);与HBSP组比较,HBSP+LY294002组+dp/dt、–dp/dt降低,血清cTnT含量增加(P均<0.05)。详见表1。
表1 各组心脏功能比较(±s)

表1 各组心脏功能比较(±s)
注:与Control组比较,*P<0.05;与DOX组比较,#P<0.05;与HBSP组比较,^P<0.05。
组别DOX+HBSP+LY294002组DOX+HBSP组DOX组Control组+dp/dt 4 270±245^5 907±306#4 187±235*7 913±270-dp/dt 3 413±312^4 500±306#3 370±207*5 557±285 cTnT 25.1±1.51^11.6±0.91#26.0±2.39*7.5±0.74
2.2 各组心肌结构比较 HE染色结果显示,Con‐trol组心肌纤维排列整齐,胞质无空泡化现象;DOX组心肌纤维排列不规则并出现明显胞质空泡化;与DOX组比较,HBSP组心肌纤维排列改善,胞质空泡化明显减轻;与HBSP组比较,HBSP+LY294002组心肌纤维排列不整齐,并再次出现明显的胞质空泡化现象。详见图1。
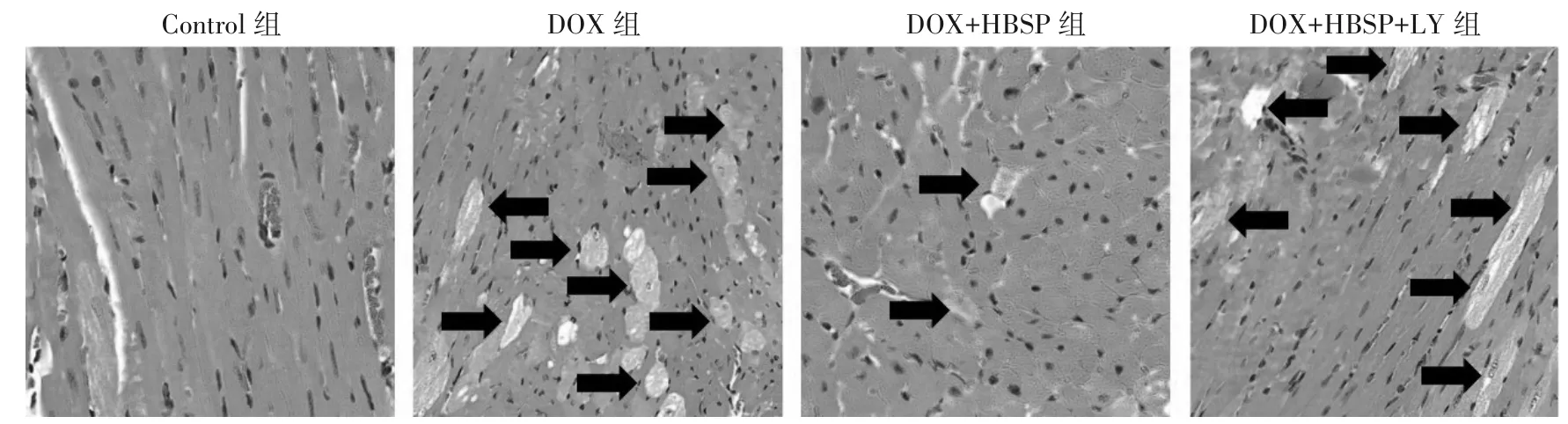
图1 各组小鼠光学显微镜下心肌结构(×200)
2.3 各组心肌组织凋亡蛋白、自噬相关蛋白及信号通路相关蛋白的相对表达量比较 与Control组比较,DOX组心肌组织中Cleaved Caspase-3、Cyto‐chrome C的相对表达量增加(P均<0.05);与DOX组比较,HBSP组Cleaved Caspase-3、Cytochrome C的相对表达量减少(P均<0.05);与HBSP组比较,HB‐SP+LY294002组Cleaved Caspase-3、Cytochrome C的相对表达量增加(P均<0.05),详见表2。
与Control组比较,DOX组心肌组织中Beclin1、p62、LAMP2蛋白的相对表达量及LC3BII/LC3BI升高(P均<0.05);与DOX组比较,HBSP组Beclin1、p62、LAMP2蛋白的相对表达量以及LC3BII/LC3BI降低(P均<0.05);与HBSP组 比 较,HBSP+LY294002组心肌组织中Beclin1、p62、LAMP2相对表 达 量 及LC3BII/LC3BI升高(P均<0.05),详见表3。
表2 各组Cleaved Caspase-3、Cytochrome C蛋白相对表达量比较(±s)

表2 各组Cleaved Caspase-3、Cytochrome C蛋白相对表达量比较(±s)
注:与Control组比较,*P<0.05;与DOX组比较,#P<0.05;与HBSP组比较,^P<0.05。
组别HBSP+LY294002组HBSP组DOX组Control组Cleaved Caspase-3 2.73±0.42^1.27±0.15#2.80±0.25*1.16±0.13 Cytochrome C 3 413±312^1.15±0.14#2.20±0.20*1.09±0.18
表3 各组Beclin1、p62、LAMP2、LC3B蛋白相对表达量比较(±s)

表3 各组Beclin1、p62、LAMP2、LC3B蛋白相对表达量比较(±s)
注:与Control组比较,*P<0.05;与DOX组比较,#P<0.05;与HBSP组比较,^P<0.05。
组别HBSP+LY294002组HBSP组DOX组Control组Beclin1 2.14±0.29^1.18±0.13#2.21±0.20*1.10±0.08 p62 2.37±0.33^1.22±0.19#2.48±0.36*1.08±0.11 LAMP2 2.43±0.15^1.07±0.18#2.53±0.17*1.13±0.14 LC3B 2.51±0.26^1.24±0.16#2.62±0.14*1.05±0.18
与Control组比较,DOX组心肌组织中p-PI3K和p-Akt蛋白相对表达量降低(P均<0.05);与DOX组比较,HBSP组心肌组织中p-PI3K和p-Akt蛋白的相对表达量增加(P均<0.05);与HBSP组比较,HBSP+LY294002组p-PI3K、p-Akt蛋白的相对表达量降低(P均<0.05),详见表4。
表4 各组p-PI3K、p-Akt蛋白相对表达量比较(±s)
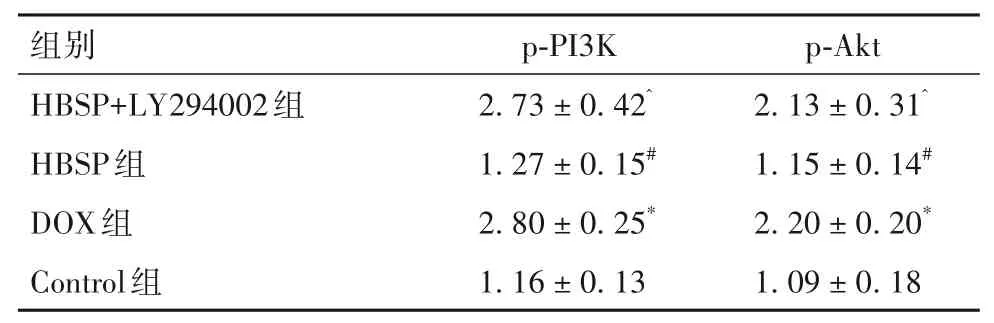
表4 各组p-PI3K、p-Akt蛋白相对表达量比较(±s)
注:与Control组比较,*P<0.05;与DOX组比较,#P<0.05;与HBSP组比较,^P<0.05。
组别HBSP+LY294002组HBSP组DOX组Control组p-PI3K 2.73±0.42^1.27±0.15#2.80±0.25*1.16±0.13 p-Akt 2.13±0.31^1.15±0.14#2.20±0.20*1.09±0.18
3 讨论
在接受蒽环类药物如DOX治疗的成年患者中约有9%的患者会出现心脏毒性,并呈剂量依赖性和时间依赖性,这成为导致肿瘤患者不良预后的重要原因[11]。DOX引起的心脏毒性严重限制其临床应用,然而临床上可用于防治DOX的药物很少。目前DOX心脏毒性作用较为明确的两种机制是活性氧的生成以及对细胞DNA和不同细胞内蛋白的损伤,破坏拓扑异构酶介导的DNA修复[12-13]。除此以外,我们前期的结果和其他研究报道都证实自噬是DOX引起心脏毒性的重要原因,但具体机制还未完全阐明。
DOX心脏毒性的主要病理表现是左心室功能障碍和心肌纤维结构损伤[14]。使用DOX治疗时,部分患者左心室功能会表现出剂量依赖性降低,并最终发展为充血性心力衰竭。在本研究中,DOX组小鼠左室功能降低,表现为+dp/dt和-dp/dt降低,血清cTnT含量增加;HE染色显示DOX组心肌胞质出现严重空泡化,这些结果表明DOX会导致心脏收缩和舒张功能损伤,并引起心肌纤维结构的病理性改变。而HBSP组小鼠左室+dp/dt和-dp/dt升高,心肌胞质空泡化减少,血清cTnT含量降低。这些结果说明HBSP可改善DOX心脏毒性。
研究表明,DOX引起心肌细胞凋亡和自噬加重,导致心肌细胞数量减少[15]。Caspase-3被剪切成Cleaved Caspase-3,以及Cytochrome C由线粒体释放到胞质,在细胞凋亡启动和进展过程中发挥重要作用[16]。自噬在维持细胞稳态和存活中发挥重要作用[17]。自噬是一个动态过程,包括自噬小体的形成、自噬溶酶体的形成以及自噬溶酶体内含物的降解。LC3I/II、Beclin1、p62和LAMP2在自噬的动态过程中发挥关键作用,是检测自噬的标志性蛋白[18]。本研究发现,DOX组Cleaved Caspase-3和Cytochrome C的蛋白表达量增加,自噬相关蛋白LC3BII/LC3BI、Beclin1、p62和LAMP2的表达量也增加,表明DOX可诱导心肌细胞凋亡和自噬;而HBSP组Cleaved Caspase-3和Cytochrome c的蛋白表达降低,LC3BII/LC3BI、Beclin1、p62和LAMP2的表达降低,这说明HBSP能减轻DOX诱导的心肌细胞凋亡和自噬。
PI3K/Akt通路在细胞存活、增殖、生长、代谢和血管生成等过程中发挥重要作用[19]。有研究发现,DOX能通过下调PI3K/Akt通路诱导心肌细胞凋亡[20]。而PI3K抑制剂3-MA可抑制DOX诱导的心肌细胞自噬和凋亡。但PI3K/Akt通路是否参与HBSP对DOX心脏毒性的抑制作用还不清楚。本研究发现,DOX组心肌组织中p-PI3K和p-Akt的表达降低,提示DOX抑 制PI3K/Akt通 路;HBSP组p-PI3K和p-Akt的表达升高,说明HBSP可激活PI3K/Akt通路,同时PI3K抑制剂LY294002能阻断HBSP对PI3K/Akt通路的调控作用。
总之,HBSP可通过抑制细胞凋亡和自噬减轻DOX诱导的心脏毒性,而这一作用与调控PI3K/Akt信号有关。本实验阐明了HBSP具有减轻DOX诱导的心脏毒性的作用,为临床治疗DOX诱导的心脏毒性提供了新的实验和理论依据。但HBSP如何调控PI3K/Akt信号还不清楚,下一步将阐明HBSP对PI3K/Akt信号的调控机制。
