外周血CLEC-2水平对创伤性颅脑损伤患者近期死亡风险的预测价值
2022-01-04唐仕军
李 方, 唐仕军, 杜 伟, 张 诚, 李 育
(新疆维吾尔自治区人民医院神经外科, 新疆 乌鲁木齐 830001)
创伤性颅脑损伤(traumatic brain injury,TBI)是临床上的急危重症,病死率、致残率高。原发性脑损伤和继发性脑损伤是TBI的两个重要的病理生理过程。原发性脑损伤主要由直接外力引起,无法预防。继发性脑损伤则是与炎症、凝血障碍、细胞凋亡和其他因素有关[1]。在继发性脑损伤的病理生理变化中,凝血障碍患者占到30%左右。据报道[2],血小板功能障碍在凝血障碍的发生发展中起着关键作用。目前TBI急性反应中导致血小板功能障碍的机制尚不清楚,有研究指出这种功能障碍与早期血小板过度活化有关[3]。临床实践发现[4],重度颅脑损伤病人的血小板计数、压积、平均体积和分布宽度等指标出现显著变化。血小板活化基本上参与了TBI后继发性脑损伤的进展,可能是通过协调复杂的血栓刺激反应,血小板、免疫细胞和接触激活系统之间的相互作用破坏了血脑屏障,激活了炎症系统,导致神经元兴奋性增高,神经毒性物质集聚,损害了神经功能。C型凝集素受体-2(CLEC-2)是具有碳水化合物结合能力的家族性FCA2+依赖性蛋白的成员,广泛表达于血小板的质膜上,可通过其内源性配体荚膜蓝蛋白或蛇毒毒素红细胞素激活血小板。CLEC-2是止血和血栓形成过程中必不可少的血小板活化受体[5]。此外研究表明[6],急性缺血性脑卒中患者发病后90d内血浆CLEC-2浓度升高与卒中进展和预后不良高度相关。目前尚无研究TBI患者血浆CLEC浓度与预后相关性的报告,本研究旨在探讨血浆CLEC-2浓度与TBI患者预后的关系。
1 资料与方法
1.1纳入与排除标准:纳入本院从2018年3月至2020年1月收治的113例TBI患者,纳入标准:①符合中重型颅脑损伤救治指南(第四版)[7]中的诊断标准。②均行MRI或颅脑CT检查证实并行开颅去骨瓣减压术。③年龄≥18岁。④临床资料完整。排除标准:①GCS评分<3分者。②临床资料不完整者。③术后48h内死亡无法获得本研究需要的实验室检查结果者。本研究已上报本院医学伦理委员会并获批。
1.2方法:所有患者入院后完善血常规、肝肾功能、头部CT等相关检查,并予以纠正电解质紊乱、甘露醇降低颅内压等对症处理措施和急诊行开颅去骨瓣减压术。
1.3临床资料收集:收集所有患者性别、年龄、伤后至入院时间、基础疾病史(高血压、糖尿病、冠心病、脑卒中)、吸烟史、饮酒史、CT显示的颅脑损伤部位、入院时格拉斯哥昏迷评分(GCS)、急性生理与慢性健康状况(APACHE-Ⅱ)评分等临床资料。
1.4实验室检查指标:入院后抽取患者静脉血,监测血常规(全自动血常规分析仪)、血乳酸、肌酐、纤维蛋白原、C-反应蛋白(CRP)水平等指标水平(采用全自动生化分析仪);采用酶联免疫吸附法测定血浆中CLEC-2水平。
1.5随访分组:记录113例患者伤后30d死亡情况,据此分为死亡组和存活组。

2 结 果
2.1分组情况及两组临床资料比较:113例患者30d内出现35例死亡,病死率为30.97%,据此分为死亡组(n=35)和存活组(n=78);对比两组患者临床资料显示,死亡组GCS评分低于存活组,脑室出血比例、APACHE-Ⅱ评分、年龄、血清CRP水平与CLEC-2水平高于存活组,差异具有统计学意义(P<0.05),见表1。
表1 两组患者临床资料比较
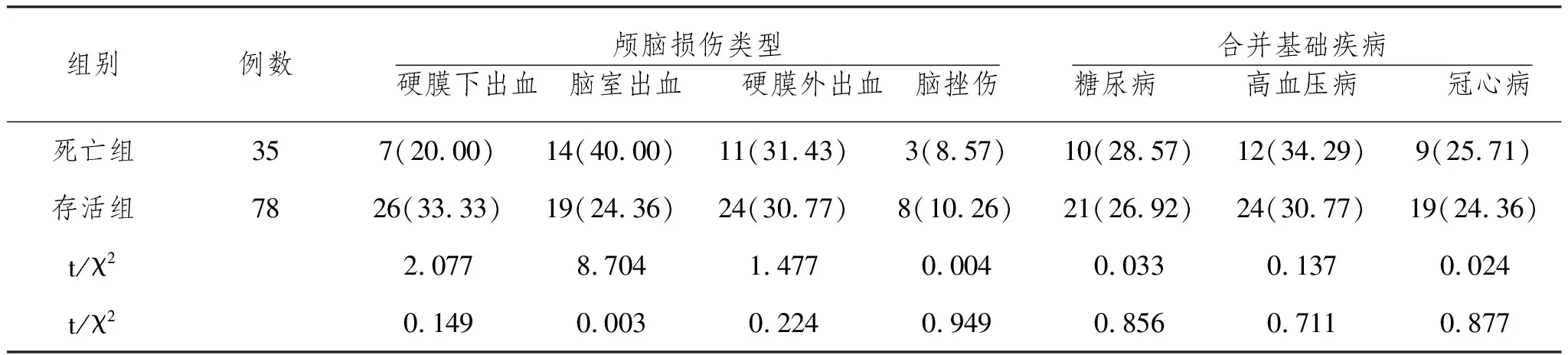
组别例数颅脑损伤类型硬膜下出血 脑室出血 硬膜外出血 脑挫伤合并基础疾病糖尿病 高血压病 冠心病死亡组357(20.00)14(40.00)11(31.43)3(8.57)10(28.57)12(34.29)9(25.71)存活组7826(33.33)19(24.36)24(30.77)8(10.26)21(26.92)24(30.77)19(24.36)t/χ22.0778.7041.4770.0040.0330.1370.024t/χ20.1490.0030.2240.9490.8560.7110.877

组别例数血红蛋白(g/L)白细胞(×103/mm3)血肌酐(μmoL/L)血乳酸(mmoL/L)CRP(mg/L)CLEC-2(pg/mL)死亡组35128.34±14.7815.71±3.4096.69±30.692.18±0.7518.12±4.77433.65±89.76存活组78130.11±13.8015.25±4.2595.26±29.712.12±0.6214.23±3.58289.77±67.46t/χ20.6170.5640.2340.4454.6049.429t/χ20.5390.5740.8150.6570.0000.000
2.2影响TBI患者30d死亡风险的相关因素分析:多因素logistic回归分析显示,脑室出血(OR=1.845)、年龄越大(OR=1.122)、CLEC-2水平越高(OR=1.022)是导致TBI患者30d死亡风险增加的独立危险因素(P<0.05);GCS评分越高(OR=0.303)是TBI患者30d死亡风险增加的独立保护因素(P<0.05),见表2。
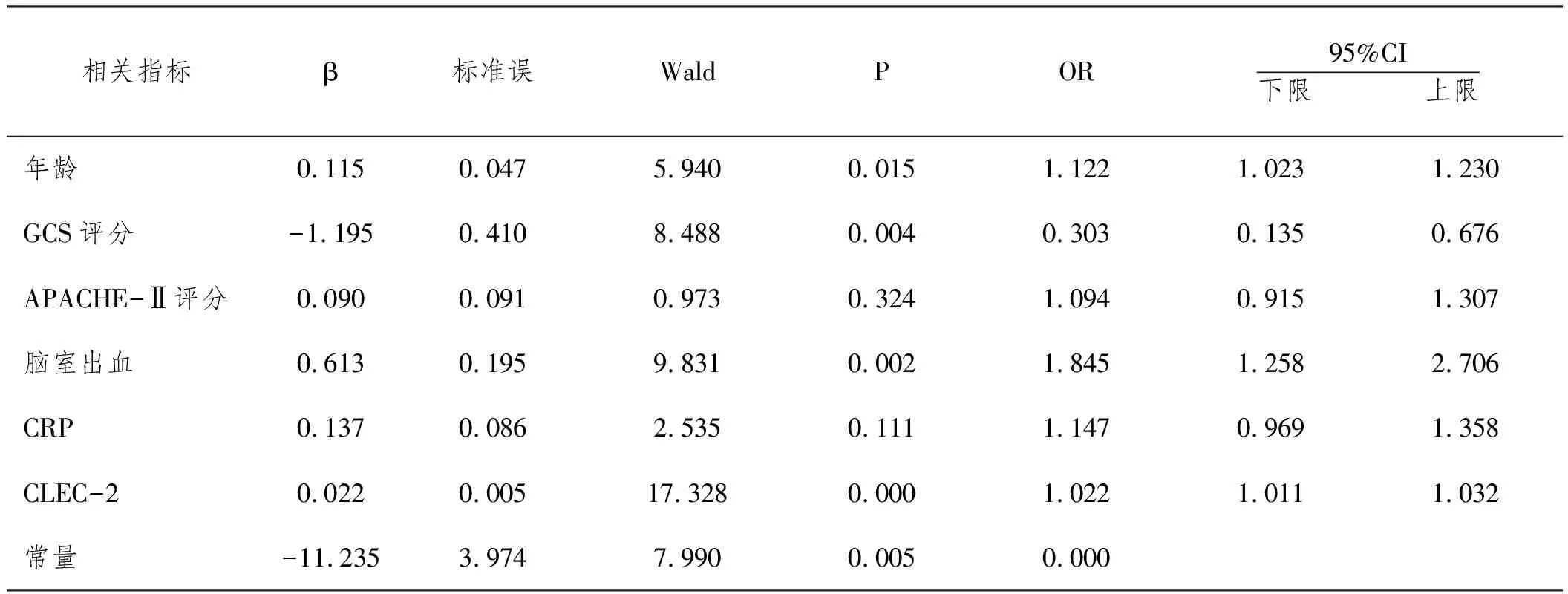
表2 影响TBI患者30d死亡风险的logistic回归分析
2.3CLEC-2在早期评估TBI患者30d死亡的ROC曲线和预测效能:ROC曲线分析显示,CLEC-2水平在早期评估TBI患者死亡风险的曲线下面积为0.910,高于GCS评分、年龄以及脑室出血;截点值为314pg/mL,诊断敏感度为71.43%,特异度为94.87%,见图1,表3。
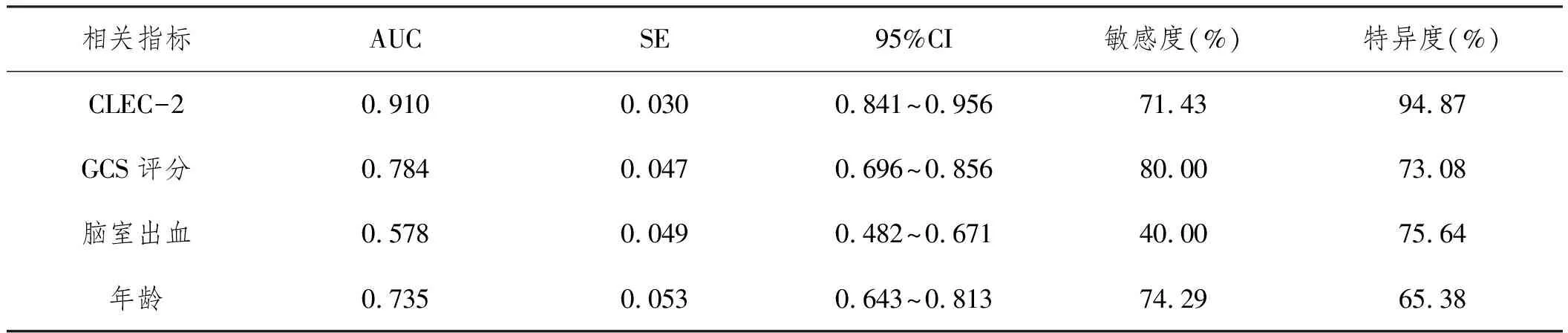
表3 CLEC-2在早期评估TBI患者30d死亡风险的预测效能
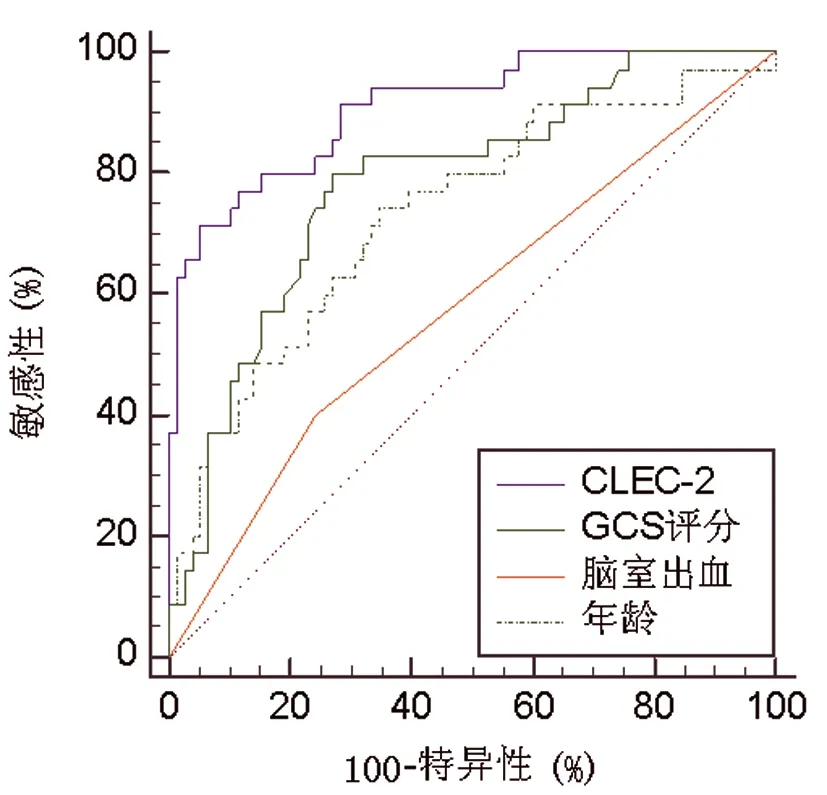
图1 CLEC-2在早期评估TBI患者30d死亡风险的ROC曲线
3 讨 论
有证据表明,TBI患者并发凝血功能障碍是预后不良的独立危险因素,与未并发凝血障碍的患者相比,其不良结局风险增加30倍[8]。有研究显示[9],CLEC-2在血栓性疾病中对于稳定血小板聚集具有一定作用,在止血和动脉血栓形成过程中与糖蛋白具有协同作用,可能成为抗血栓药物作用的靶点。目前研究结果显示,TBI患者血清中CLEC-2水平较正常人群明显升高[10]。但关于CLEC-2水平升高幅度与脑损伤程度的相关性分析较少,故本试验基于此,对CLE-2水平的评估预后价值进行分析,现将研究结果报道如下。
在本研究中结果显示,死亡组患者的GCS评分、脑室出血比例、APACHE-Ⅱ评分、年龄、血清CRP及CLEC-2水平与存活组患者相比较存在明显差异。通过对上述指标进一步行Logistic回归分析,结果表明,低GCS评分、脑室出血、高龄、高CLEC-2水平是导致TBI患者30d死亡的独立危险因素。高龄的TBI患者,其身体各项机能退化,脑部萎缩,颅脑损伤后会产生大量的氧自由基,且年龄较大的患者其抗氧化能力偏弱,无法及时清除氧化应激所导致的继发性损伤[11]。GCS评分包括睁眼、语言、运动三项情况,分数越低,表示患者颅脑损伤越严重,患者长期存活的可能性更低[12]。脑室作为脑质内部的室管系统,含有大量的脉络丛,产生脑脊液充盈脑室并注入蛛网膜下腔营养神经组织。脑室内出血则会刺激周边脑组织分泌更多的炎症介质,局部组织的水肿则会导致阻塞性脑积水,且该部位引流困难,周边紧邻延髓生命中枢,病死率较高。研究指出[13],因颅脑创伤所致的继发性脑室出血占脑室出血比例的90%,且病死率高达60%~90%。
此外,CLE-2预测TBI患者30d死亡风险的ROC曲线示,CLEC-2水平在早期评估TBI患者死亡风险的AUC为0.910,高于GCS评分、年龄以及脑室出血;其诊断的最佳截点为314pg/mL,诊断敏感度为71.43%,特异度为94.87%,证明CLEC-2在早期评估TBI患者近期死亡风险方面具有良好的应用价值。CLEC-2能够影响TBI患者近期死亡的原因可能与能够促进血小板聚集、加重颅脑内部凝血障碍,进而加剧了受损神经组织的损伤程度有关。此外,C-型凝集素受体激活Syk信号转导通路也可能也参与多种神经系统疾病的神经炎性反应,而特异性抑制该通路激活可以抑制神经炎症,抗凋亡及改善神经功能损伤。
综上,血浆CLEC-2浓度升高与30d死亡密切相关,可作为临床上评估TBI患者预后新型生物学标志物。
