VTRNA2-1在特应性皮炎患者外周血T淋巴细胞中的表达分析
2022-01-04万梦婕范秀红
万梦婕, 王 薇, 范秀红
(中南大学湘雅医学院附属海口医院暨海口市人民医院皮肤性病科, 海南 海口 570208)
特应性皮炎(Atopic Dermatitis,AD)主要以皮肤干燥、瘙痒、炎症等为特征,是一种慢性且易复发的皮肤性疾病[1]。据文献报道,全球AD患病率成人达2%~5%[2,3]。AD因病程较长和反复发作性严重影响着患者的生活质量,同时对家庭及社会构成巨大负担。目前对于AD发病机制研究较为复杂,涉及上皮屏障功能障碍、免疫系统过度活化、皮肤微生物群失调等方面[4]。早期研究发现,T淋巴细胞的免疫失衡在AD发病过程中扮演着关键的角色,而长的非编码RNA(lncRNA)作为功能性大分子可充当T淋巴细胞过程的调节剂[5]。穹窿核糖核酸2-1(vault ribonucleic acid 2-1,VTRNA2-1)是一种穹顶RNA,最初被分类为microRNA前体hsa-mir-886,又称为“Nc886”,是一种新型的lncRNA[6]。VTRNA2-1被认为是先天免疫反应中活化蛋白激酶R(protein kinaseR,PKR)的内源性调节剂,且发现VTRNA2-1的表达在人类CD4+激活过程中高度上调T细胞[7]。但目前在皮肤疾病中描述VTRNA2-1与 PKR的作用研究报道较少,因此,本研究探讨VTRNA2-1在AD患者中的基因表达水平,分析其与PKR存在的相互作用关系。
1 对象与方法
1.1研究对象:收集2018年1月至2020年5月期间在本院皮肤科的AD患者50例为AD组,同期内另选取体检科行健康体检者30例设为对照组。AD组男28例,女22例,年龄22~53岁,平均(35.25±9.25)岁;对照组男14例,女16例,年龄24~55岁,平均(35.72±9.07)岁,两组性别及年龄比较无统计学意义(χ2=0.655/t=0.222,P均>0.05)。纳入标准:①AD患者符合《中国特应性皮炎诊疗指南(2020版)》诊断标准[8];②年龄≥18岁;③患者及家属均在知情且同意参与本研究。排除标准:①伴有其他类型皮肤疾病;②入组前一个月内曾接受过免疫抑制剂、糖皮质激素等药物治疗史;③恶性肿瘤、伴有心肝肾等器官严重疾病者。本实验经医院伦理委员会批准。
1.2分组:对于符合标准的AD患者,入院后收集其特应性皮炎评分指数(Scoring Atopic Dermatitis Index,SCORAD)[9],该评分包括A(皮损面积)、B(皮损严重程度评分)、C(瘙痒程度和影响睡眠程度评分)三部分。计算公式:SCORAD总分= A/5+7B/2+C,根据总分评定 AD 的严重程度并进行分组:轻度AD组(0~24分,n=25),中度AD组(25~50分,n=16),重度AD组(51~103分,n=9)。轻度AD组男15例,女10例,年龄25~53岁,平均(34.51±9.04)岁;中度AD组男10例,女6例,年龄22~50岁,平均(34.07±9.11)岁;重度AD组男3例,女6例,年龄23~50岁,平均(34.74±9.07)岁。三组性别及年龄比较无统计学意义(χ2=2.313/F=0.125,P均>0.05)。
1.3实验方法
1.3.1标本采集与处理:患者入组后由熟练的护士采集AD患者和健康体检患者外周血5mL肝素抗凝,并迅速送至实验室进行实验检测。血样本在4℃,3000rpm离心15min,收集血清样本进行编号,分装于干净EP管中,-80℃冰箱保存备用。
1.3.2外周血单个核细胞分离:取全血标本稀释,水平转子800g离心30min,吸取白色单核细胞层15mL放置离心管中,加入10mL细胞洗涤液再次250g离心10min,重复两次后弃上清,细胞重悬备用,采用差异贴壁法纯化细胞2~4h。细胞稀释液充分混匀后,滴10μL到玻璃计数板上使细胞稀释10倍后进行细胞计数,在无菌条件下通过免疫磁珠方法(130-045-101,Miltenyi Biotec,德国)从外周血单个核细胞中阳性选择纯化CD4+T细胞。
1.3.3实时荧光定量PCR检测各组VTRNA2-1基因表达:细胞总RNA的提取:取CD4+T细胞放置冰上孵育20min,取出后室温静置10min,加入200μL氯仿,放入高速低温离心机中,12000rpm离心10min,弃上清,保留底部沉淀RNA,溶解获得总RNA,上机检测RNA浓度及纯度。逆转录PCR:参照相关试剂盒说明书加入试剂,混匀后低速离心20s使其沉淀,获得RNA逆转录成的cDNA。VTRNA2-1基因引物序列:F:CGACCCCAGTCATAAACTATGA;R:AAGACCCCTCCCAGATAGATA。采用7500 Fast实时荧光定量PCR系统(品牌:赛默飞世尔)进行扩增,-ΔΔCt法计算VTRNA2-1基因相对表达率。
1.3.4Western blot检测CD4+T细胞VTRNA2-1蛋白表达:取细胞悬液进行总蛋白质的提取,根据BCA蛋白定量试剂盒(产地:中国/上海;品牌:泽叶生物)操作说明书进行蛋白质定量,将配制好的蛋白缓冲液放置于95℃以上水浴加热10min至蛋白质变性后,冷却离心10min,-80℃保存。根据十二烷基硫酸钠-聚丙烯酰胺凝胶试剂盒中的说明书制备凝胶进行凝胶电泳和凝胶成像,利用Image Lab软件分析条带灰度值,计算VTRNA2-1蛋白质相对表达量。
1.3.5免疫共沉淀实验分析VTRNA2-1蛋白与其相互作用蛋白:使用试剂盒提取总蛋白质进行蛋白质定量,置-80℃保存,脱硫生物素标记体外转录的VTRNA2-1与素磁珠和链霉亲结合,再与正常细胞质蛋白裂解液孵育,裂解细胞以13000r/min离心15min得到蛋白上清液,后加入洗脱液洗脱去除杂蛋白,通过Western blotting实验进行验证。

2 结 果
2.1AD组与对照组VTRNA2-1基因相对表达量比较:AD组患者外周血CD4+T淋巴细胞中VTRNA2-1基因表达水平为1.55±0.19,对照组为0.77±0.32,两组比较,AD组患者VTRNA2-1表达呈高水平状态,差异有统计学意义(P<0.05),见图1。

图1 AD组与对照组VTRNA2-1基因表达水平比较
2.2不同程度AD患者VTRNA2-1基因相对表达量比较:轻度AD组患者外周血CD4+T淋巴细胞中VTRNA2-1表达水平为1.22±0.19,中度AD组为1.55±0.11,重度为1.79±0.12,不同组间比较差异均具有统计学意义(P<0.05),见图2。

图2 不同程度AD患者VTRNA2-1基因表达水平比较
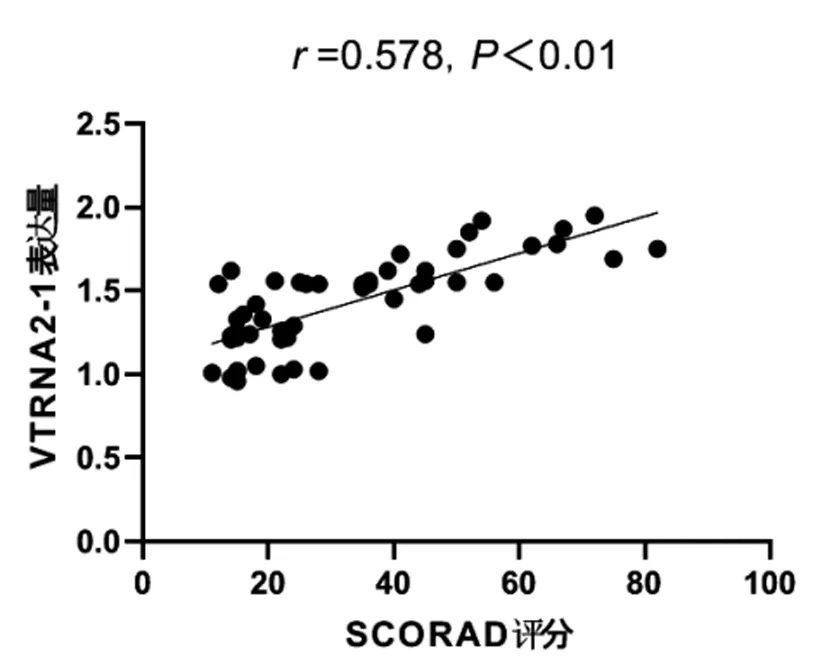
图3 SCORAD评分与VTRNA2-1基因表达水平关系分析
2.3SCORAD评分与VTRNA2-1基因相对表达量的关系:Pearson相关性分析结果显示,AD患者SCORAD评分越高,其外周血CD4+T淋巴细胞中VTRNA2-1表达水平也随之升高,两者存在明显的正相关,见图3。
2.4VTRNA2-1蛋白水平及其直接作用蛋白:免疫共沉淀实验结果显示,CD4+T细胞中有蛋白激酶R(protein kinaseR,PKR)蛋白的表达,此实验方法得到的PKR蛋白质在细胞内与VTRNA2-1特异性结合。AD组患者CD4+T细胞中 VTRNA2-1和PKR的蛋白表达量较对照组高(P<0.05),见图4和表1。

图4 蛋白质印迹法检测VTRNA2-1和PKR蛋白

表1 AD组与对照组VTRNA2-1和PKR蛋白表达水平
3 讨 论
参与AD病理过程的细胞种类有很多,其中CD4+T细胞亚群在介导内源性AD中发挥着更为重要的作用,当表皮细胞破损后分泌胸腺基质淋巴细胞生成素,激活固有淋巴细胞使其分泌Th2型细胞炎症因子,从而促使AD引起炎症反应,而这些炎症因子又会与肥大细胞等相互作用,进而加重炎症反应[10]。限于AD当前治疗手段的有限性,有必要进一步深入研究AD的发病机制,为临床提供更佳的治疗靶点。
本研究首先采用了AD患者与健康的患者形成对照比较,发现VTRNA2-1基因表达水平在AD患者中显著增高,进一步将AD患者按照疾病严重程度进行分组,结果显示,VTRNA2-1基因表达水平随着AD严重程度的加重而升高,且后续研究证实了SCORAD评分于VTRNA2-1基因表达水平存在明显的正相关,因此初步认为VTRNA2-1在活化的分泌细胞因子的人CD4+T细胞中高度上调,其升高可能与AD疾病严重程度有关。VTRNA2-1基因的高表达在许多肿瘤组织中均有表现,其可以通过启动二核苷酸修饰在表观遗传上受控制,并且可以发挥抑癌或致癌功能,且VTRNA2-1启动子的甲基化状态及其与临床相关参数存在相关性[11]。不过在与细胞因子产生相关的T细胞活化过程中,VTRNA2-1是以依赖于持续刺激的方式高度上调。Sallustio等[12]在IgA肾病患者研究中发现高甲基化区域的VTRNA2-1参与了CD4+T细胞的应答和增殖,该区域导致CD4+的TCR信号强度降低,使得T细胞及其异常反应和激活可能解释了T辅助细胞的不平衡。
为了评估VTRNA2-1参与AD具体机制情况,我们进行了RNA印迹分析和免疫共沉淀实验,印迹实验证实了VTRNA2-1蛋白在活化细胞的上调,同时还测试了最丰富的PKR蛋白表达,发现VTRNA2-1在VTRNA2-1表达细胞中与PKR共免疫沉淀。既往在癌细胞中已发现VTRNA2-1与关联并抑制RNA依赖的PKR蛋白,在人T细胞中也如此,由于VTRNA2-1具有细胞质,可与PM1人类T细胞系中的PKR相互作用,同时VTRNA2-1可抑制人CD4+T细胞细胞系裂解物中介导的PKR活化[13,14]。VTRNA2-1的表达及其与PKR的相互作用可以作为控制PKR与各种信号通路相互作用的能力的开关,这种开关改变通路的存在,其中PKR在病程进展参与抗增殖促凋亡的作用,因此可以解释VTRNA2-1的高表达状态可能是激活相关PKR信号传导的主要调节因子[15]。
综上所述,VTRNA2-1在AD患者的CD4+T淋巴细胞中呈高表达状态,VTRNA2-1表达升高可能加重患者临床症状严重程度,因此VTRNA2-1可能是是T细胞介导的炎症的标志物,其机制可能是通过人类细胞中PKR依赖性信号传导和相关细胞因子产生的调节剂,在AD病理过程中发挥调控作用,可作为未来临床治疗靶标。
