帕博利珠单抗二线治疗含铂化疗进展的驱动基因阴性NSCLC的临床研究
2022-01-04陈嘉劼朱正秋单海霞孔飞飞
陈嘉劼, 朱正秋, 单海霞, 孔飞飞
(1.徐州医科大学肿瘤内科, 江苏 徐州 221000 2.徐州医科大学附属医院肿瘤内科, 江苏 徐州 221000)
NSCLC是致死率极高的恶性肿瘤之一,因其易发生转移,患者往往预后差[1]。靶向药物的发展对NSCLC的治疗有所改善,但只有小部分患者有驱动基因突变,而且大多数癌症患者对靶向治疗产生耐药性[2]。近年来,对于驱动基因阴性的晚期NSCLC患者,靶向PD-1/PD-L1通路的免疫疗法成为了很有前途的治疗选择[3]。一项Ⅲ期KEYNOTE-010研究[4]已经证实,对于PD-L1 TPS≥1的含铂化疗进展后EGFR/ALK突变阴性或未知的晚期NSCLC,帕博利珠单抗用于二线治疗取得了相较于传统多西他赛治疗更佳的近期及远期疗效,且安全性更佳。但该研究中研究对象多为白种人,对于亚洲人群疗效尚不清楚,且由于NMPA尚未批准该适应症,目前国内有关帕博利珠单抗二线用于晚期NSCLC患者的研究较少。因此,本研究将探讨帕博利珠单抗二线治疗PD-L1 TPS≥1的含铂化疗进展后驱动基因阴性的晚期非小细胞肺癌患者的疗效及不良反应。
1 资料与方法
1.1一般资料:收集从2018年1月到2021年4月我院收治的7838例晚期NSCLC患者的病历资料,排除既往行靶向、免疫及多西他赛治疗患者3415例,排除驱动基因突变患者1412例,排除行免疫治疗之前未行PD-L1 TPS检测或结果阴性者1152例,排除未二线治疗2周期或治疗后3个月内死亡者681例,排除脑转移患者654例,排除合并其他肿瘤或重大系统疾病者312例,排除发生重度不良反应停药者及失访者108例,最终纳入104例患者病历资料。纳入标准:①确诊为NSCLC;②驱动基因阴性;③临床分期:ⅢB或Ⅳ期;④一线治疗使用含铂化疗至少2周期后进展;⑤ECOG PS(美国东部肿瘤协作组行为状态评分)0~2分;⑥患者接受至少2周期二线治疗,且治疗后生存期大于3个月。排除标准:①对本次研究药物过敏或产生严重不良反应停止用药者;②严重肝、肾功能不全者;③合并其他肿瘤或重大系统疾病者;④脑转移者;⑤患者既往行靶向、免疫及多西他赛治疗;⑥治疗前未测PD-L1 TPS或结果阴性者;⑦使用激素者;⑧二线治疗不足2周期者或治疗后不足3个月死亡;⑨失去随访者。该104例患者按着治疗方案不同分为研究组(n=51)和对照组(n=53),两组患者的年龄、性别、吸烟史、组织类型、临床分期、PD-L1 TPS结果、既往放疗史、转移部位、多发转移的差异无统计学意义(P>0.05),具有可比性。见表1。

表1 患者的基本资料n(%)
1.2治疗方法:研究组:帕博利珠单抗注射液(MSD Ireland,100mg/4mL,批准文号S20180019),剂量2mg/kg静脉输注30min以上,每三周给药一次;对照组:多西他赛注射液(江苏恒瑞医药股份有限公司,0.5mL:20mg或1.5mL:60mg或2.0mL:80mg,国药准字H20020543),剂量75mg/m2静脉输注1h,每三周给药一次。直至出现疾病进展或不可接受的毒性,出现不良反应者均予以对症处理。
1.3观察指标:①近期疗效:选用RECIST1.1(实体瘤评价标准)于治疗4周期后对患者的病情进行影像学评价,并于4~6周后确认。计算患者的客观缓解率(ORR)、疾病控制率(DCR)。CR为完全缓解,PR为部分缓解,SD为病情稳定,PD为病情进展,ORR=(CR+PR)例数/总例数×100%,DCR=(CR+PR+SD)例数/总例数×100%。②远期疗效:PFS:患者使用药物使用至病情进展/死亡的时间。至随访结束时,尚未进展的患者PFS统计至其最后随访日期为止。③不良事件按照美国国家癌症研究所不良事件通用术语标准(4.0版)进行分级。

2 结 果
2.1两组近期疗效的比较:研究组与对照组的ORR无统计学差异(P>0.05);研究组的DCR比对照组高,差异有统计学意义(P<0.05)。见表2。
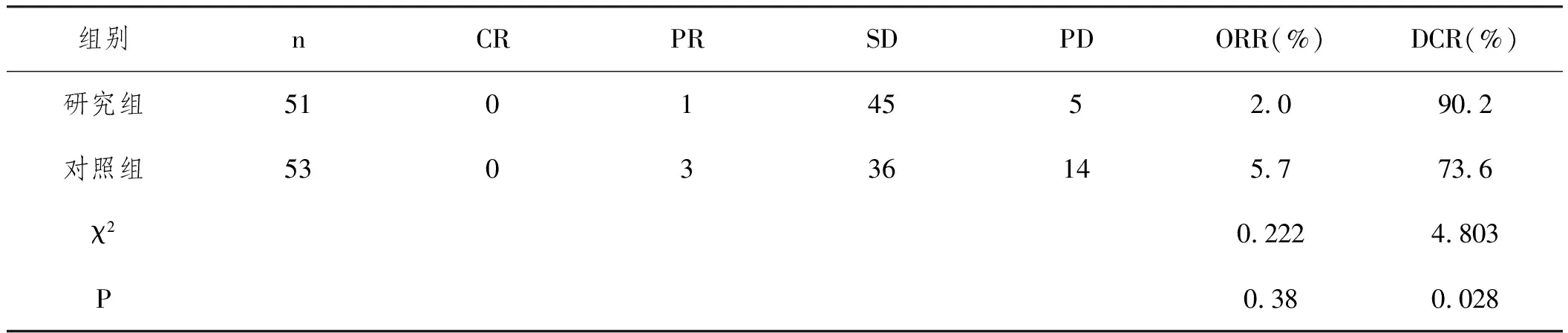
表2 两组ORR DCR的比较
2.2两组远期疗效的比较:研究组与对照组分别有6和4例患者在随访结束时仍未进展,其余病人均在随访结束时已进展。研究组的中位PFS为5.2(月)95%CI(3.176,7.224),对照组的中位PFS为4.1(月)95%CI(2.820,5.380),研究组与对照组的PFS无统计学差异(χ2=3.560,P=0.059);两组的Kaplan-Meier曲线见图1。

图1 两组患者的Kaplan-Meier曲线
2.3对两组远期疗效的PD-L1 TPS亚组分析
2.3.1对研究组的PD-L1 TPS亚组分析:为研究PD-L1 TPS评分是否影响帕博利珠单抗的疗效,将研究组按PD-L1 TPS分成TPS≥50%和TPS 1~49%两个亚组,各有3例患者在随访结束时仍未进展。研究组TPS≥50%亚组的中位PFS为6.0(月)95%CI(1.289,10.711),TPS 1~49%亚组的中位PFS为4.7(月)95%CI(3.173,6.227),研究组TPS≥50%亚组的PFS比TPS 1~49%亚组的长,差异有统计学意义(χ2=4.223,P=0.040);两亚组的Kaplan-Meier曲线见图2。
2.3.2对两组的PD-L1 TPS≥50%亚组分析:为研究PD-L1高表达患者使用哪种药物疗效更佳,将研究组和对照组分别按TPS≥50%分为两组,两组分别有3例和2例患者在随访结束时仍未进展。研究组TPS≥50%亚组的中位PFS为6.0(月)95%CI(1.289,10.711),对照组TPS≥50%亚组的中位PFS为4.2(月)95%CI(1.267,7.133),研究组TPS≥50%亚组的中位PFS比对照组的长,差异有统计学意义(χ2=5.207,P=0.023);两亚组的Kaplan-Meier曲线见图3。

图2 研究组PD-L1 TPS亚组的Kaplan-Meier曲线

图3 两组DP-L1 TPS≥50%亚组的Kaplan-Meier曲线
2.4两组不良事件率比较:本次研究不良反应事件予对症治疗后均可缓解。帕博利珠单抗组与多西他赛组相比,≥3级治疗相关不良事件(treatment-related adverse event,TRAE)发生率无明显差异(23.5%vs.20.8%)。帕博利珠单抗组免疫性肺炎发生率比多西他赛组更高(11.8%vs.0%),差异有统计学意义(χ2=4.630,P=0.031)。见表3。

表3 两组不良反应的比较n(%)
3 讨 论
对于有驱动基因突变的患者,晚期NSCLC的患者一线使用靶向药物取得了不错的疗效,但仅有小部分患者驱动基因突变检测阳性,且大多数患者在使用一代EGFR-TKI药物1年左右即出现耐药[5,6]。但是近年来,随着对于PD-1/PD-L1抑制剂的研究不断增多,PD-1/PD-L1抑制剂成为了治疗驱动基因阴性的晚期NSCLC患者的新选择[7,8]。PD-1抑制剂是一种在激活的B细胞和T细胞上表达,通常下调过度的免疫反应的免疫检查点抑制剂[9,10]。PD-1与其配体(PD-L1和PD-L2)在肿瘤细胞上的结合通过负反馈回路抑制T细胞,导致免疫反应的逃避[11]。帕博利珠单抗是一种高度选择性的、人源化的、抗PD-1的IgG4单克隆抗体。目前FDA批准帕博利珠单抗作为PD-L1表达水平≥1且EGFR/ALK基因突变阴性或未知的晚期NSCLC的二线治疗。本次研究回顾性分析了帕博利珠单抗二线治疗PD-L1 TPS≥1的含铂化疗进展后驱动基因阴性的晚期非小细胞肺癌患者的疗效及不良反应,希望对以后的帕博利珠单抗治疗提供反馈及帮助。
本研究结果示,研究组TPS≥50%亚组的中位PFS(6.0月)比TPS 1~49%亚组的中位PFS(4.7月)长(P<0.05),这表明了PD-L1 TPS评分越高,患者越可能受益。虽然对于本次研究所有PD-L1 TPS≥1的人群,未能证实帕博利珠单抗相较于多西他赛取得了PFS的获益,但在对TPS≥50%的亚组分析中,研究组的中位PFS(6.0月)比对照组的中位PFS(4.2月)长(P<0.05),这显示了对于TPS≥50%的患者,帕博利珠单抗表现出了更佳的疗效。其中在TPS≥50%的患者中,帕博利珠单抗组的OS获益更明显,与多西他赛组相比,中位OS分别为14.9(月)和8.2(月)。在两组不良反应的研究中,帕博利珠单抗组中免疫相关的不良事件(irAE)发生率为19.6%,而多西他赛组则无irAE发生。值得注意的是,在所有发生的irAE中,帕博利珠单抗组与多西他赛组免疫性肺炎发生率为11.8%vs.0%,差异有统计学意义(P=0.035),这可能与增强的PD-1/PD-L1抑制剂疗效相关[12,13]。这表明需重视帕博利珠单抗存在的irAE风险,在使用帕博利珠单抗治疗过程中,需定期复查相关检查及早预防和治疗随之出现的免疫治疗不良反应。
综上所述,帕博利珠单抗对于PD-L1 TPS≥1的含铂化疗进展后驱动基因阴性的晚期NSCLC患者可能具有更好的近期及远期疗效,且对于PD-L1 TPS≥50%的患者,使用帕博利珠单抗可能更加受益,但在安全性方面,同时需注意可能出现的免疫相关性不良反应。
