不同浓度生长因子对人脐静脉内皮细胞增殖影响的实验研究
2022-01-03魏建国段东明井一涵娄爱菊曾裕威刘子恺王簕
魏建国 段东明 井一涵 娄爱菊 曾裕威 刘子恺 王簕
广州医科大学附属第三医院1骨科,2再生医学与3D 打印转化中心(广州510150);3广州医科大学附属荔湾医院风湿科(广州510150)
组织修复是一个复杂的过程,基本包括炎症反应期,肉芽生成期,以及组织塑形期。细胞作为器官组织的基本构成单位,需要细胞大量增殖、分化来形成组织[1]。而组织修复需要生长因子在时间空间上相互调节细胞增殖、分化、成血管以及组织生长的基因表达[2]。血小板衍生生长因子(platelet derived growth factor,PDGF)是血小板α 颗粒中的一种碱性蛋白质,当PDGF 和靶细胞的受体结合后,细胞合成新的DNA,从而促进细胞有丝分裂而增殖[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种高度特异性的促血管内皮细胞生长因子,能促进血管内皮细胞的增殖分化,在血管系统发生发展过程中起着明显的调节作用[4-5]。随着医学发展,PDGF 和VEGF 将被越来越多的应用于再生修复治疗,如治疗老年性骨量丢失、糖尿病创面等[6-8]。近来,生物材料在医学再生领域研究以及应用较为火热,如水凝胶、3D 打印支架等[9-11]。这些材料基本由明胶(gelatin)或者PCL 等为基材,通过化学或物理方式对其进行改造成为生物修复材料,并负载药物如生长因子,给组织提供修复微环境以促成骨或促成血管[12-13]。
虽然生长因子对组织修复的作用很重要,但目前学术界对于如何把控生长因子的剂量使用研究鲜有报道[14-16],推测存在一个生长因子浓度,对组织修复有最佳的效应。本研究将使用不同浓度的PDGF-BB 和VEGF-A,在二维和三维培养条件下,探讨其对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖效率的影响。
1 材料与方法
1.1 主要材料PDGF-BB(近岸蛋白)、VEGF-A(MCE)、明胶(typeA,sigma)、透明质酸(40 kDa,华熙福瑞达)、lenti-eGFP(CyagenBiosciences)、HUVEC(CyagenBiosciences),tryple(Gibco)、CCK-8(碧云天)、Carbohydrazide(HDZ,Aladdin)、1-Hydroxybenzotriazolemonohydrate(HOBt,Aladdin)、1-(3-Dimethylaminopropyl)-3-ethylcarbodiimidehydrochloride(EDC,Aladdin)、(S)-3-Amino-1,2-propanedlol(Aladdin)、NaIO4(Macklin),EG(Ethylene Glycol,Macklin),ECM(EndothelialCellMedium,ScienCell),FBS(Gibco),双抗(Solarbio),荧光显微镜(OlympusIX83),酶标仪(TECANM200pro)。
1.2 实验分组在完全培养基中加入不同浓度的PDGF-BB 或者VEGF-A,按因子浓度将实验分成以下组:0 μg/mL 组(Control组)、0.02 μg/mL GFs组、0.2 μg/mL GFs 组、2 μg/mL GFs 组、5 μg/mL GFs组,每组至少设置3 个复孔。
1.3 水凝胶材料的制备作为三维培养的生物材料,用经碳酰肼改性的gelatin 和醛基修饰的HA,碳酰肼基团和醛基之间交联形成稳定的希夫碱[17],凝胶整体较为稳定。对于Gel-CDH 的合成,准备300 mL 的1%明胶水溶液,剧烈搅拌下加入6.49 g HDZ,1.1 g HOBt,调节溶液pH 4.7,反应1 h 后加入0.46 g EDC,反应过夜。第二天经0.3 mol/L NaCl,纯水透析4 d,最后冻干得Gel-CDH。对于HA-mCHO的合成,其分两步反应;首先,准备500 mL 的2%HA 水溶液,剧烈搅拌下加入4.55 g Amino,3.83 g HOBt,调节pH 6.0,反应2 h后加入1.45 g EDC,反应过夜。第二天经0.3 mol/L NaCl,纯水透析4 d,最后冻干得HA-mCHO-diol。准备482 mL 的1%HAmCHO-diol 水溶液,剧烈搅拌下,加入2.58 g NaIO4水溶液,避光反应5 min,随后加入14.95 g EG,反应2 h。0.3 mol/L NaCl,纯水透析4 d,最后冻干得HA-mCHO。
1.4 HUVEC 的培养与lenti-eGFP 的转染及观察鉴定原代HUVEC 购买于Cyagen Biosciences,使用ECM 完全培养基接种于T75 培养瓶,于37 ℃、5%CO2无菌培养箱培养。在细胞状态良好的早期代数中消化并收集细胞,重悬细胞至5 × 105/mL,再接种于24 孔板内,每孔1 mL 细胞悬液,于细胞培养箱培养。次日,将慢病毒、Polybrene 取出,于冰浴融解并保持低温状态;取20 μL/孔对应的lenti-eGFP 总量加入到对应培养基中,轻柔混匀;再加入5 μg/mL 对应的Polybrene 轻柔摇匀,吸去原有培养基,PBS 冲洗1 次;加入含lenti-eGFP 培养基;轻轻摇动培养皿,使培养基覆盖所有细胞;放入细胞培养箱中。24 h 后,吸去原有lenti-eGFP 培养基,更换为新鲜的完全培养基,得到lenti-GFP HUVEC。24 h 及72 h 观察荧光转染效果。
1.5 二维条件下给予不同浓度生长因子的GFPHUVEC培养效果观察实验对象取自上述实验经GFP 转染的HUVEC。GFP-HUVEC 按照1 × 105/mL接种于24孔板内,培养1 d以稳定细胞状态。随后,在状态良好情况下,除去孔内培养基,PBS 洗涤1 次,加入新鲜的含不同浓度PDGF-BB或者VEGF-A的1 mL 完全培养基,每天更换1 次新鲜培养基。按照预定分组,每组设置3 个复孔。在第1、4、7 天时,在荧光显微镜下观察并拍照,并使用image-Jv1.58 软件对荧光数量进行半定量分析。
1.6 二维条件下CCK-8HUVEC 增殖检测实验对象取自上述实验第4 代HUVEC,使用tryple 收集足够数量并且状态良好的HUVEC,以5 × 103/mL数量接种至24 孔板内,培养1 d 以稳定细胞状态。而后在细胞状态良好情况下,除去孔内培养基,PBS 洗涤1 次,加入新鲜的含不同浓度PDGF-BB 或者VEGF-A 的100 μL 完全培养基,每天按此换液1 次。按照预定分组,每组设置5 个复孔。在第1、4、7 天时,按照CCK-8 说明书检测OD值。
1.7 三维条件下给予不同浓度生长因子的GFPHUVEC 培养效果观察实验对象取自上述实验经GFP 转染的HUVEC。首先取Gel-CDH 制备4%的PBS 溶液于无菌EP 管中,置于37 ℃中备用。再取HA-mCHO 制备5.34%的PBS 溶液于无菌EP 管中,用0.22 μm 滤膜过滤残渣后备用。收集足够数量并且状态良好的GFP-HUVEC,用PBS 重悬至2 × 106/mL,然后以此细胞悬液稀释等量的HAmCHO 溶液至2.67%。最后,25 μL Gel-CDH 和含细胞的25 μL HA-mCHO 剧烈混合,并静置30 min以充分反应。凝胶放入24 孔板,每孔含1 mL 不同浓度PDGF-BB 或者VEGF-A 的完全培养基。每孔设置3 个复孔。在第1、4、7 天时,在荧光显微镜下观察并拍照,并使用imageJv1.58 软件对荧光数量进行半定量分析。
1.8 统计学方法实验结果数据用()表示,由统计软件SPSS 20.0 进行统计分析,graphpadprismv 8.0 进行数据绘图展示。实验各组样本结果均数采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 HUVEC 培养和慢病毒转染效果HUVEC 按照供应商的实验方法并结合本实验研究计划进行培养并转染lenti-eGFP,细胞状态良好,可以用于后续的实验(图1)。
图1 HUVEC 培养和慢病毒转染后1 d 和3 d 的效果Fig.1 Effects of HUVEC culture and lentivirus transfection on day 1 and day 3
2.2 二维条件下给予不同浓度生长因子的GFPHUVEC 培养效果为了观察镜下HUVEC 的生长情况,按照预定实验计划,除了使用完全培养基外,对实验对象额外单独添加两种不同浓度的PDGFBB 和VEGF-A,以不加生长因子作为实验对照组。在PDGF-BB 实验组内(图2a-b),在第1、4、7 天,2 μg/mL 组始终保持较高的荧光数量(P<0.01);同样,在VEGF-A 组实验组内(图2c-d),0.2 μg/mL组表现出相同趋势(P<0.05)。此外还观察到,5 μg/mL 组呈现低荧光数量。可见,2 μg/mL 的PDGFBB或者0.02 μg/mL 的VEGF-A 对HUVEC起明显促进效果(P<0.05)。
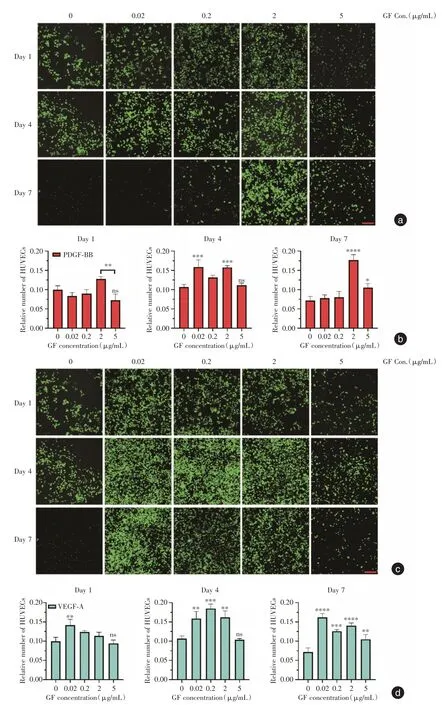
图2 不同浓度PDGF-BB 或VEGF-A 下HUVEC 在孔板中的生长情况Fig.2 Proliferation of HUVEC in plate with different concentrations of PDGF-BB or VEGF-A
2.3 二维条件下CCK-8 检测HUVEC 增殖结果为了检测在二维条件下HUVEC 的增殖情况,在给予了不同浓度PDGF-BB 或者VEGF-A 后进行了CCK-8 检测,见图3。在第1 天时,PDGF-BB 实验组内,与对照组相比,2 μg/mL 与5 μg/mL 细胞增殖情况有所下降(P<0.05),而其余组却无明显差别(P>0.05);但在第4、7 天时,2 μg/mL 组保持较高增殖活性(P<0.05)。在VEGF-A 组内,第1、4、7天时,0.02 μg/mL 组始终保持较高的增殖活性(P<0.05)。但观察到两个因子5 μg/mL 组表现较低甚至是抑制效应。说明这与上述的结果相一致,并且过高的因子浓度可能会出现抑制效应。
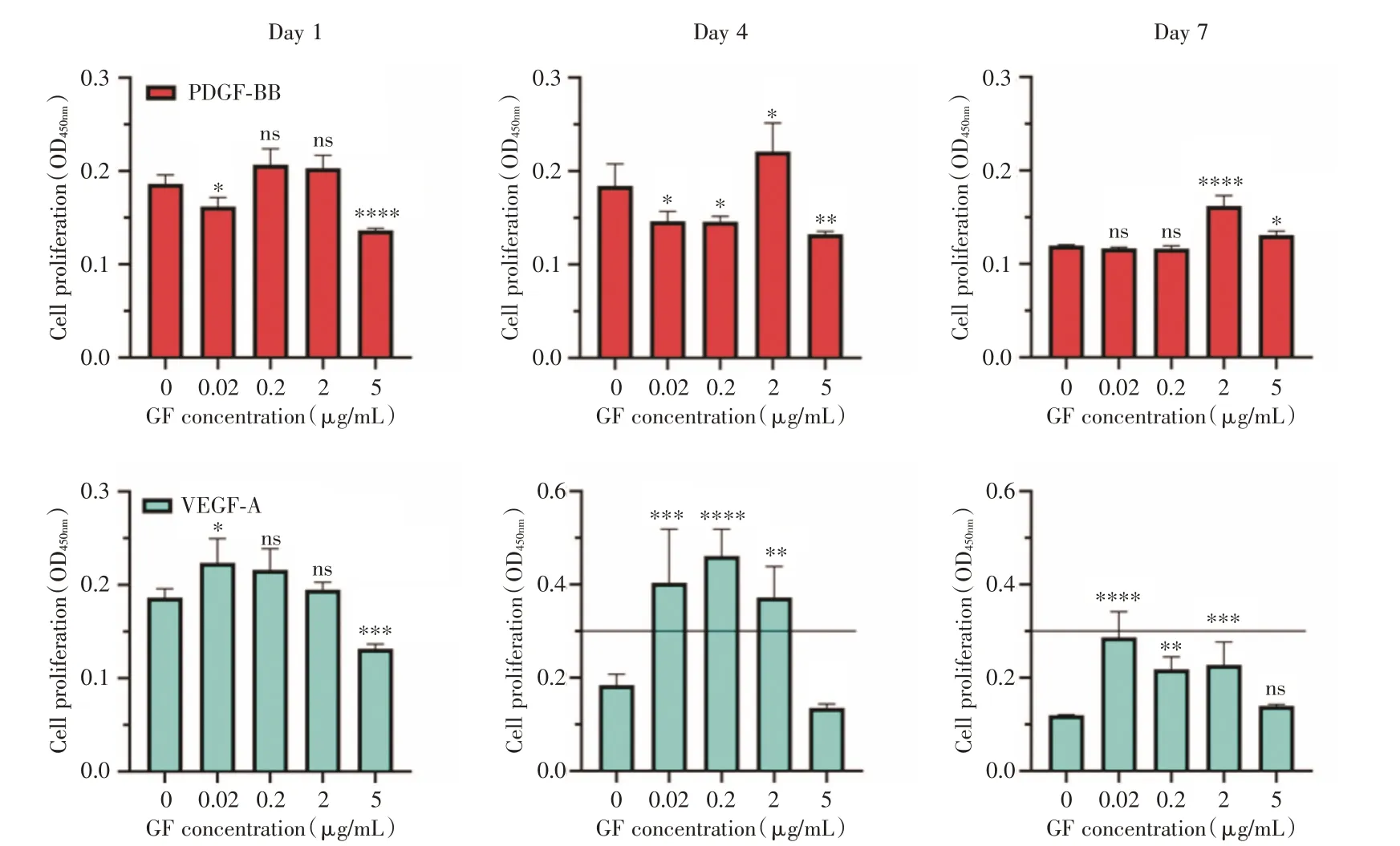
图3 CCK-8 检测不同浓度生长因子对HUVEC 增殖的影响Fig.3 Effects of different concentrations of growth factors detected by CCK-8 on HUVEC proliferation
2.4 三维条件下给予不同浓度生长因子的GFPHUVEC 培养结果按照预定实验计划,将转染了慢病毒的HUVEC 包裹进水凝胶里面,以模拟三维生长环境,并在培养基中添加不同浓度生长因子,观察其生长情况。在第1、4、7 天,PDGF-BB 组内2 μg/mL 始终表现出较多荧光数量(P<0.01)。VEGF-A 组内0.02 μg/mL 与前者表现出相同趋势(P<0.01)。说明在三维条件下,仍以2 μg/mL 的PDGF-BB 或0.02 μg/mL 的VEGF-A 对HUVEC 有更好的促进效应,过高的因子浓度可能会出现抑制,这与上面的实验结果较为相符。
3 讨论
生长因子是一类调节细胞组织正常生长代谢所必需的有机物,其可控制组织缺损修复、创面愈合等过程中的许多关键细胞活动,如新血管生成、细胞迁移与增殖等[18-19]。由于生长因子良好的修复作用,所以为各种原因导致的创伤治疗带来了新的希望。水凝胶是生物相容性较高的再生修复材料,负载生长因子之后,它可以随时间而逐渐降解并释放更多的生长因子,因而进一步促修复,形成良性循环,最终材料降解消失,组织愈合[20-21]。LIENEMANN 等[22]和贾乐宁等[23]用含生长因子的水凝胶研究修复效应,得出其能明显促进骨缺损修复和新血管生成的结论。
虽然生长因子已被广泛使用,但许多研究对其剂量的效应探讨并无详细赘述,如果在治疗修复方面每次都使用大剂量,那可能将会对患者产生过高的消费,副作用及其他未知问题[24]。在此,笔者探讨了较低浓度下的PDGF-BB 和VEGF-A 对于再生修复的效果。以GFP-HUVEC 为实验对象,将其接种在孔板上或者在水凝胶里面,再添加不同浓度的PDGF-BB 和VEGF-A 进行培养,用lenti-GFP的荧光和CCK-8 来检测,结果发现,2 μg/mL 的PDGF-BB 或0.02 μg/mL 的VEGF-A 始终对细胞表现出促进作用。
虽然已基本证实有一个浓度的生长因子对细胞表现出最佳促效应,但是在凝胶实验中还发现细胞在其中生长速率总体比在孔板中较慢。水凝胶是含大量水、少量gelatine 和HA 组成的生物材料,形成有一定密闭性的微环境,而HUVEC 生长会涉及延伸、黏附以及成网等。猜测这可能水凝胶对培养基中的物质通透、对细胞的生长限制等有关。如能对凝胶的理化性质如物质通透性等进行测试,可能将更了解该凝胶对细胞的生物兼容性。
综上所述,得出结论,2 μg/mL PDGF-BB 和0.02 μg/mL VEGF-A 对HUVEC 产生的增殖效果最好,过高浓度的生长因子对于其可能有抑制作用。但本研究只在细胞层面验证了该结论,由于体内微环境的复杂性,尚不清楚在动物模型上是否得到相同的结论。后续会在本文基础上增加动物模型实验,使结论更具可靠性。

图4 不同浓度PDGF-BB 或VEGF-A 下HUVEC 在凝胶中的生长情况Fig.4 Proliferation of HUVEC in hydrogels with different concentrations of PDGF-BB or VEGF-A
