HIV-1感染者外周血T细胞miR-155水平与免疫激活和耗竭的关系研究
2022-01-03赵增艳韦彩雯张源程林芳靳昌忠
赵增艳 韦彩雯 张源 程林芳 靳昌忠
上海交通大学医学院附属新华医院崇明分院1全科医学科,2神经内科(上海202150);3浙江大学医学院附属第一医院传染病诊治国家重点实验室(杭州310003)
HIV-1 感染者进展到艾滋病阶段的一个重要特征是存在广泛的非特异T 细胞慢性免疫激活,并能够被抗病毒治疗在一定程度上抑制[1-2]。许多T细胞免疫激活分子的表达与HIV-1感染密切相关,如CD38 和HLA-DR 等T 细胞激活标记[3-4]。由于HIV-1 难以清除并以低水平持续存在,长期刺激T 细胞激活进而导致其增殖和应答能力的缺失,即免疫耗竭[5-7]。miRNA 是细胞内一类没有编码能力的RNA,在免疫细胞发育和免疫功能调控中有重要作用[8-10]。miR-155 近年来被发现是T 细胞功能分化的重要调控因子,可以调控CD4+T 细胞分化为不同的功能亚群,参与CD8+T 细胞的激活过程[9-10]。此外,miR-155 与HIV-1 感染密切相关。有研究发现,HIV-1 感染者血浆中的miR-155水平与HIV-1 疾病进展程度有关,长期不进展者显著较低[11-13]。此外,miR-155 还可以通过其它机制来抑制HIV-1 的感染,例如降低HIV-1 感染所需的宿主蛋白的表达水平等[14-15]。目前对于miR-155 在HIV-1 感染者T 细胞免疫应答中的作用尚未明确,已有研究多是体外研究,基于HIV-1 感染者队列的体内研究较少。鉴于T 细胞免疫状态对HIV-1 感染的重要性以及miR-155 在T 细胞功能调控中的重要作用,本文重点研究HIV-1 感染者miR-155 与T 细胞免疫激活和耗竭的关系,为临床免疫状况评估提供重要的参考指标。
1 材料与方法
1.1 一般资料147 例HIV-1 感染者来自门诊确诊患者,抗病毒治疗1年以上,选取58 例体检者纳入健康对照组。排除合并其它感染、血液或免疫性疾病者,以及近期使用免疫抑制剂或其它对T 细胞功能有影响的药物的患者。HIV-1 感染者根据《中国艾滋病诊疗指南(2018 版)》[16]按照免疫学疗效分为治疗有效组(71 例)和治疗无效组(76 例)。所有参与者均知情同意,研究方案通过浙江大学医学院附属第一医院伦理委员会审核。
1.2 miR-155检测抽取患者5 mL抗凝血,分离外周血单个核细胞并用免疫磁珠(德国美天旎公司)分选CD4+和CD8+T细胞后,使用Qiagen RNeasy Micro Kit 试剂盒(德国凯杰公司)提取细胞总RNA。使用Takara 荧光定量PCR 试剂(大连宝生物公司)和人miR-155 特异性引物(广州锐博公司)进行一步法定量PCR 检测T 细胞内miR-155 水平,内参为U6 RNA,根据CT 值计算miR-155 相对表达水平。
1.3 流式细胞术使用美国BD 公司FACScanto Ⅱ流式细胞仪,抗人CD3-PE-Cy7、抗人CD38-FITC、抗人CD4-PE、抗人CD8-APC 和抗人PD-1-FITC 抗体购自BD 公司,抗体组合方案如下:CD3+CD4+CD8+CD38+和CD3+CD4+CD8+PD-1。每管取50 μL全血与抗体室温避光孵育15 min 后裂解红细胞,上机检测。
1.4 HIV-1 RNA 定量检测HIV-1 病毒载量检测使用罗氏cobas AmpliPrep/cobas TaqMan 病毒载量检测系统(瑞士罗氏公司)进行,检测下限为20 copies/mL。
1.5 统计学方法采用SPSS 20.0 软件,组间比较采用t或χ2检验,三组间比较采用单因素方差分析,相关分析采用Pearson 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况比较治疗有效组CD4+T 细胞为(584.87 ± 242.43)/μL,高于治疗无效组(374.89 ±193.46)/μL(P<0.01),CD8+T 细胞治疗有效组(548.23 ± 331.45)/μL 低于治疗无效组(865.38 ±213.56)/μL,(P<0.01)。见表1。

表1 HIV-1 感染者及健康对照组临床信息和实验室指标比较Tab.1 Comparison of clinical information and laboratory indexes between HIV-1 infected subjects and healthy controls x±s
2.2 外周血miR-155 水平比较治疗无效组CD4+和CD8+T 细胞miR-155 水平分别为(47.53±11.30)和(67.98 ± 22.73),显著高于治疗有效组[(23.87 ±6.54)vs.(34.69 ± 12.78)]和健康对照组[(12.76 ±5.35)vs.(17.87±9.65)](均P<0.05)。见表1。
2.3 T 细胞免疫激活和耗竭水平比较治疗无效组CD4+和CD8+T 细胞免疫激活水平(CD38+%)最高,分别为(43.88±14.92)%和(56.93±15.79)%,治疗有效组分别为(27.42±8.65)%和(38.87±9.13)%,高于健康对照组(P<0.01)。见表1。
治疗无效组T 细胞免疫耗竭水平(PD-1+%)最高,分别为(37.82 ± 16.48)%和(44.68 ± 20.37)%,治疗有效组T 细胞免疫耗竭水平亦高于健康对照组,除治疗有效组CD4+PD-1+%与健康对照之间差异外,其余差异均有统计学意义(P<0.01)。见表1。
2.4 外周血T 细胞miR-155 水平与免疫激活和耗竭指标的相关性分析HIV-1 感染者T 细胞miR-155 水平与免疫激活和耗竭正相关(P<0.05),健康对照组T 细胞miR-155 与细胞激活呈正相关(P<0.05),与免疫耗竭相关性不显著(P>0.05)。见表2。
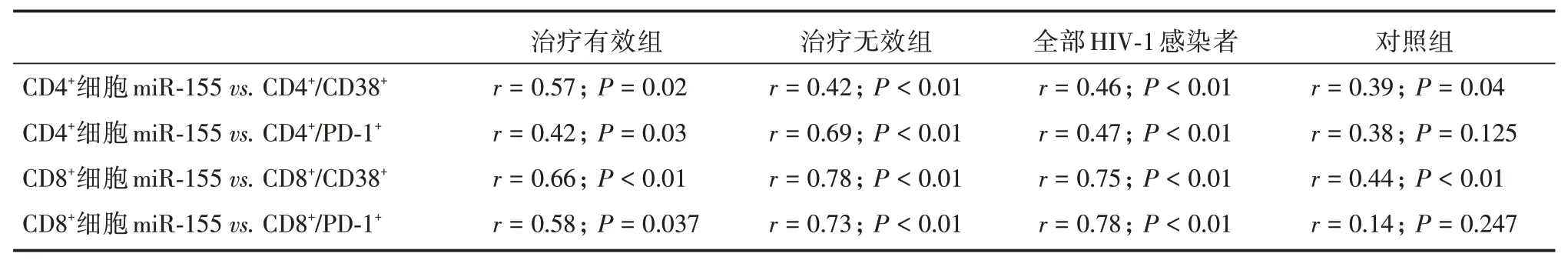
表2 外周血T 细胞miR-155 水平与免疫激活和耗竭指标的相关性分析Tab.2 Correlation analysis of miR-155 level and immune activation and exhaustion in T cells
3 讨论
有效的抗病毒治疗能够对感染者的免疫功能和状态起到一定的恢复作用[17-18]。除了CD4+T 细胞数量和比例这一经典指标外,T 细胞免疫激活、耗竭等指标及其调控因素对判断HIV-1 感染者免疫状态有重要的临床价值[19-20]。本文通过对抗病毒治疗有效和无效的HIV-1 感染者以及健康对照进行横断面观察研究发现,HIV-1 感染者T 细胞miR-155 表达、免疫激活和耗竭水平均显著升高,以治疗无效者更显著,miR-155 与免疫激活和耗竭水平正相关。这表明HIV-1 感染能提高T 细胞miR-155 表达,并影响T 细胞激活和耗竭水平,有效的抗病毒治疗可以部分逆转这一改变。但研究未发现miR-155 与HIV-1 载量存在直接相关性。
miR-155 可以通过多种机制影响HIV-1 感染。有研究发现HIV-1 感染者效应型调节性T 细胞miR-155表达水平高于未感染者[11-12]。miR-155能降低树突状细胞表面协同受体的表达以抑制HIV-1的感染能力[15]。本研究发现,miR-155 可通过调节T 细胞免疫激活和耗竭水平来影响感染的进展。持续的非特异性T 细胞免疫激活是HIV-1 感染造成T 细胞免疫功能缺陷的主要因素[21]。miR-155能够调节CD8+T 细胞不同亚群的增殖和分化,维持记忆型和效应记忆型CD8+T 细胞的比例[22]。本研究发现miR-155 对于维持HIV-1 感染者的CD4+T 细胞的免疫激活状态也很重要。PD-1 是一种免疫抑制性受体,与T 细胞免疫耗竭相关[7]。本研究发现HIV-1 感染者T 细胞表面PD-1 表达升高,有效的抗病毒治疗能够部分降低PD-1 的表达水平,这与既往研究一致[21]。但本研究并没有发现T 细胞表面PD-1 表达水平与病毒载量和CD4+T 细胞数存在相关性,而是与miR-155 相关,提示miR-155可能参与了T 细胞的免疫耗竭调控。
本研究存在一定的局限性,仅对HIV-1 感染者的T 细胞免疫状态和miR-155 水平等指标进行了横断面研究,仅揭示了miR-155 与T 细胞免疫激活和耗竭的相关性,未阐明三者间的因果关系和相互作用机制。许多问题还有待于通过队列随访和机制研究进一步探索。如T 细胞的免疫耗竭由免疫激活导致还是由miR-155 直接调控的机制,HIV-1感染是如何改变miR-155 表达水平,以及抗病毒治疗恢复miR-155 水平和T 细胞免疫功能的原理。
总之,本研究结果提示miR-155 参与了HIV-1感染者T 细胞免疫激活和耗竭的调控,抗病毒治疗能够一定程度上抑制miR-155 表达水平并部分恢复T 细胞免疫功能。检测T 细胞miR-155 水平可为临床评估HIV-1 感染者T 细胞功能提供重要的参考。
